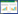文章信息
- 穆盛田, 唐洁, 阎东莉, 郑振
- MU Shengtian, TANG Jie, YAN Dongli, ZHENG Zhen
- 乌司他丁通过抑制氧化应激反应改善TNF-α引起的人肺微血管内皮细胞屏障功能障碍
- Ulinastatin ameliorates TNF-α-induced human pulmonary microvascular endothelial barrier dysfunction by inhibiting oxidative stress
- 中国医科大学学报, 2020, 49(1): 52-57
- Journal of China Medical University, 2020, 49(1): 52-57
-
文章历史
- 收稿日期:2019-05-24
- 网络出版时间:2019-12-11 15:15
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是目前危重症领域常见且死亡率极高的一种临床综合征[1]。临床上以急性呼吸窘迫和呼吸衰竭为特点,可由脓毒症、创伤、休克等多种因素引起。病理生理上以毛细血管内皮细胞损伤导致的毛细血管渗漏和弥漫性肺水肿为特点,过度的全身和局部炎症反应被认为是其最主要的发病机制。近年来,过度的炎症反应引起的氧化应激损伤以及氧化应激产物过度释放导致的炎症反应进一步扩大已经越来越引起临床和基础研究的关注[2]。
乌司他丁作为一种从健康人尿液中提取的胰蛋白酶抑制剂,是人体中重要的内源性抑炎物质,可以抑制多种蛋白水解酶的活性,同时还可以调节炎性细胞因子的释放,并有效抑制氧自由基的产生,临床早期多用于急性重症胰腺炎的治疗。随着研究的逐步深入,乌司他丁还用于脓毒症、休克、缺血再灌注损伤以及多器官功能障碍等多种临床综合征的救治,它可以改善机体组织灌注损伤,具有保护脏器功能的作用[3-6]。已有临床研究[7]发现,乌司他丁可以改善ARDS患者的预后,但其具体的作用机制目前尚不明确。本研究探讨了乌司他丁对肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)引起的人肺微血管内皮细胞(human pulmonary microvascular endothelial cells,HPMECs)屏障功能破坏的保护作用及可能机制。
1 材料与方法 1.1 材料HPMECs购自上海拜力生物技术有限公司;TNF-α和N-乙酰半胱氨酸(N-acetyl-cysteine,NAC)购自美国Sigma公司;乌司他丁(国药准字H19990134,10万U/支)购自广东天普生化医药股份有限公司;血管内皮钙黏蛋白(vasscular endothelial cadherin,VE-cadherin)抗体购自英国Abcam公司;一氧化氮(nitric oxide,NO)检测试剂盒购自南京建成生物科技有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒购自碧云天生物技术公司。
1.2 细胞培养及分组HPMECs培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2饱和湿度的Thermo培养箱中培养,每隔1~2 d换液1次。将无血清的DMEM培养基加入待实验细胞后2 h进行分组处理,分为对照组,TNF-α组(给予10 ng/mL的TNF-α刺激HPMECs 6 h),TNF-α+乌司他丁组(给予TNF-α前30 min分别给予10、100和1 000 U/mL的乌司他丁),TNF-α+NAC组(给予TNF-α前30 min给予1 mmol/L的NAC)。
1.3 细胞内ROS的检测应用无血清DMEM培养基稀释荧光剂(DCFH-DA)至浓度10 μmol/L,取2 mL加至6孔细胞培养板中,于培养箱孵育30 min后弃上清,用无血清培养基清洗,重复3次后检测ROS表达。在Leica DMi8荧光显微镜(德国徕卡公司)下可观察到绿色荧光,应用Image J测量荧光值并计算,从而反映ROS的产生。
1.4 细胞上清液中NO的检测收集各组细胞上清液,置于EP管中超低温冰箱保存待测。根据NO检测试剂盒说明书,采用硝酸还原酶法测定NO含量。在波长540 nm处检测吸光度值,计算NO含量。
1.5 电阻抗法检测Transwell小室内单层细胞电阻值选择Transwell小室(美国Corning公司)种植和培养HPMECs,于上室均匀接种细胞1.5×105/孔,体积为100 μL,下室加入HPMECs培养液600 μL,于37℃、5%CO2细胞培养箱内培养。小室种完细胞后第1和3天换液,生长到第4天细胞融合,更换为无胎牛血清的DMEM培养基饥饿2 h,使细胞同步化后用于实验。应用Millicell® ERS-2电阻仪(美国默克公司)检测各组HPMECs的跨内皮细胞电阻(transendothelial electrical resistance,TEER)值。
1.6 荧光分光光度计检测Transwell小室内透过单层细胞的FITC-dextran应用无胎牛血清的DMEM培养液配置不同浓度的FITC-dextran,制作标准曲线,细胞同步化后不同分组细胞在Transwell上下室分别加入相关试剂,之后将1 mg/mL的FITC-dextran 100 μL加入上室,避光、37 ℃、5%CO2孵箱孵育1 h,从下室提取100 μL样品后,荧光分光光度计检测下室样品的荧光能量值(激发波长494 nm,发射波长520 nm)。根据标准曲线计算和测得样品的荧光能量值,计算透过Transwell小室的FITC-dextran的浓度(μg/mL)。
1.7 免疫荧光检测VE-cadherin将HPMECs均匀种植在细胞培养盖玻片上,待细胞爬片培养至80%~90%融合度后,应用4%多聚甲醛固定,0.1% TritonX-100溶液透化,5%胎牛血清蛋白封闭,加入200 μL配置好的VE-cadherin一抗工作液(1:200) 4 ℃冰箱孵育过夜,加入200 μL配置好的Alexa Fluor® 488二抗工作液(1:200)室温避光下孵育1 h,5 μg/mL的DAPI室温避光下染色2 min,将盖玻片倒扣在滴有甘油的载玻片上,应用Leica DMi8荧光显微镜观察并保存图像。
1.8 Western blotting法检测VE-cadherin裂解、提取细胞蛋白,BCA法测定蛋白含量,经SDS-PAGE凝胶电泳后转膜,Tris缓冲液洗涤,室温下脱脂奶粉封,VE-cadherin一抗工作液(1:1 000) 4 ℃冰箱孵育过夜,Tris缓冲液冲洗后加辣根过氧化物酶标记的羊抗兔IgG抗体室温下孵育,免疫印迹化学发光法显色,凝胶图像处理系统分析目标条带。
1.9 统计学分析应用Graphpad Prism 6.0软件分析数据,实验结果以x±s表示,2组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同剂量乌司他丁对TNF-α刺激HPMECs产生ROS的影响与对照组比较,TNF-α组和TNF-α+10 U/mL乌司他丁组细胞内ROS生成量明显增加(P < 0.05);TNF-α组与TNF-α+10 U/mL乌司他丁组比较,ROS生成量无统计学差异(P > 0.05);TNF-α+100 U/mL乌司他丁组和TNF-α+1 000 U/mL乌司他丁与TNF-α组比较,ROS生成量明显减少(P < 0.05),这与TNF-α+NAC组作用相似。见图 1。
|
| A,immunofluorescence images (×200);B,quantitative analysis. * P < 0.05 vs control group;# P < 0.05 vs TNF-α group. 图 1 免疫荧光法检测各组ROS生成量 Fig.1 ROS detected by immunofluorescence in each group of HPMECs |
2.2 不同剂量乌司他丁对TNF-α刺激HPMECs产生NO的影响
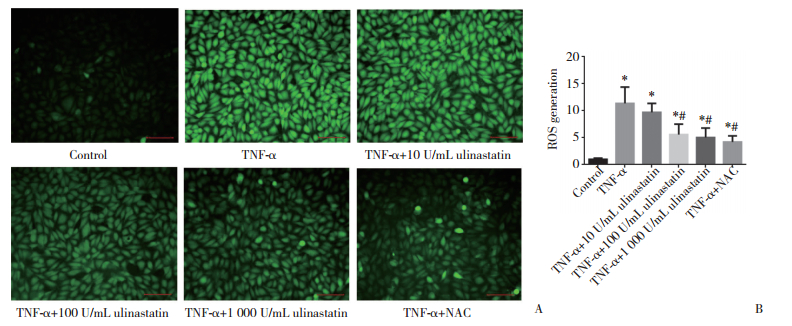
与对照组比较,TNF-α组和TNF-α+10 U/mL乌司他丁组细胞NO生成量明显增加(P < 0.05);TNF-α组与TNF-α+10 U/mL乌司他丁组比较,NO生成量无统计学差异(P > 0.05);TNF-α+100 U/mL乌司他丁组和TNF-α+1 000 U/mL乌司他丁与TNF-α组比较,NO生成量明显减少(P < 0.05),这与TNF-α+NAC组作用相似。见图 2。
|
| *P < 0.05 vs control group;#P < 0.05 vs TNF-α group. 图 2 硝酸还原酶法测定各组NO含量 Fig.2 NO detected by the nitrate reductase method in each group of HPMECs |
2.3 乌司他丁对TNF-α引起的HPMECs屏障功能破坏的保护作用
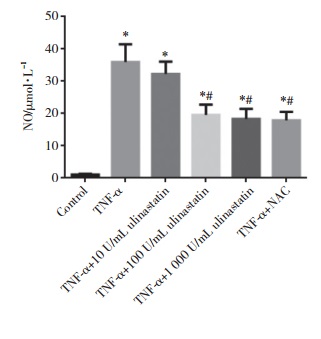
应用Millicell® ERS-2电阻仪检测Transwell小室单层HPMECs的TEER值。0 h时,各组间TEER值无统计学差异(P > 0.05);6 h后,TNF-α组单层HPMECs的TEER值较对照组明显降低(P < 0.05);TNF-α+100 U/mL乌司他丁组和TNF-α+NAC组与TNF-α组比较,TEER值明显升高(P < 0.05)。见图 3A。
|
| A,TEER after 6 hours;B,FITC-dextran. *P < 0.05 vs control group;#P < 0.05 vs TNF-α group. 图 3 各组单层HPMECs的TEER和透过单层细胞的FITC-dextran浓度 Fig.3 TEER and the influx of FITC-dextran across the monolayer of HPMECs in each group |
通过荧光分光光度仪检测透过Transwell小室单层HPMECs的FITC-dextran浓度。TNF-α组与对照组比较,透过HPMECs的FITC-dextran明显增加(P < 0.05);TNF-α+100 U/mL乌司他丁组和TNF-α+NAC组与TNF-α组比较,透过内皮细胞的FITC-dextran明显减少(P < 0.05)。这表明乌司他丁可以通过抑制氧化应激反应,改善TNF-α刺激HPMECs引起的内皮屏障功能破坏。见图 3B。
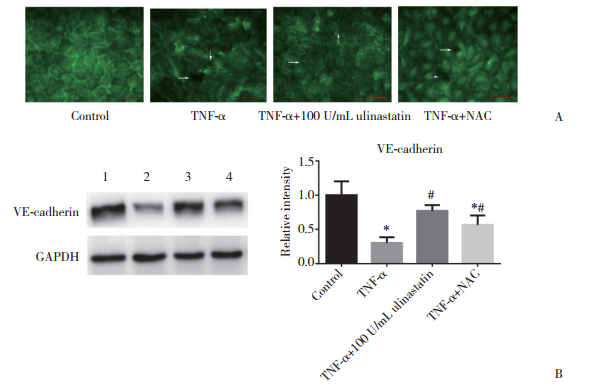
2.4 乌司他丁对TNF-α刺激HPMECs引起的VE-cadherin表达减少的保护作用对照组VE-cadherin主要在内皮细胞周边表达,内皮细胞间连接紧密。TNF-α组HPMECs中VE-cadherin表达减少,尤其是细胞周边,引起细胞间隙增大。而TNF-α+100 U/mL乌司他丁组和TNF-α+NAC组与TNF-α组比较,VE-cadherin表达增加。见图 4A。
|
| A,immunofluorescence images (×400);B,Western blotting results. Arrows indicate intercellular gaps. 1,control group;2,TNF-α group;3,TNF-α+100 U/mL ulinastatin group;4,TNF-α+NAC group. *P < 0.05 vs control group;#P < 0.05 vs TNF-α group. 图 4 免疫荧光染色和Western blotting检测各组VE-cadherin表达 Fig.4 The expression of VE-cadherin detected by immunofluorescence and Western blotting in each group of HPMECs |
Western blotting结果进一步证明了TNF-α组HPMECs中VE-cadherin表达减少,而TNF-α+100 U/mL乌司他丁组和TNF-α+NAC组与TNF-α组比较,VE-cadherin表达明显增加(P < 0.05)。这表明乌司他丁可以通过抑制氧化应激反应,改善TNF-α刺激HPMECs引起VE-cadherin表达减少。见图 4B。
3 讨论ARDS目前仍然是危重症领域研究的主要热点问题之一,因为其发病机制的复杂性,临床尚缺少有效的治疗手段,尤其是中重度ARDS,临床病死率接近50%[1]。目前已经证实过度的炎症反应是其主要的发病机制之一,TNF-α等炎性细胞因子大量释放可引起肺毛细血管内皮细胞屏障功能破坏,导致毛细血管渗漏,引起弥漫性肺间质及肺泡水肿。近年来,越来越多的研究[2, 8]发现氧化应激反应在脓毒症及ARDS中发挥非常重要的作用。过度释放的炎性细胞因子可以通过激活中性粒细胞等炎症细胞促进ROS等氧自由基产生,后者可以通过激活钙离子通道调节内皮细胞的屏障功能,从而造成内皮细胞通透性增加[3]。有研究[9]发现,抗氧化应激治疗可以保护ARDS过程中受损的内皮屏障功能。
乌司他丁作为一种人尿液中提取出来的胰蛋白酶抑制剂,具有抑制蛋白酶活性、调节炎性细胞因子释放的作用;同时作为一种糖蛋白,还可以稳定溶酶体膜,能够减少溶酶体酶的合成和传递,从而清除多种氧自由基,发挥保护作用。因此,乌司他丁广泛用于临床脓毒症、休克、胰腺炎等危重疾病的救治。近年研究[7, 10]发现,乌司他丁可以改善ARDS患者的预后,但其机制目前尚不十分明确。2014年发表的一项meta分析[7]结果显示,乌司他丁可以降低ARDS患者ICU内的病死率,但并不改变患者的28 d病死率,乌司他丁可以改善ARDS患者的氧合,同时减少患者的住院时间。近期发表的临床研究[10]也发现,乌司他丁联合机械通气治疗ARDS,除了可以减少患者TNF-α及白细胞介素(interlenkin,IL)-6等炎性细胞因子的过度释放,还可以增加患者体内丙二醛、超氧化物歧化酶和总抗氧化能力水平。关于乌司他丁在ARDS过程中的保护机制,目前大多数基础研究认为乌司他丁可以通过抑制过度的炎症反应,在ARDS过程中发挥保护作用。早期的研究[11]发现,乌司他丁能显著降低烧伤大鼠血浆及肺组织中TNF-α、IL-1β、IL-6和IL-8的水平,可以抑制中性粒细胞弹性蛋白酶和髓过氧化物酶的分泌。近期又有研究[12]发现,乌司他丁可以通过抑制Toll样受体4/核转录因子-κB信号通路的激活和减少炎症介质来保护脂多糖引起的急性肺损伤。但有关其对氧化应激损伤及肺血管通透性的研究较少。近期有基础研究[13]发现,乌司他丁可以通过抑制氧化应激损伤引起的内皮细胞凋亡来保护血管内皮的通透性。本研究通过免疫荧光和ELISA方法也发现,乌司他丁的确可以减少TNF-α刺激HPMECs后产生的ROS和NO,并且呈一定程度的剂量依赖性。这也直接说明乌司他丁的确可以抑制炎性细胞因子刺激产生的过度的氧化应激损伤。
肺微血管内皮细胞作为脓毒症及ARDS损伤的主要靶细胞,其屏障功能障碍是目前基础研究的热点问题,甚至有研究认为内皮损伤的生物标志物可以帮助鉴别ARDS的病因及预后评估,但有关乌司他丁在ARDS过程中如何保护血管内皮细胞的机制目前尚不清楚。近期有研究[14]发现,乌司他丁可能通过保护内皮细胞表面的多糖包被及抑制肝素酶的活性来改善ARDS时肺血管内皮的屏障功能。还有研究[15]发现,乌司他丁可以通过RhoA/ROCK信号通路直接改善炎症引起的内皮细胞通透性增加。本研究通过检测Transwell小室单层内皮细胞TEER值及采用荧光分光光度仪检测透过Transwell的FITC-dextran,发现乌司他丁及NAC的确可以保护TNF-α刺激HPMECs引起的内皮细胞通透性增加,进一步通过免疫荧光和Western blotting发现,乌司他丁和NAC均可以增加TNF-α刺激HPMECs引起的内皮细胞VE-cadherin表达下降,后者是影响肺微血管内皮细胞黏附连接的重要蛋白。近期有研究[16]显示,乌司他丁可能是通过抑制VE-cadherin的Tyr658位点磷酸化来增加VE-cadherin的表达,从而保护内皮细胞的屏障功能。
综上所述,乌司他丁可以通过减少TNF-α刺激HPMECs引起的ROS和NO过度释放从而改善内皮细胞的屏障功能。本研究为临床应用乌司他丁治疗ARDS提供了新的理论依据,但还需要更深一步的机制研究和动物实验证实。
| [1] |
BELLANI G, LAFFEY JG, PHAM T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [2] |
KELLNER M, NOONEPALLE S, LU Q, et al. ROS signaling in the pathogenesis of acute lung injury (ALI) and acute respiratory distress syndrome (ARDS)[J]. Adv Exp Med Biol, 2017, 967: 105-137. DOI:10.1007/978-3-319-63245-2_8 |
| [3] |
KARNAD DR, BHADADE R, VERMA PK, et al. Intravenous administration of ulinastatin (human urinary trypsin inhibitor) in severe sepsis:a multicenter randomized controlled study[J]. Intensive Care Med, 2014, 40(6): 830-838. DOI:10.1007/s00134-014-3278-8 |
| [4] |
LI XF, ZHANG XJ, ZHANG C, et al. Ulinastatin protects brain against cerebral ischemia/reperfusion injury through inhibiting MMP-9 and alleviating loss of ZO-1 and occludin proteins in mice[J]. Exp Neurol, 2018, 302: 68-74. DOI:10.1016/j.expneurol.2017.12.016 |
| [5] |
ZHAO YM, CAI HB, ZHOU PM, et al. Protective effect of ulinastatin on hepatic ischemia reperfusion injury through autophagy activation in Chang liver cells[J]. J Cell Biochem, 2019, 120(9): 14960-14970. DOI:10.1002/jcb.28758 |
| [6] |
ATAL SS, ATAL S. Ulinastatin-a newer potential therapeutic option for multiple organ dysfunction syndrome[J]. J Basic Clin Physiol Pharmacol, 2016, 27(2): 91-99. DOI:10.1515/jbcpp-2015-0003 |
| [7] |
LENG YX, YANG SG, SONG YH, et al. Ulinastatin for acute lung injury and acute respiratory distress syndrome:a systematic review and meta-analysis[J]. World J Crit Care Med, 2014, 3(1): 34-41. DOI:10.5492/wjccm.v3.i1.34 |
| [8] |
PRAUCHNER CA. Oxidative stress in sepsis:pathophysiological implications justifying antioxidant co-therapy[J]. Burns, 2017, 43(3): 471-485. DOI:10.1016/j.burns.2016.09.023 |
| [9] |
CHEN L, LI W, QI D, et al. Lycium barbarum polysaccharide protects against LPS-induced ARDS by inhibiting apoptosis, oxidative stress, and inflammation in pulmonary endothelial cells[J]. Free Radic Res, 2018, 52(4): 480-490. DOI:10.1080/10715762.2018.1447105 |
| [10] |
JI MX, CHEN TJ, WANG BM, et al. Effects of ulinastatin combined with mechanical ventilation on oxygen metabolism, inflammation and stress response and antioxidant capacity of ARDS[J]. Exp Ther Med, 2018, 15(6): 4665-4670. DOI:10.3892/etm.2018.6012 |
| [11] |
FANG Y, XU P, GU C, et al. Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response[J]. J Trauma, 2011, 71(5): 1297-1304. DOI:10.1097/TA.0b013e3182127d48 |
| [12] |
CAO C, YIN CF, SHOU ST, et al. Ulinastatin protects against LPS-induced acute lung injury by attenuating TLR4/NF-κB pathway activation and reducing inflammatory mediators[J]. Shock, 2018, 50(5): 595-605. DOI:10.1097/SHK.0000000000001104 |
| [13] |
LI GC, LI T, LI YF, et al. Ulinastatin inhibits oxidant-induced endothelial hyperpermeability and apoptotic signaling[J]. Int J Clin Exp Pathol, 2014, 7(11): 7342-7350. |
| [14] |
WANG LP, HUANG X, KONG GQ, et al. Ulinastatin attenuates pulmonary endothelial glycocalyx damage and inhibits endothelial heparanase activity in LPS-induced ARDS[J]. Biochem Biophys Res Commun, 2016, 478(2): 669-675. DOI:10.1016/j.bbrc.2016.08.005 |
| [15] |
WEI F, LIU SY, LUO L, et al. Anti-inflammatory mechanism of ulinastatin:inhibiting the hyperpermeability of vascular endothelial cells induced by TNF-α via the RhoA/ROCK signal pathway[J]. Int Immunopharmacol, 2017, 46: 220-227. DOI:10.1016/j.intimp.2017.03.007 |
| [16] |
CHEN J, WANG J, SU CL, et al. Urinary trypsin inhibitor attenuates LPS-induced endothelial barrier dysfunction by upregulation of vascular endothelial-cadherin expression[J]. Inflamm Res, 2016, 65(3): 213-224. DOI:10.1007/s00011-015-0907-9 |
 2020, Vol. 49
2020, Vol. 49