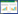文章信息
- 付昱, 李昕, 韩冬, 郭靖宇, 王艺霖, 张鸿
- FU Yu, LI Xin, HAN Dong, GUO Jingyu, WANG Yilin, ZHANG Hong
- 二氮嗪对氧糖剥夺后BV-2细胞凋亡及caspase-3表达的影响
- Effects of diazoxide on apoptosis and caspase-3 expression after oxygen-glucose deprivation in BV-2 cells
- 中国医科大学学报, 2020, 49(1): 31-34
- Journal of China Medical University, 2020, 49(1): 31-34
-
文章历史
- 收稿日期:2019-01-08
- 网络出版时间:2019-12-12 8:45
ATP敏感性钾通道(ATP-sensitive potassium channels,KATP)开放剂可以对脑缺血/再灌注损伤中的神经元及血脑屏障相关蛋白发挥保护作用[1-2],但对于小胶质细胞的作用及相关信号通路仍不清楚。二氮嗪是一种线粒体KATP开放剂,研究[2]表明二氮嗪可以在大鼠脑缺血/再灌注模型中对神经细胞及血脑屏障相关蛋白起保护作用。BV-2细胞是小鼠小胶质细胞,常用作小胶质细胞模型,用无糖血清和三气培养箱创造氧糖剥夺条件对BV-2细胞进行处理,可模拟缺血缺氧状态下的细胞微环境。本研究拟通过氧糖剥夺诱导的BV-2细胞探讨二氮嗪对缺血缺氧状态下小胶质细胞的影响。
1 材料与方法 1.1 主要仪器及试剂HERA Cell 150三气培养箱(美国Billups-Rothenberg公司),FACScalibur流式细胞检测分析仪(美国BD公司),Eclipse NI正置荧光显微镜+图像采集系统(日本尼康公司),RPMI1640培养基、新生胎牛血清、无糖DMEM培养基(美国Gibco公司),AV/PI凋亡试剂盒(苏州宇恒生物科技有限公司),caspase-3抗体、FITC标记二抗(美国Proteintech Group公司)。
1.2 方法 1.2.1 细胞培养小胶质细胞系BV-2细胞用含有20%胎牛血清的RPMI1640完全培养基在37 ℃、5% CO2培养箱中培养,每48 h更换培养基1次。
1.2.2 分组建模及给药将4个培养皿的BV-2细胞传代2 d后,分为A、B、C、D 4组。A组为对照组;B组更换为无糖无血清培养基并移至HERA Cell 150三气培养箱中进行氧糖剥夺建模,持续充以10%CO2和90%N2,在此条件下培养6 h后复氧,更换为常氧、原培养液条件下再培养24 h;C组在氧糖剥夺处理之前给予二氮嗪100 μmol/L;D组在氧糖剥夺处理之前给予二氮嗪100 μmol/L+5-羟葵酸(5-hydroxydecanoate,5-HD)100 μmol/L。
1.2.3 流式细胞术检测BV-2细胞的凋亡用含0.25%EDTA的胰酶对BV-2细胞进行消化处理,每样本细胞数在1×105~5×105范围内,收集细胞后在高速冷冻离心机中以300 g离心5 min,弃去上清培养液。加入PBS 500 μL洗涤2次,再以300 g离心5 min。弃去上清培养液后,加入100 μL流式缓冲液进行重悬,采用AnnexinV-FITC/PI双染法,每管先加入5 μL AnnexinV-FITC,混匀后再加入2 μL PI工作液振荡混匀,所有操作均在冰上进行。于室温下避光孵育15 min,1 h内上流式细胞仪检测。
1.2.4 免疫细胞荧光染色检测cleaved caspase-3蛋白表达待培养皿中的BV-2细胞培养至对数生长期,以104/孔铺于6孔板,待细胞生长至镜下视野的70%~80%,PBS洗3次,每次3 min。用4%多聚甲醛在-20 ℃固定20 min,PBS洗3次,每次3 min。5%BSA室温封闭1 h。加入caspase-3一抗(稀释1︰100),在湿盒中4 ℃过夜。PBS洗3次,每次3 min。加二抗(PBS稀释1︰100),室温避光孵育4 h,PBS洗3次,每次3 min。加入DAPI染色剂200 μL,室温避光孵育5 min。PBS洗4次,每次5 min。加入50 μL抗荧光淬灭剂封片,利用荧光显微镜观察蛋白定位并测定蛋白平均光密度值(IOD)。
1.2.5 免疫印迹实验检测cleaved caspase-3蛋白表达情况收集BV-2细胞至EP管,用RIPA提取总蛋白,BCA蛋白定量,高温变性。各组取40 g蛋白行10%SDS-PAGE凝胶电泳,110 V、86 mA恒压转印至PVDF膜。5 %脱脂奶粉常温封闭2 h。加入一抗(anti-cleaved caspase-3稀释1︰1 000及anti-β-actin稀释1︰5 000)4 ℃摇床过夜。加入二抗(1︰200与HRP2结合)孵育2 h,ECL染色,凝胶图像分析仪扫描图像,用Image J软件分析蛋白条带灰度,计算目的蛋白灰度值/内参蛋白灰度值。
1.3 统计学分析应用SPSS 22.0软件进行统计学分析,数据以x±s表示,组内两两比较采用独立样本t检验,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组BV-2细胞凋亡情况流式细胞术结果显示,B、C、D组凋亡率均有升高,与A组比较差异均有统计学意义(P < 0.01);B、D组凋亡率升高较C组显著,差异有统计学意义(P < 0.01),B组和D组比较差异无统计学意义(P > 0.05)。见图 1。
|
| A, control group; B, oxygen-glucose deprivation/reperfusion (OGD/R) group; C, OGD/R+diazoxide group; D, OGD/R+diazoxide+5-hydroxydecanoate (5-HD) group. *P < 0.01 vs control group. 图 1 各组BV-2细胞凋亡率 Fig.1 Apoptosis rate of BV-2 cells in different groups |
2.2 cleaved caspase-3蛋白的表达情况
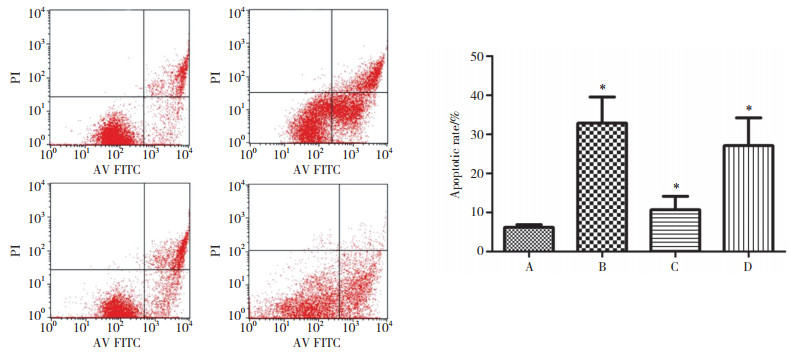
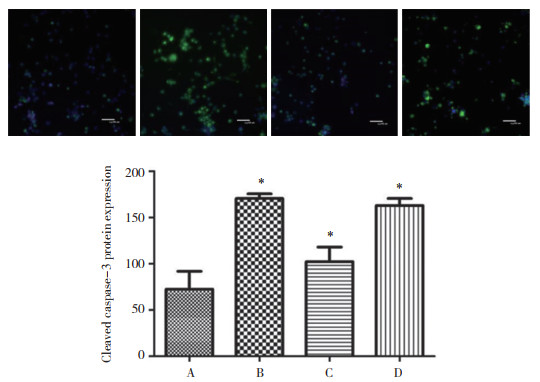
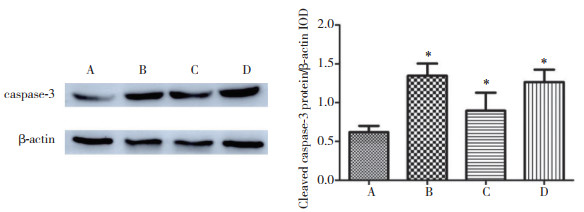
免疫荧光染色和免疫印迹检测结果显示,4组细胞内均可见cleaved caspase-3蛋白表达。B、C、D组表达均高于A组,但C组低于B、D组,差异均有统计学意义(均P < 0.01)),B组和D组比较无统计学差异(P > 0.05)。见图 2~3。
|
| A, control group; B, OGD/R group; C, OGD/R+diazoxide group; D, OGD/R+diazoxide+ 5-HD group. *P < 0.01 vs control group. Bar=50 μm. 图 2 各组BV-2细胞cleaved caspase-3蛋白的表达(免疫荧光染色) Fig.2 Expression of cleaved caspase-3 protein in different groups(immunafluorescence) |
|
| A, control group; B, OGD/R group; C, OGD/R+diazoxide group; D, OGD/R+diazoxide+5-HD group. *P < 0.01 vs control group. 图 3 各组cleaved caspase-3蛋白的表达水平(Western blotting) Fig.3 Expression levels of cleaved caspase-3 protein in different groups(Western blotting) |
3 讨论
卒中是全球成人致死致残的主要病因,随着我国经济水平不断提高,卒中已逐步成为我国仅次于心脏疾病和肿瘤的第三大致死病因。虽然对于卒中发生的分子和细胞机制的了解越来越深入,但是目前仍然没有非常有效的治疗药物。
脑内的神经元、星形胶质细胞、血管内皮细胞、细胞外基质、周细胞以及小胶质细胞等组成神经血管单元[3]。神经血管单元中的小胶质细胞作为“中枢神经系统的巨噬细胞”,在神经系统疾病中的作用一直为众多学者所关注[4-6],特别是小胶质细胞在脑缺血/再灌注损伤中的反应,被作为一个重要的治疗靶点加以研究[7-8]。前期研究[9-11]显示,KATP开放剂吡那地尔能够明显减轻大鼠脑缺血/再灌注后的神经功能损伤,减小梗死区体积,并通过激活PI3K/Akt/Bcl-2通路,影响神经细胞的凋亡,以此对脑组织起到保护作用。
多项研究[12-13]表明,KATP开放剂二氮嗪能够降低病理条件下的神经元PC12细胞的凋亡率。也有1[14]报道有药物能够减少氧糖剥夺后BV-2小胶质细胞炎性细胞因子的释放以及凋亡的发生,但KATP开放剂二氮嗪对氧糖剥夺后小胶质细胞的作用仍不清楚。本研究使用流式细胞术和AnnexinV-FITC/PI双染法检测了小胶质细胞系BV-2细胞的凋亡率,结果发现二氮嗪可以减少氧糖剥夺/复氧后的BV-2细胞的凋亡。caspase-3蛋白是细胞凋亡的重要相关蛋白,通常被活化剪切为P17与P12 2种片段,引起凋亡发生[15-16]。本研究结果表明,二氮嗪能减少缺氧/复氧后BV-2细胞中caspase-3的活化,而5-HD作为一种KATP阻断剂能降低二氮嗪对caspase-3的活化。证明KATP开放剂有可能是通过减少caspase-3蛋白的活化而发挥其对缺氧/复氧后的小胶质细胞的保护作用。
综上所述,本研究结果提示,KATP开放剂二氮嗪可能通过减少caspase-3的活化影响小胶质细胞的凋亡,从而对脑缺血/再灌注后的脑组织损伤发挥保护作用。但是,有关小胶质细胞在病理条件下对神经血管单元其他组成部分的作用以及KATP通道对脑缺血后神经血管单元的影响,有待进一步探讨。
| [1] |
WANG W, LI J, MENG X, et al. Effect of electronic stimulation at Neiguan (PC 6) acupoint on gene expression of adenosine triphosphate-sensitive potassium channel and protein kinases in rats with myocardial ischemia[J]. J Tradit Chin Med, 2015, 35(5): 577-582. DOI:10.1016/s0254-6272(15)30142-4 |
| [2] |
ZHANG H, SONG LC, LIU YY, et al. Pinacidil reduces neuronal apoptosis following cerebral ischemia-reperfusion in rats through both mitochondrial and death-receptor signal pathways[J]. Neurosci Bull, 2007, 23(3): 145-150. DOI:10.1007/s12264-007-0021-2 |
| [3] |
DEL ZOPPO GJ. Stroke and neurovascular protection[J]. N Engl J Med, 2006, 354(6): 553-555. DOI:10.1056/NEJMp058312 |
| [4] |
GALATRO TF, HOLTMAN IR, LERARIO AM, et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes[J]. Nat Neurosci, 2017, 20(8): 1162-1171. DOI:10.1038/nn.4597 |
| [5] |
ARNOLD T, BETSHOLTZ C. Correction:the importance of microglia in the development of the vasculature in the central nervous system[J]. Vascular Cell, 2013, 5(1): 12. DOI:10.1186/2045-824X-5-12 |
| [6] |
PEREGO C, FUMAGALLI S, DE SIMONI MG. Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice[J]. J Neuroinflammation, 2011, 8: 174. DOI:10.1186/1742-2094-8-174 |
| [7] |
RAJAN WD, WOJTAS B, GIELNIEWSKI B, et al. Dissecting functional phenotypes of microglia and macrophages in the rat brain after transient cerebral ischemia[J]. Glia, 2019, 67(2): 232-245. DOI:10.1002/glia.23536 |
| [8] |
WANG LN, WANG XL, LI TT, et al. 8e protects against acute cerebral ischemia by inhibition of PI3Kγ-mediated superoxide generation in microglia[J]. Molecules, 2018, 23(11): E2828. DOI:10.3390/molecules23112828 |
| [9] |
张鸿, 刘艳艳, 马英, 等. ATP敏感性钾通道开放剂对脑缺血/再灌注损伤的保护作用及信号转导机制研究[J]. 中国危重病急救医学, 2007, 19(4): 221-224. DOI:10.3760/j.issn:1003-0603.2007.04.008 |
| [10] |
张鸿, 贾春红, 赵丹阳, 等. ATP敏感性钾通道开放剂通过PI3K/Akt信号通路对缺血缺氧诱导PC12细胞凋亡发挥保护作用[J]. 解剖科学进展, 2011, 17(1): 27-32. DOI:10.16695/j.cnki.1006-2947.2011.01.023 |
| [11] |
王占强, 贾春红, 鲁杨, 等. 二氮嗪对氧糖剥夺后PC12细胞凋亡及对Bcl-2蛋白的影响[J]. 中国药理学通报, 2010, 26(7): 930-933. |
| [12] |
巴茂文, 孔敏, 于国平, 等. 二氮嗪联合环孢菌素A减轻突触核蛋白片段对PC12细胞凋亡的作用机制[J]. 中华老年心脑血管病杂志, 2013, 15(9): 976-978. DOI:10.3969/j.issn.1009-0126.2013.09.023 |
| [13] |
KONG M, BA MW. Protective effects of diazoxide against Aβ25-35-induced PC12 cell apoptosis due to prevention of endoplasmic reticulum stress[J]. Neuroreport, 2012, 23(8): 493-497. DOI:10.1097/WNR.0b013e3283537615 |
| [14] |
ZHOU JM, GU SS, MEI WH, et al. Ginkgolides and bilobalide protect BV2 microglia cells against OGD/reoxygenation injury by inhibiting TLR2/4 signaling pathways[J]. Cell Stress Chaperones, 2016, 21(6): 1037-1053. DOI:10.1007/s12192-016-0728-y |
| [15] |
KAVANAGH E, RODHE J, BURGUILLOS MA, et al. Regulation of caspase-3 processing by cIAP2 controls the switch between pro-inflammatory activation and cell death in microglia[J]. Cell Death Dis, 2014, 5: e1565. DOI:10.1038/cddis.2014.514 |
| [16] |
YAO LL, LU PF, LING EA. Melatonin suppresses toll like receptor 4-dependent caspase-3 signaling activation coupled with reduced production of proinflammatory mediators in hypoxic microglia[J]. PLoS One, 2016, 11(11): e0166010. DOI:10.1371/journal.pone.0166010 |
 2020, Vol. 49
2020, Vol. 49