文章信息
- 郭利晴, 张慧予, 李慧源, 孙晓红
- GUO Liqing, ZHANG Huiyu, LI Huiyuan, SUN Xiaohong
- 丁苯酞通过诱导自噬调控BV-2小胶质细胞炎症反应
- Butylphthalide regulates the inflammatory response of BV-2 microglial cells by inducing autophagy
- 中国医科大学学报, 2020, 49(1): 27-30
- Journal of China Medical University, 2020, 49(1): 27-30
-
文章历史
- 收稿日期:2018-12-11
- 网络出版时间:2019-12-12 9:45
阿尔茨海默病(Alzheimer disease,AD)是一种起病隐匿,病程呈进行性进展的神经退行性疾病,认知障碍和行为损害是其主要特征,病理变化包括β-淀粉样蛋白(β-amyloid protein,Aβ)沉积、神经原纤维缠结和神经元变性[1]。近年来的研究[2]认为脑内促炎症介质的过度释放加重了中枢神经系统损伤,减轻中枢神经系统炎症反应有助于改善记忆和认知能力。丁苯酞(butylphthalide,NBP)是一种广泛用于治疗脑血管疾病的药物,在脑卒中模型中可以减少血脑屏障损伤,研究[3-4]发现NBP可以改善脑梗死的炎症反应,但是对Aβ25-35诱导的BV-2小胶质细胞炎症反应的调节及相关机制尚不清楚。本研究拟利用Aβ25-35激活BV-2小胶质细胞构建AD炎症细胞模型,并在给予NBP干预后检测相关的炎症和自噬指标,探讨NBP对炎症的影响及可能机制。
1 材料与方法 1.1 试剂和仪器BV-2小胶质细胞(中国医学科学院基础医学研究所基础医学细胞中心),胎牛血清(德国Sera Pro公司),细胞培养基DMEM/HIGH GLUCOSE(美国HyClone公司),纯度 > 99%的NBP粉末、纯度 > 99%的Aβ25-35(美国APExBIO公司),BCA蛋白定量试剂盒(中国万类生物科技公司),ECL化学发光试剂盒(中国碧云天生物技术公司),ELISA试剂盒(美国R & D公司),LC3B和p62抗体(美国Proteintech公司),Beclin1、ATG5、白细胞介素(interlukin,IL)-6和IL-1β引物(武汉生工公司),实时PCR试剂盒(日本TaKaRa公司),实时PCR仪(美国ABI公司)。
1.2 方法 1.2.1 细胞培养与分组BV-2小胶质细胞培养于含有90%DMEM/HIGH GLUCOSE培养基和10%胎牛血清的培养基,在37 ℃、5%CO2的细胞培养箱中培养,1~2 d后进行消化混悬,按1︰2或1︰3的比例传代。将同时段培养处于对数生长期的细胞分为Control组(培养基培养细胞24 h)、Model组(20 μmol/L Aβ25-35处理细胞24 h)、NBP组(40 μmol/L NBP预处理2 h,20 μmol/L Aβ25-35继续处理细胞24 h)和NBP联合6-氨基-3-甲基嘌呤(3-methyladenine,3-MA)组(0.5 mmol/L 3-MA和40 μmol/L NBP依次预处理2 h,20 μmol/L Aβ25-35继续处理细胞24 h)。
1.2.2 CCK-8法检测NBP和Aβ25-35对BV-2小胶质细胞活力的影响将生长良好的细胞混悬接种到96孔板,100 μL/孔,约5×103个细胞。培养箱培养24 h后,对各组细胞分别进行处理及培养后,每孔加入10 μL CCK-8溶液,培养箱孵育1 h,酶标仪测定各孔吸光值,计算细胞存活率。
1.2.3 Western blotting干预结束后,弃培养基,PBS清洗细胞3遍;提取总蛋白,BCA蛋白定量,行SDS-PAGE电泳(浓缩胶80 V、30 min,分离胶110 V、60 min);转移蛋白至已被甲醇激活的聚二偏乙烯膜(80 V、90 min);5%脱脂奶粉封闭1 h,TBST洗膜(5 min/次×3次);加入一抗4 ℃孵育过夜,TBST洗膜(10 min/次×3次);加入二抗孵育1 h,TBST洗膜(5 min/次×3次);ECL发光显色。重复实验3次,应用Image J软件分析目的条带和内参β-actin的灰度值,用二者之比表示目的蛋白的相对表达情况。
1.2.4 实时PCRTrizol法提取细胞总RNA,用反转录试剂盒获取cDNA,用PCR试剂盒以cDNA为模板进行扩增,反应条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,GAPDH作为内参基因,2-ΔΔCt表示目的基因的相对表达量。
1.2.5 ELISA收集各组细胞上清液,按照ELISA试剂盒说明检测上清液中IL-1β的分泌量,450 nm读板,制作标准曲线,根据标准曲线计算各孔IL-1β的含量,实验重复3次。
1.3 统计学分析采用SPSS 20.0软件进行统计分析,计量资料用x±s表示,采用t检验进行比较。P < 0.05为差异有统计学意义。
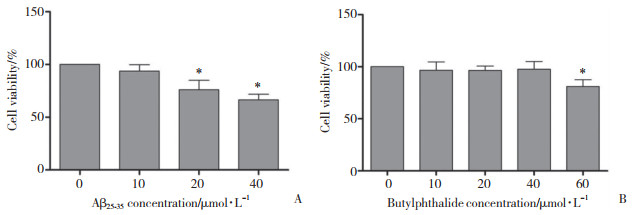
2 结果 2.1 NBP和Aβ25-35对BV-2小胶质细胞活力的影响利用CCK-8法检测NBP和Aβ25-35对BV-2小胶质细胞生存率的影响,将NBP浓度梯度依次设为0、10、20、40、60 μmol/L,Aβ25-35浓度梯度设为0、10、20、40 μmol/L。结果显示,NBP浓度≤40 μmol/L时,细胞活力无明显变化,因此后续实验选取40 μmol/L作为干预细胞的终浓度;Aβ25-35浓度为10 μmol/L时细胞仅轻微受损,与未处理细胞相比无统计学差异,细胞损伤随Aβ25-35浓度的增加而逐渐加重,故选择20 μmol/L作为细胞造模的有效处理浓度。见图 1。
|
| A, effect of concentration gradients of Aβ25-35 on cell viability; B, effect of concentration gradients of NBP on cell viability. *P < 0.05 vs 0 μmol/L. 图 1 梯度浓度的NBP和Aβ25-35对BV-2小胶质细胞存活率的影响 Fig.1 Effect of concentration gradients of NBP and Aβ25-35 on the viability of BV-2 microglial cells |
2.2 NBP对BV-2小胶质细胞自噬效应的调控
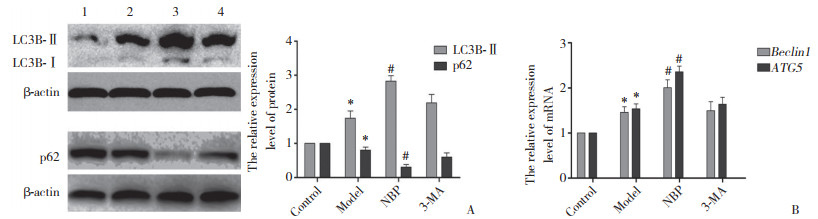
Western blotting和实时PCR结果显示,与Model组相比,NBP组自噬蛋白LC3B-Ⅱ和自噬基因ATG5、Beclin1表达增加,p62蛋白表达减少,自噬水平上调。给予自噬抑制剂3-MA联合处理后,3-MA组自噬水平较NBP组明显降低,差异有统计学意义(P < 0.05),见图 2。
|
| A, the relative expression of LC3B-Ⅱ and p62 detected by Western blotting; B, the relative expression of Beclin1 and ATG5 mRNA detected by real-time PCR. 1, control group; 2, model group; 3, NBP group; 4, 3-MA group.* P < 0.05 vs control group, # P < 0.05 vs model and 3-MA groups. 图 2 Western blotting和实时PCR检测自噬相关指标的表达情况 Fig.2 Results of autophagy related indicators as detected by Western blotting and real-time PCR |
2.3 NBP对BV-2小胶质细胞炎症反应的作用
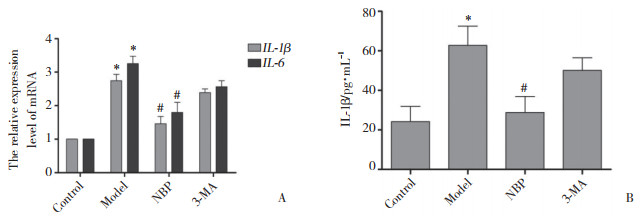
Aβ25-35诱导BV-2小胶质细胞后,实时PCR检测发现Model组炎性细胞因子IL-1β、IL-6基因表达较Control组增加,ELISA结果显示细胞上清液中IL-1β含量明显升高。与Model组相比,NBP组IL-1β、IL-6 mRNA和细胞上清液中IL-1β的表达显著降低。3-MA组IL-1β、IL-6 mRNA和细胞上清液中IL-1β水平较NBP组明显增加,差异均有统计学意义(P < 0.05),见图 3。
|
| A, the relative expression of IL-1β and IL-6 mRNA detected by real-time PCR; B, the assay of IL-1β in the supernatant fluid detected by ELISA. * P < 0.05 vs control group; # P < 0.05 vs model and 3-MA groups. 图 3 ELISA和实时PCR检测炎性相关指标的结果 Fig.3 Results of inflammatory related indicators by ELISA and real-time PCR |
3 讨论
AD发病机制复杂,慢性炎症反应是其众多机制假说中研究较为广泛的一种。小胶质细胞是中枢神经系统的免疫细胞,具有多种生物学功能,是介导中枢神经系统炎症反应的重要细胞,生理状态下呈静息态,当受到毒性物质和病原体等病理因素刺激时,转变为激活态。AD时具有神经毒性的Aβ异常沉积,可招募小胶质细胞迁移至其周围而被激活,持续释放促炎症介质IL-1β、IL-6等细胞毒性物质,破坏周围的神经元和突触,使其丧失正常的生理功能,逐渐进展为中枢神经系统慢性炎症损伤[5-8]。小胶质细胞及其介导的神经炎症反应在AD的病理过程中具有重要作用。
自噬是细胞内聚集蛋白质和受损细胞器等病变的清除降解方式,在维持细胞生存、更新和宿主防御等方面发挥关键作用。自噬障碍与神经退行性疾病、癌症和代谢性疾病等多种病变的病理变化相关[9]。越来越多的证据表明自噬参与炎症反应的调控,自噬受损时炎症反应加重。研究[10-12]认为,自噬可能通过清除聚集的炎性体,抑制其活化,进而阻碍某些促炎症介质的释放。因此,深入探讨两者之间的作用机制具有重要意义。
NBP是一种提取自芹菜的脂溶性物质,具有抗凋亡、抗氧化应激、改善线粒体功能和增强认知能力等多种神经保护作用[13]。本研究利用NBP干预Aβ25-35构建的BV-2小胶质细胞炎症模型,通过Western blotting、ELISA和实时PCR技术分别检测各组细胞的炎症指标IL-1β、IL-6和自噬指标ATG5、LC3B-Ⅱ、Beclin1及p62的变化,探究NBP与炎症之间的作用机制。p62亦称为sequestosome-1(SQSTM1),是一种自噬受体,介导泛素化底物的降解,自噬效应增加时LC3B-Ⅰ脂化转变成LC3B-Ⅱ并定位于自噬泡膜上,泛素化底物与p62特定区域结合后迁移至LC3B-Ⅱ位点,与之相互作用形成闭合的自噬体,自噬体吞噬p62及其介导的泛素化底物后与溶酶体融合,并在溶酶体酶的作用下降解清除p62和底物。自噬相关物质ATG5和Beclin1的表达在自噬体形成过程中亦发挥关键作用,是衡量自噬水平的重要指标[14-16]。本研究结果显示,Aβ25-35可以活化BV-2小胶质细胞,炎性细胞因子IL-1β、IL-6表达增加,而NBP具有上调自噬、减轻炎症反应的作用,说明自噬与炎症之间确实存在某种联系。为了验证这种关联,本研究中设置了自噬抑制剂3-MA组,结果显示,3-MA组在自噬水平受到抑制的同时,炎性细胞因子IL-1β、IL-6表达增加。以上结果表明,NBP可能通过诱导自噬参与抗炎过程,但其具体的调控机制尚不清楚,有待深入探讨研究。
| [1] |
FUJIKAKE N, SHIN M, SHIMIZU S. Association between autophagy and neurodegenerative diseases[J]. Front Neurosci, 2018, 12: 255. DOI:10.3389/fnins.2018.00255 |
| [2] |
PINTO A, BONUCCI A, MAGGI E, et al. Anti-oxidant and anti-inflammatory activity of ketogenic diet:new perspectives for neuroprotection in Alzheimer's disease[J]. Antioxidants (Basel), 2018, 7(5): E63. DOI:10.3390/antiox7050063 |
| [3] |
ZHENG BB, ZHOU YL, ZHANG HY, et al. Dl-3-n-butylphthalide prevents the disruption of blood-spinal cord barrier via inhibiting endoplasmic reticulum stress following spinal cord injury[J]. Int J Biol Sci, 2017, 13(12): 1520-1531. DOI:10.7150/ijbs.21107 |
| [4] |
HE ZL, ZHOU YL, LIN L, et al. Dl-3-n-butylphthalide attenuates acute inflammatory activation in rats with spinal cord injury by inhibiting microglial TLR4/NF-κB signaling[J]. J Cell Mol Med, 2017, 21(11): 3010-3022. DOI:10.1111/jcmm.13212 |
| [5] |
BISHT K, SHARMAÈ K, TREMBLAY MÈ. Chronic stress as a risk factor for Alzheimer's disease:roles of microglia-mediated synaptic remodeling, inflammation, and oxidative stress[J]. Neurobiol Stress, 2018, 9: 9-21. DOI:10.1016/j.ynstr.2018.05.003 |
| [6] |
SHADFAR S, HWANG CJ, LIM MS, et al. Involvement of inflammation in Alzheimer's disease pathogenesis and therapeutic potential of anti-inflammatory agents[J]. Arch Pharm Res, 2015, 38(12): 2106-2119. DOI:10.1007/s12272-015-0648-x |
| [7] |
CARNIGLIA L, RAMÍREZ D, DURAND D, et al. Neuropeptides and microglial activation in inflammation, pain, and neurodegenerative diseases[J]. Mediators Inflamm, 2017, 2017: 5048616. DOI:10.1155/2017/5048616 |
| [8] |
GHOSH S, GEAHLEN RL. Stress granules modulate SYK to cause microglial cell dysfunction in Alzheimer's disease[J]. EBioMedicine, 2015, 2(11): 1785-1798. DOI:10.1016/j.ebiom.2015.09.053 |
| [9] |
LAPAQUETTE P, GUZZO J, BRETILLON L, et al. Cellular and molecular connections between autophagy and inflammation[J]. Mediators Inflamm, 2015, 2015: 398483. DOI:10.1155/2015/398483 |
| [10] |
DE MATTOS BARBOSA MG, DE ANDRADE SILVA BJ, ASSIS TQ, et al. Autophagy impairment is associated with increased inflammasome activation and reversal reaction development in multibacillary leprosy[J]. Front Immunol, 2018, 9: 1223. DOI:10.3389/fimmu.2018.01223 |
| [11] |
NETEA-MAIER RT, PLANTINGA TS, VAN DE VEERDONK FL, et al. Modulation of inflammation by autophagy:Consequences for human disease[J]. Autophagy, 2016, 12(2): 245-260. DOI:10.1080/15548627.2015.1071759 |
| [12] |
WANG Y, LI YB, YIN JJ, et al. Autophagy regulates inflammation following oxidative injury in diabetes[J]. Autophagy, 2013, 9(3): 272-277. DOI:10.4161/auto.23628 |
| [13] |
ZHAO WH, LUO C, WANG J, et al. 3-N-butylphthalide improves neuronal morphology after chronic cerebral ischemia[J]. Neural Regen Res, 2014, 9(7): 719-726. DOI:10.4103/1673-5374.131576 |
| [14] |
KUANG P, DENG HD, LIU H, et al. Sodium fluoride induces splenocyte autophagy via the mammalian targets of rapamycin (mTOR) signaling pathway in growing mice[J]. Aging (Albany NY), 2018, 10(7): 1649-1665. DOI:10.18632/aging.101499 |
| [15] |
SHI JY, WONG J, PIESIK P, et al. Cleavage of sequestosome 1/p62 by an enteroviral protease results in disrupted selective autophagy and impaired NFKB signaling[J]. Autophagy, 2013, 9(10): 1591-1603. DOI:10.4161/auto.26059 |
| [16] |
COHEN-KAPLAN V, LIVNEH I, AVNI N, et al. P62-and ubiquitin-dependent stress-induced autophagy of the mammalian 26S proteasome[J]. Proc Natl Acad Sci USA, 2016, 113(47): E7490-E7499. DOI:10.1073/pnas.1615455113 |
 2020, Vol. 49
2020, Vol. 49