文章信息
- 李玉泽, 刘娜, 佟晶, 金蓉, 陈梅, 卑贵光
- LI Yuze, LIU Na, TONG Jing, JIN Rong, CHEN Mei, BEI Guiguang
- 动脉自旋标记灌注对足月缺氧缺血性脑病新生儿预后的预测价值
- The Value of Arterial Spin Labeling in the Outcome of Full-Term Neonates with Hypoxic-Ischemic Encephalopathy
- 中国医科大学学报, 2019, 48(9): 812-816
- Journal of China Medical University, 2019, 48(9): 812-816
-
文章历史
- 收稿日期:2018-10-15
- 网络出版时间:2019-09-09 9:22
2. 北部战区总医院 新生儿科, 沈阳 110812
2. Department of Newborn, General Hospital of Northern Theater Command, Shenyang 110812, China
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指新生儿在围产期窒息引起的缺氧、脑血流量减少或暂停而导致的缺氧缺血性脑损伤,最常见的原因是胎儿宫内窘迫,主要见于分娩过程中以及出生后的窒息缺氧。脑血流量的改变在脑损伤发生中发挥着极其重要的作用,常并发生长发育落后、智力低下、癫痫、脑瘫等一系列神经后遗症[1],病死率较高。因此,HIE患儿准确的预后评估极为重要。磁共振成像(magnetic resonance imaging,MRI)是目前公认的HIE首选的影像学检查方法,但是常规MRI序列及扩散加权成像(diffusion-weighted imaging,DWI)不能反映HIE时的脑血流量变化。三维动脉自旋标记(3D arterial spin labeled,3D ASL)以动脉血内水分子作为内源性示踪剂,无需注入放射性对比剂即可获得相对脑血流量(relative cerebral blood flow,rCBF)[2]。本研究拟探讨3D ASL技术在足月HIE新生儿预后评估中的价值。
1 材料与方法 1.1 临床资料选择2016年5月至2018年5月在北部战区总医院诊断为HIE的足月新生儿30例,其中,男11例,女19例,胎龄37~42周,平均胎龄(38.4±1.6)周,体质量2.1~3.9 kg,平均(3.19±0.45)kg。均于生后3 d行头部MRI检查。本研究经我院医学伦理委员会批准,患儿家长均已知情同意并签署知情同意书。
根据《新生儿缺血缺氧性脑病诊断标准》 [3]及分度标准对HIE患儿进行分度。由于轻度HIE患儿症状在72 h内消失,且预后好,所以本研究仅纳入中、重度HIE患儿。由2名具有15年以上工作经验的新生儿科副主任医师判断患儿的病情轻重程度,共纳入中度患儿27例,重度3例。患儿于治疗后1个月复诊,由新生儿科副主任医师进行预后评估,包括神经行为评分(neonatal behavioral neurological assessment,NBNA)及MRI检查。患儿NBNA评分 > 35分,症状消失,MRI表现为病灶减少者为预后良好;患儿NBNA评分 < 35分,症状不消失,MRI显示病灶未见减少或出现脑室旁软化灶者为预后不良。将所有患儿根据预后评估结果分为预后不良组和预后良好组。磁共振3D ASL图像由2名放射科副主任医师阅片。
1.2 仪器与方法采用3.0T MR扫描仪(GE Discovery MR750,美国通用电气公司),ADW4.6工作站和8通道专用头部线圈,检查序列包括横断位T1WI、T2WI、T2flair,矢状位T2WI、DWI及ASL。3D ASL采用三维脉冲式动脉自旋标记(pulsed arterial spin labeling,PASL)。扫描参数:TR 4 389 ms,TE 10.5 ms,层厚4 mm,激励次数3次。DWI采用平面回波成像(echo-planar imaging,EPI),TR 4 000 ms,TE 50 ms,层厚4 mm,层距0.5,b值为0、1 000 s/mm2,激励次数2次。
检查前30 min给予镇静剂苯巴比妥钠(10 mg/kg),确保患儿在睡眠状态下完成MRI检查。检查前用海绵固定患儿头部防止头部运动,将棉球塞入患儿耳内以保护听力。为了降低患儿从病房到MRI检查室搬运过程中的风险并实时监测患儿情况,由新生儿科医生全程陪同,直至检查结束返回病房。
1.3 图像分析于表观扩散系数(apparent diffusion coefficient,ADC)图像上勾画感兴趣区(region of interest,ROI),面积11~14 mm2,对称测量双侧丘脑及基底节ADC值。在rCBF图上相应部位勾画ROI,测量rCBF值,ROI尽可能与ADC图一致。rCBF伪彩图上用红色、绿色、蓝色、黑色依次代表高灌注、中等灌注、低灌注、无灌注。
1.4 统计学分析采用SPSS 20.0软件进行统计分析。计数资料以百分率(%)表示,组间比较采用Fisher确切概率法。计量资料以x±s表示,预后不良组及预后良好组的脑血流量(cerebral blood flow,CBF)值及ADC值的比较采用两独立样本t检验,P < 0.05为差异有统计学意义。采用双变量回归分析评估ASL与ADC的相关性。
2 结果 2.1 2组新生儿一般临床资料比较30例患儿中,21例预后良好,9例预后不良。因足月儿孕龄不同脑成熟度也不同,故需要分析预后不良组和预后良好组的一般临床资料有无差别。结果显示,2组患儿在性别、胎龄、体质量、1 min Apgar评分、孕妇年龄方面均无统计学差异(P均 > 0.05),见表 1。
| Group | n | Male/female | Gestational age(week) | Body weight(kg) | 1 min Apgar | Maternal age(year) |
| Adverse outcome | 9 | 3/6 | 38.6±1.4 | 3.1±0.6 | 9.1±1.8 | 29.78±4.3 |
| Favourable outcome | 21 | 8/13 | 38.7±1.2 | 3.2±0.4 | 9.4±1.4 | 28.48±3.1 |
| χ2/t | -0.32 | -0.64 | -0.46 | 0.930 | ||
| P | 1 | 0.24 | 0.14 | 0.33 | 0.26 |
2.2 预后不良组和预后良好组ASL比较
预后不良组和预后良好组患儿的MRI图像(TIWI、T2WI、CBF伪彩图、ADC图)见图 1、2。预后不良组基底节区灌注[(42.90±5.30)mL·100 g-1·min-1]大于预后良好组[(34.25±1.91)mL·100 g-1·min-1],差异有统计学意义(t = 4.76,P = 0.001);预后不良组双侧丘脑灌注[(52.56±4.33)mL·100 g-1·min-1]大于预后良好组[(44.95±2.13)mL·100 g-1·min-1],差异有统计学意义(t = 5.01,P = 0.001)。预后不良组和预后良好组基底节及丘脑灌注平均值分别为(47.73±3.56)mL·100 g-1·min-1和(39.60±1.60)mL·100 g-1·min-1,2组的平均灌注值有统计学差异(t = 6.56,P < 0.01),见表 2。rCBF值的受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the concentration-time curve,AUC)为0.984,敏感度和特异度分别为100%和76.2%。
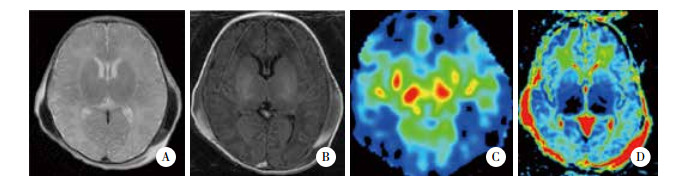
|
| A, T2-weighted image; B, T1-weighted image; C, rCBF color map; D, ADC map. 图 1 预后不良组HIE患儿MR图像 Fig.1 MR images of an infant with HIE in adverse outcome group |
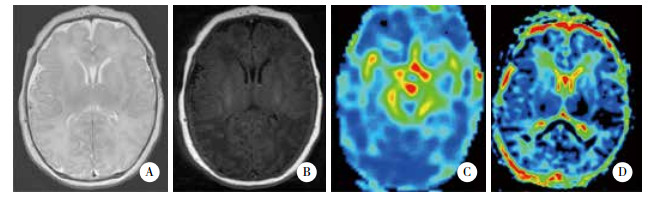
|
| A, T2-weighted image; B, T1-weighted image; C, rCBF color map; D, ADC map. 图 2 预后良好组HIE患儿MR图像 Fig.2 MR images of an infant with HIE in favourable outcome group |
| Group | rCBF value(mL·100 g-1·min-1) | ADC value(×10-3 mm-2·s-1) | |||
| Basal ganglia | Thalami | Basal ganglia | Thalami | ||
| Adverse outcome | 42.90±5.30 | 52.56±4.33 | 1.16±0.05 | 1.05±0.06 | |
| Favourable outcome | 33.82±0.87 | 44.95±2.13 | 1.21±0.06 | 1.12±0.05 | |
| t | 4.76 | 5.01 | -2.24 | -3.44 | |
| P | 0.001 | 0.001 | 0.03 | 0.002 | |
预后不良组基底节、丘脑的ADC值[(1.16±0.05)×10-3 mm-2·s-1,(1.05±0.06)×10-3 mm-2·s-1]均低于预后良好组[(1.21±0.06)×10-3 mm-2·s-1,(1.12±0.05)×10-3 mm-2·s-1],差异有统计学意义(t = -2.24,P = 0.03;t = -3.44,P = 0.002)。预后不良组和预后良好组ADC平均值分别为(1.10±0.04)×10-3 mm-2·s-1和(1.16±0.36)×10-3 mm-2·s-1,差异有统计学意义(t = -4.15,P < 0.01)。见表 2。ADC值的AUC为0.873,敏感度和特异度分别为88.9%和47.6%。
2.3 相关性分析rCBF与ADC之间呈负相关(r = -0.54,P < 0.01)。rCBF对足月HIE患儿预后评价的敏感度及特异度均高于ADC。
3 讨论新生儿HIE是围产期新生儿最常见的神经系统疾病之一,是新生儿中发病率和死亡率最高的疾病,研究[4]报道发病率约占活产足月儿的1~3/1 000,尤其中、重度HIE患儿常伴有各种严重并发症。HIE患儿的神经后遗症包括脑瘫、癫痫、智力缺陷、学习能力障碍、肌无力[5-7]。由于HIE致残率、致死率高,因此,对该病除了应做到早发现、早治疗外,充分的预后评估也十分重要,有助于指导临床制定治疗方案,以及评估神经保护治疗的效果[8]。本研究的目的在于分析MR动脉自旋标记灌注成像技术3D ASL对HIE患儿的预后评估价值,为HIE患儿的临床治疗提供科学的参考依据,以期提高HIE患儿的总体预后效果。
HIE可导致一系列的生化改变,包括缺氧致胎儿心输出量减少,脑血流量减少,脑局部缺血引起脑免疫细胞-小胶质细胞活化,随后启动免疫反应[9],小胶质细胞转变成巨噬细胞,并破坏血脑屏障;外围的免疫细胞聚集到缺血区域,由于二次神经元损害导致缺血性脑损伤的加剧[10]。小胶质细胞反应贯穿HIE的整个病理过程,在急性和慢性阶段表现出不同的特点[11]。大脑氧气和葡萄糖供应不足,三磷酸腺苷明显减少和乳酸堆积,细胞内钙离子超载,兴奋性氨基酸在细胞外产生一定毒性作用,生成大量氧自由基,导致细胞死亡[12-13]。有研究[14]认为HIE患儿将经历缺氧-缺血-再灌注损伤的病理生理过程,有学者认为缺血后再灌注比单纯缺血更为严重。
CBF的变化在HIE的发生发展中发挥着极其重要的作用。3D ASL磁共振灌注成像采用磁标记的动脉血水分子作为内源性示踪剂,是一种非侵入性灌注成像方法,可以测得rCBF,不需要注入对比剂,无辐射[15],是唯一能够应用于新生儿的非侵入性的检查方法,具有无创、安全、实时、可重复性强等特点,扫描时间较短,不存在伦理上的问题和技术上的困难,尤其适用于新生儿。本研究结果表明,出生后72 h HIE患儿存在脑内高灌注,与其他相关研究[16]结果一致。3D ASL可以尽早评估HIE发生后患儿脑组织的再灌注情况,这种自身CBF重新分配修复缺血损伤产生的高能磷酸化合物可使细胞死亡延迟,因此3D ASL对于评估HIE的预后有重要意义[8]。本研究选择双侧基底节和丘脑作为ROI测量脑CBF值,是因为在足月HIE患儿中这些区域较易受到损伤[17],而且这些区域存在高灌注。本研究结果证实预后不良组的基底节、丘脑灌注显著高于预后良好组,差异有统计学意义(P < 0.01)。
DWI是目前唯一能够在活体检测水分子扩散运动的方法,能够早期发现HIE患儿脑内高信号病灶,并能够通过定量参数ADC值对HIE患儿的脑损伤进行定量评估。3D ASL和DWI对于HIE患儿的预后预测价值均较高,且3D ASL的预测价值优于DWI。本研究结果显示,脑缺血缺氧区rCBF的增高与ADC值的下降存在相关性,与其他相关研究[18]结果一致。
研究[19]表明,新生儿脑灌注更多取决于妊娠时间,而本研究对象为足月新生儿,2组的临床资料无统计学差异,脑成熟度无明显差异;而且均于生后3 d行MRI检查,避免了因检查时间不同而造成的灌注差异,有效地避免了偏倚。
本研究的不足之处如下:新生儿ASL对运动敏感,可能会造成图像质量下降;本研究采用手动ROI分析,虽然简单易行,但可能存在偏倚;本研究的样本量较小,统计学结果可能存在误差,有待进一步扩大样本量进行研究。
综上所述,3D ASL可以无创、准确地测量HIE患儿的CBF,对HIE预后评估的价值高于DWI,可以为临床评估HIE患儿的预后提供客观准确的依据,具有较高的临床应用价值。
| [1] |
吴珂, 付民峰, 王君霞, 等. 新生儿缺氧缺血性脑病MR快速评估的临床应用价值[J]. 临床放射学杂志, 2016, 35(8): 1253-1257. DOI:10.13437/j.cnki.jcr.2016.08.029 |
| [2] |
ALSOP DC, DETRE JA, GOLAY X, et al. Recommended implementation of arterial spin-labeled perfusion MRI for clinical applications:a consensus of the ISMRM perfusion study group and the European consortium for ASL in dementia[J]. Magn Reson Med, 2015, 73(1): 102-116. DOI:10.1002/mrm.25197 |
| [3] |
中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J]. 中华儿科杂志, 2005, 43(8): 584-585. DOI:10.3760/j.issn:0578-1310.2005.08.007 |
| [4] |
EL-MAZARY AA, NASIF KA, ABDEL-HAKEEM GL, et al. Adiponectin, leptin and insulin levels at birth and in early postnatal life in neonates with hypoxic ischemic encephalopathy[J]. J Diabetes Metab Disord, 2015, 14: 87. DOI:10.1186/s40200-015-0219-1 |
| [5] |
EDWARDS AB, CROSS JL, ANDERTON RS, et al. Poly-arginine R18 and R18D (D-enantiomer) peptides reduce infarct volume and improves behavioural outcomes following perinatal hypoxic-ischaemic encephalopathy in the P7 rat[J]. Mol Brain, 2018, 11(1): 8-19. DOI:10.1186/s13041-018-0352-0 |
| [6] |
ZHAO M, ZHU P, FUJINO M, et al. Oxidative stress in hypoxic-ischemic encephalopathy:molecular mechanisms and therapeutic strategies[J]. Int J Mol Sci, 2016, 17(12): E2078. DOI:10.3390/ijms17122078 |
| [7] |
LOONEY AM, AHEARNE C, BOYLAN GB, et al. Glial fibrillary acidic protein is not an early marker of injury in perinatal asphyxia and hypoxic-ischemic encephalopathy[J]. Front Neurol, 2015, 6(21): 264. DOI:10.3389/fneur.2015.00264 |
| [8] |
DE VIS JB, HENDRIKSE J, PETERSEN ET, et al. Arterial spin-labelling perfusion MRI and outcome in neonates with hypoxic-ischemic encephalopathy[J]. Eur Radiol, 2015, 25(1): 113-121. DOI:10.1007/s00330-014-3352-1 |
| [9] |
MIRZA MA, RITZEL R, XU Y, et al. Sexually dimorphic outcomes and inflammatory responses in hypoxic-ischemic encephalopathy[J]. J Neuroinflammation, 2015, 12(1): 32-41. DOI:10.1186/s12974-015-0251-6 |
| [10] |
JONES KA, MALTBY S, PLANK MW, et al. Peripheral immune cells infiltrate into sites of secondary neurodegeneration after ischemic stroke[J]. Brain Behav Immun, 2018, 67: 299-307. DOI:10.1016/j.bbi.2017.09.006 |
| [11] |
AL MAMUN A, CHAUHAN A, YU H, et al. Interferon regulatory factor 4/5 signaling impacts on microglial activation after ischemic stroke in mice[J]. Eur J Neurosci, 2018, 47(2): 140-149. DOI:10.1111/ejn.13778 |
| [12] |
王瑞珠, 邹月芬, 唐文伟, 等. 磁共振成像及氢质子磁共振波谱在新生儿缺氧缺血性脑病中的应用价值[J]. 实用放射学杂志, 2014, 30(8): 1358-1362. DOI:10.3969/j.issn.1002-1671.2014.08.029 |
| [13] |
陆镇奇, 何力, 高平明. 新生儿缺氧缺血性脑病早期振幅整合脑电图背景活动的特点及意义[J]. 实用医学杂志, 2014, 30(2): 279-281. DOI:10.3969/j.issn.1006-5725.2014.02.042 |
| [14] |
黎芳丽, 汤静, 肖怀春, 等. 动脉自旋标记成像在新生儿缺氧缺血性脑病中的研究进展[J]. 医疗装备, 2016, 29(7): 53-54. DOI:10.3969/j.issn.1002-2376.2016.07.033 |
| [15] |
TORTORA D, MATTEI PA, NAVARRA R, et al. Prematurity and brain perfusion:Arterial spin labeling MRI[J]. Neuroimage Clin, 2017, 15: 401-407. DOI:10.1016/j.nicl.2017.05.023 |
| [16] |
冀旭, 范国光. 连续动脉自旋标记磁共振灌注成像对足月缺氧缺血性脑病患儿的初步研究[J]. 磁共振成像, 2011, 2(1): 19-23. DOI:10.3969/j.issn.1674-8034.2011.01.006 |
| [17] |
WU TW, TAMRAZI B, HSU KH, et al. Cerebral lactate concentration in neonatal hypoxic-ischemic encephalopathy:in relation to time, characteristic of injury, and serum lactate concentration[J]. Front Neurol, 2018, 9: 293. DOI:10.3389/fneur.2018.00293 |
| [18] |
PIENAAR R, PALDINO MJ, MADAN N, et al. A quantitative method for correlating observations of decreased apparent diffusion coefficient with elevated cerebral blood perfusion in newborns presenting cerebral ischemic insults[J]. Neuroimage, 2012, 63(3): 1510-1518. DOI:10.1016/j.neuroimage.2012.07.062 |
| [19] |
ROCHE-LABARBE N, FENOGLIO A, AGGARWAL A, et al. Near-infrared spectroscopy assessment of cerebral oxygen metabolism in the developing premature brain[J]. J Cereb Blood Flow Metab, 2012, 32(3): 481-488. DOI:10.1038/jcbfm.2011.145 |
 2019, Vol. 48
2019, Vol. 48