文章信息
- 徐冬雪, 黄文燕, 黄毅鹏, 封琼, 曾素娟
- XU Dongxue, HUANG Wenyan, HUANG Yipeng, FENG Qiong, ZENG Sujuan
- 铒钇铝石榴石激光与氟联合应用促进早期釉质龋再矿化的体外研究
- Effect of Combined Application of Erbium-Doped Yttrium Aluminum Garnet Laser and Fluoride on the Remineralization of Early Enamel Caries: an in vitro Study
- 中国医科大学学报, 2019, 48(6): 530-533
- Journal of China Medical University, 2019, 48(6): 530-533
-
文章历史
- 收稿日期:2018-11-28
- 网络出版时间:2019-05-27 16:45
自从MAIMAN 1960年第1次报道激光辐射以来,人们对许多潜在的激光应用领域进行了研究。铒钇铝石榴石(erbium-doped yttrium aluminum garnet,Er:YAG)激光是一种波长为2.94 μm的硬组织激光,具有多种功能。Er:YAG激光的一大特性是其波长接近水吸收曲线及羟基磷灰石吸收红外线峰值,故可以有效地去除牙本质和釉质[1]。1997年,该种类型激光得到FDA批准,可用于牙科去除腐质和洞型制备。Er:YAG激光的防龋机制为改变釉质结构,降低其可溶性;通过使釉质表面熔融、微孔封闭而增强其抗脱矿能力;促进釉质对氟的吸收[2]。
氟化物是目前为止应用最为广泛的一种有效防龋物质,如果结合Er:YAG激光低能量辐照技术提高氟化物的利用效率,就能很好地增强牙体的抗龋性,同时可以降低氟的使用量[3]。但目前国内对于Er:YAG激光与氟联合应用对早期釉质龋再矿化的研究较少,本研究将Er:YAG激光与氟化物联合应用,对早期釉质龋表面进行再矿化处理,利用扫描电镜观察再矿化釉质表面形态,并通过能谱分析测定牙釉质表面微区成分,对其作用机制进行初步探讨。
1 材料与方法 1.1 主要材料和仪器多乐氟(美国高露洁棕榄公司,主要成分为50 mg/mL的氟化钠);扫描电镜(日本HITACHI S-3400N);硬组织切割机(德国EXAKT 300/30-1170)。
1.2 标本制备选取新鲜拔除的釉质表面光滑、颜色正常无缺损、无裂痕的牛下颌切牙50颗,冲洗干净,冠根分离,在超声清洗机里进行清洗后自然干燥,以硬组织切割机切割成6 mm×5 mm×2 mm的釉质块,于每个标本唇面建立直径1 mm的开窗区,其余部分涂布抗酸指甲油,于去离子水中4 ℃保存。
1.3 人工釉质脱矿标本的制备将标本浸泡在脱矿液[部分饱和酸缓冲脱矿体系:2.2 mmol/L Ca(NO3)2、2.2 mmol/L KH2PO4、50 mmol/L醋酸、1.0 mmol/L NaN3、0.1 mmol/L NaF pH4.5]中3 d,接触面积为1.8 mm2/mL,置于37 ℃恒温箱中,每天更换脱矿液。
1.4 再矿化将50块脱矿釉质块用去离子水冲洗干净,随机分成5组,每组10块,D组:脱矿组,C组:空白对照组,L组:Er:YAG激光处理组,FV组:含氟涂膜处理组,FVL组:含氟涂膜+Er:YAG激光处理组。L组以Er:YAG激光(波长2 940 nm、能量密度60 mJ、频率10 HZ、功率0.6 W,调节激光与牙釉质面的距离,使激光光斑刚好覆盖牙釉质面的窗口)照射开窗区釉质5 s;FV组将多乐氟凝胶均匀涂于釉质块唇侧开窗区,使呈薄层,气枪吹干;FVL组以Er:YAG激光(标准同L组)照射开窗区釉质5 s,再以多乐氟凝胶均匀涂于釉质块唇侧开窗区,使其呈薄层,气枪吹干。各组处理完成后以去离子水冲洗2次,分别置于37 ℃,50 mL人工唾液(MgCl2·6H2O、CaCl2·2H2O、K2HPO4·3H2O、K2CO3、NaCl、KCl)中再矿化7 d,每天更换唾液。
1.5 扫描电镜观察及能谱分析将脱矿后与再矿化处理后的牙釉质块标本以超声荡洗30 min,流水冲洗5 min,自然干燥、脱水、喷金,扫描电镜观察牙釉质块表面孔隙及平滑情况,而后在釉质块表面随机选取3个区域进行微区成分(C、O、P、Ca)测定,根据所选区域收集的能谱,求得该区域内各成分的质量百分比,取平均值。
1.6 统计学分析采用SPSS 19.0软件对结果进行统计分析。定量资料采用x±s描述,各组间Ca、P、Ca/P进行单因素方差分析,两两比较用SNK检验,P < 0.05为差异有统计学意义。
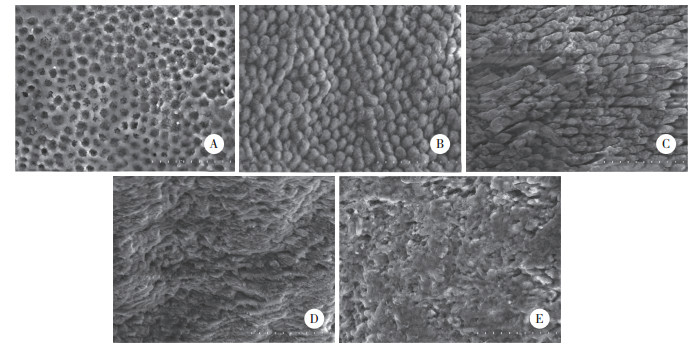
2 结果 2.1 牙釉质表面形貌扫描电镜放大1 500倍,D组可见牙釉质表面呈蜂窝状改变,釉柱中心溶解(图 1A);C组见牙釉质表面球形微粒沉积于釉柱脱矿溶解的微孔表面。(图 1B)。L组见牙釉质釉柱表面矿物质沉积,釉柱间质破坏,呈裂缝状,部分区域有溶解消融现象(图 1C),FV组见牙釉质表面呈不规则矿化,矿化表面凸凹不平,呈蚀刻状(图 1D),FVL组见牙釉质表面呈斑块状再矿化沉积物,部分无沉积物的表面可见釉柱间质消融产生的裂缝(图 1E)。
|
| A,group D;B,group C;C,group L;D,group FV;E,group FVL. 图 1 扫描电镜下5组牙釉质表面形貌×1 500 Fig.1 SEM observation of surface enamel of each group ×1 500 |
2.2 能谱分析结果
各组的Ca、P质量百分比及Ca/P存在统计学差异(F = 67.868,P < 0.001)。使用SNK检验进行了多组间的两两比较,结果表明,再矿化后的L组、FV组和FVL组的Ca及P元素质量百分比均较C组高,FVL组Ca及P元素的质量百分比显著高于其余各组,均有统计学差异(P < 0.05)。FVL组Ca/P较FV组、L组、C组高,结果有统计学差异(P < 0.05),但FV组、L组及C组的Ca/P两两比较均无统计学差异(P > 0.05)。见表 1。
| Group | C(%) | O(%) | Ca(%) | P(%) | Ca/P |
| D | 15.34±4.09 | 57.02±3.40 | 16.00±1.89 | 11.71±0.41 | 1.37±0.14 |
| C | 8.61±2.13 | 61.83±1.46 | 17.42±1.63 | 12.13±0.77 | 1.44±0.18 |
| L | 6.74±2.86 | 62.18±1.48 | 18.49±2.332) | 12.59±0.732) | 1.47±0.141) |
| FV | 12.09±2.99 | 57.79±1.46 | 17.90±2.031) | 12.22±0.771) | 1.46±0.121) |
| FVL | 5.02±2.71 | 62.24±1.42 | 19.68±1.762) | 12.84±0.852) | 1.54±0.121) |
| 1)P < 0.05 compared with group D;2)P < 0.05 compared with group FV. | |||||
3 讨论
氟化涂膜具有良好的防龋效果,其涂布在牙齿表面自然干燥后形成一层含氟薄膜,与釉质表面作用生成氟化钙样物质,当口腔pH值降低时可作为氟离子的储存库释放氟离子[4],通过减少脱矿和增加唾液的矿物质含量来预防龋齿[5-6]。
近几十年来,激光与氟联合应用防龋一直是国内外学者的研究热点。研究[7-8]表明,激光可以促进釉质表面微小的指状突起形成,这种结构可使进入釉质表面溶解层的氟形成氟磷灰石,在局部形成氟库。此外,激光引起的热效应可以明显增强釉质对氟的吸收,是促进氟化物吸收和增强釉质抗酸性的主要原因[9]。
本研究采用扫描电镜对脱矿后经氟化涂膜及激光处理后进行再矿化的样本进行观察,各组釉质表面形态均具有显著的外貌特征。L组牙釉质釉柱表面矿物质沉积,釉柱间质破坏,呈裂缝状,部分区域有溶解消融现象。FVL组牙釉质表面呈斑块状再矿化沉积物,但部分无沉积物的表面也可见釉柱间质消融产生的裂缝,表明激光能量密度偏高,釉柱间有机物分解明显。HSU等[10]研究表明,激光产生的热量可导致釉质有机物分解,并且使羟基磷灰石形成难降解的磷酸钙或焦磷酸钙。牙釉质中的蛋白质在350~400 ℃之间分解,而这种有机阻断效应可能会在300~400 ℃达到最大,在高于400 ℃时,由于有机物质的完全分解而下降。研究中,因不同区域接受激光照射的能量略有不同,部分激光照射能量高的区域因有机物质完全分解而呈裂缝状,而激光照射能量略低的表面区域有机物分解后形成磷酸钙或焦磷酸钙。此外,激光与氟化物联合应用有助于氟化物在釉质表面形成氟羟基磷灰石和氟化钙,从而作为氟储库,抑制釉质脱矿。其协同作用机制尚不清楚,有学者[11]提出2种机制,一方面是由于激光照射产生的热量使釉质对氟化物的通透性增强,另一方面是由于激光照射使釉质表面形成一些微孔隙和微裂纹,这些结构起到了固定氟的作用。
在釉质的再矿化研究中常根据X线能谱量化表面钙、磷的相对含量,无机成分的变化,碳酸盐含量的变化,来评估再矿化结果[12]。本研究中L组、FV组、和FVL组再矿化后的Ca、P元素质量百分比及Ca/P均较C组高,FVL组Ca、P元素的质量百分比显著高于各组。OHO等[11]认为激光可降低牙釉质的碳酸盐、水份和有机质的含量,使蛋白凝固,降低牙釉质的溶解性,并可导致牙釉质产生微孔样结构,增加釉质对钙、磷、氟的吸收,使龋病形成过程中产生的钙、磷、氟再矿化。在Er:YAG激光照射后O和P均明显增加,可能与牙釉质加热有关的焦磷酸盐含量的增加有关[13]。牙釉质的扩散通路是由有机基质控制的,其占据棱柱间和棱柱内的空间,在酸的侵蚀下,牙釉质中的有机基质可以延迟牙齿的脱矿。SATO [14]认为,牙齿受热所产生的有机物质的熔化和膨胀,可能会阻断扩散通路,降低Ca的损失。
Er:YAG激光在氟化涂膜在早期釉质龋的再矿化中起到协同作用,为激光在临床上的应用提供一定的理论依据,但具体协同作用机制还待进一步研究。
| [1] |
KILINC E, ROSHKIND DM, ANTONSON SA, et al. Thermal safety of Er:YAG and Er, Cr:YSGG lasers in hard tissue removal[J]. Photomed Laster Surg, 2009, 27(4): 565-570. DOI:10.1089/pho.2008.2335 |
| [2] |
APEL C, MEISTER J, DUSCHNER H, et al. Structural changes in human dental enamel after subablative erbium laser irradiation and its potential use for caries prevention[J]. Caries Res, 2005, 39(1): 65-70. DOI:10.1159/000081659 |
| [3] |
MATHEW A, VENUGOPAL RN, SUGUMARAN DK, et al. Acquired acid resistance of human enamel treated with laser (Er:YAG laser and Co2 laser) and acidulated phosphate fluoride treatment:an in vitroatomic emission spectrometry analysis[J]. Contemp Clin Dent, 2013, 4(2): 170-175. DOI:10.4103/0976-237X.114864 |
| [4] |
王子华, 石四箴. 氟防龋研究的进展[J]. 牙体牙髓牙周病学杂志, 2002, 12(8): 455-457. DOI:10.3969/j.issn.1005-2593.2002.08.033 |
| [5] |
COHEN L. International collaborative research on fluoride[J]. J Dent Res, 2000, 79(4): 893-904. DOI:10.1177/00220345000790040301 |
| [6] |
ESTEVESOLIVEIRA M, HAO Y, EDUARDO CDP, et al. Screening of CO2 laser (10.6μm) parameters for prevention of enamel erosion[J]. Photomed Laser Surg, 2013, 30(6): 331-338. DOI:10.1089/pho.2011.3175 |
| [7] |
OHO T, SHIMAZAKE Y, MITOMA M. Bovine milk antibodies against cell surface protein antigen PAc-glucosyltransferase fusion protein suppress cell adhesion and alter glucan synthesis of streptococcus mutans[J]. J Nutr, 1999, 129(10): 1836-1841. DOI:10.1093/jn/129.10.1836 |
| [8] |
MALSUMURA M, IZUMI T, MATSUMOTO M, et al. The role of glucan-binding proteins in the cariogenicity of streptococcus mutans[J]. Microbiol Immunol, 2003, 47(3): 213-215. DOI:10.1111/j.1348-0421.2003.tb03389.x |
| [9] |
LETOWSKI J, BROUSSEAU R, MA L, et al. Designing better probes:effect of probe size, mismatch position and number on hybridization in DNA oligonucleotide microarrays[J]. J Microbiol Methods, 2004, 57(2): 269-278. DOI:10.1016/j.mimet.2004.02.002 |
| [10] |
HSU CY, JORDAN TH, DEDERICH DN, et al. Effects of low-energy CO2 laser irradiation and the organic matrix on inhibition of enamel demineralization[J]. J Dent Res, 2000, 79(9): 1725-1730. DOI:10.1177/00220345000790091401 |
| [11] |
OHO T, MORIOKA T. A possible mechanism of acquired acid resistance of human dental enamel by laser irradiation[J]. Caries Res, 1990, 24(2): 86-92. DOI:10.1159/000261245 |
| [12] |
LOU L, NELSON AE, HEO G, et al. Surface chemical composition of human maxillary first premolar as assessed by X-ray photoelectron spectroscopy (XPS)[J]. Appl Surf Sci, 2008, 254(21): 6706-6709. DOI:10.1016/j.apsusc.2008.04.085 |
| [13] |
FOWLER BO, KURODA S. Changes in heated and in laser-irradiated human tooth enamel and their probable effects on solubility[J]. Calcif Tissue Int, 1986, 38(4): 197-208. DOI:10.1007/BF02556711 |
| [14] |
SATO K. Relation between acid dissolution and histological alteration of heated tooth enamel[J]. Caries Res, 1983, 17(6): 490-495. DOI:10.1159/000260708 |
 2019, Vol. 48
2019, Vol. 48