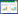文章信息
- 何波, 王文瑞, 李健, 王平
- HE Bo, WANG Wenrui, LI Jian, WANG Ping
- 蛋白酶体抑制剂MG132对膀胱癌细胞增殖及凋亡的影响
- Effects of Proteasome Inhibitor MG132 on Proliferation and Apoptosis of Bladder Cancer Cells
- 中国医科大学学报, 2019, 48(4): 349-353
- Journal of China Medical University, 2019, 48(4): 349-353
-
文章历史
- 收稿日期:2018-01-08
- 网络出版时间:2019-04-14 7:03
膀胱癌是泌尿生殖系统最常见的恶性肿瘤,90%以上为移行上皮细胞癌[1]。至今,膀胱癌的治疗进展缓慢。因此,迫切需要寻找有效的膀胱癌治疗方法[2]。
蛋白质的动态平衡是大多数真核细胞生长过程中必不可少的。其中,在蛋白质降解系统里,泛素-蛋白酶体系统(ubiquitin proteasome system,UPS)扮演着至关重要的作用,该系统降解细胞内85%以上的蛋白质[3],参与多种细胞功能,与肿瘤关系密切[4-7]。近年来,以泛素-蛋白酶体系统作为抗癌治疗靶点的研究越来越多。美国食品药品监督管理局陆续批准使用蛋白酶体抑制剂(硼替佐米、卡非佐米)治疗多发性骨髓瘤和其他一些血液系统肿瘤。事实上,蛋白酶抑制剂已经证明了干预癌症的治疗潜力。MG132是一种常用的蛋白酶体抑制剂,文献[8-11]报道,MG132可以促进多种癌细胞的细胞凋亡及逆转某些恶性特征,是一种潜在的抗肿瘤药物。本研究拟探讨MG132对膀胱癌细胞增殖及凋亡的影响,旨在为膀胱癌寻找新的治疗药物提供实验依据。
1 材料与方法 1.1 材料膀胱癌细胞系(BIU87、T24,中科院上海生命科学研究院),1640培养基(美国Gibco公司),FBS(美国Gibco公司),兔抗人caspase-3抗体、兔抗人β-Tubulin抗体、辣根过氧化物酶连接的抗兔二抗(美国Thermo Fisher公司),CCK-8试剂盒(日本同仁),Annexin V-FITC/PI细胞凋亡检测试剂盒(BD生命科学公司),MG132(德国Calbiochem公司)。
1.2 方法 1.2.1 细胞培养2种膀胱癌细胞系由RPMI 1640完全培养液(含10% FBS、1%青-链霉素双抗)在37 ℃、5% CO2恒温细胞培养箱中培养,用0.25%胰酶溶液(内含EDTA)进行消化传代,取对数生长期的细胞进行实验。
1.2.2 MG132处理膀胱癌细胞首先用稀释剂(按DMSO与无水乙醇1:1的比例配制而成)将MG132溶解为一定浓度。将细胞分为培养液处理的MOCK组(空白对照组)、只加稀释剂的NC组(阴性对照组)和实验组。实验组又进一步按不同药物终浓度、不同药物干预时间分组。将MG132按终浓度0、1、2、3、4、6、8、10 μmol/L,分别于0、1、2、4、8、12、24、48 h作用于BIU87膀胱癌细胞,CCK-8检测MG132对膀胱癌细胞增殖的影响,筛选出最佳药物终浓度、最佳药物作用时间。经筛选,后续实验按药物最佳干预条件进行。
1.2.3 CCK-8检测细胞增殖活力提前分好组,然后在96孔板中接种膀胱癌细胞并过夜,待细胞融合度达80%~90%时按上述MG132干预细胞的方法加入MG132。在37 ℃、5% CO2恒温培养箱孵育细胞适当时间。然后更换为110 μL(10 μL CCK-8原液+100 μL培养基)含CCK-8的RPMI1640培养基,放入恒温孵育箱继续培养1~4 h;用酶标仪测定在450 nm处的吸光度,并绘制细胞增殖曲线。
1.2.4 流式细胞术检测细胞凋亡按实验分组,提前1 d接种膀胱癌细胞于6孔板中,按药物最佳干预条件给予MG132处理。细胞孵育适当时间后,用不含EDTA的胰酶消化收集贴壁细胞。用预冷(4 ℃)PBS冲洗重悬细胞2次,室温1 000 r/min离心3 min,收集细胞沉淀。加入300 μL的1×结合缓冲液悬浮细胞,加入5 μL Annexin V-FITC混匀后,避光室温孵育15 min。上机前5 min加入5 μL的PI染色进行标记。上机前补加200 μL的1×结合缓冲液。最后上机进行检测。
1.2.5 Western blottingMG132处理膀胱癌细胞后,提取细胞蛋白,用BCA法检测总蛋白浓度,绘制标准曲线,计算蛋白浓度并加以调整和处理。蛋白样品进行凝胶电泳,120 v恒压电泳,电泳时间约2~3 h。110 ma恒流90 min转膜,转膜完毕后,观察marker条带是否清晰来判断是否转膜成功。用3% BSA室温封闭1~2 h,封闭后用TBST冲洗1次,5 min。然后行抗体孵育,一抗4 ℃孵育过夜(或室温4 h),TBST洗涤3次,二抗室温孵育1~2 h,TBST洗涤3次。ECL发光,采用Image J软件行结果分析。
1.3 统计学分析实验数据统计分析及作图均采用SPSS 20.0软件、Graphpad prism 6.0,组间均数比较采用t检验,2组以上数据的比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 MG132对膀胱癌细胞增殖活力的影响用不同终浓度及不同处理时间的MG132干预BIU87膀胱癌细胞,结果显示,在24 h与48 h生长曲线上,阴性对照组与空白对照组的OD450值比较,差异无统计学意义(P > 0.05)。表明MG132的稀释剂对BIU87膀胱癌细胞增殖活力无明显影响。且在相同处理时间下,与空白对照组比较,随着MG132浓度的增加,BIU87膀胱癌细胞增殖活力逐渐减低,即MG132对其细胞增殖的抑制作用逐渐增强,差异有统计学意义(P < 0.05),结果呈现出浓度依赖性的关系,即当浓度为≤2 μmol/L,对细胞增殖的抑制作用的浓度曲线趋势较陡。当浓度 > 2 μmol/L时,对细胞增殖的抑制作用逐渐趋于平稳。在相同浓度处理条件下,MG132处理时间48 h对细胞增殖的抑制作用明显高于MG132处理时间24 h(P < 0.05)。经浓度筛选,选取2 μmol/L为MG132药物处理浓度。在MG132药物处理浓度为2 μmol/L的条件下,随着药物作用时间的增加,对BIU87及T24膀胱癌细胞增殖活力的抑制作用逐渐增强(P < 0.05),结果呈现出时间依赖性关系。当处理时间≤24 h,对细胞增殖的抑制作用的浓度曲线趋势较陡。当处理时间 > 24 h,对细胞增殖的抑制作用逐渐趋于平稳。故后续实验选取24 h为MG132药物处理时间。见图 1。
|
| A, BIU87 cells were treated with various concentrations of MG132;B, BIU87 cells were treated with MG132 for various durations; C, T24 cells. *P < 0.05 vs control group; #P < 0.05 vs Mock group. 图 1 MG132对BIU87及T24膀胱癌细胞增殖活力的影响 Fig.1 Effects of MG132 on cell proliferation of BIU87 and T24 bladder cancer cells |
2.2 流式细胞术检测细胞凋亡率
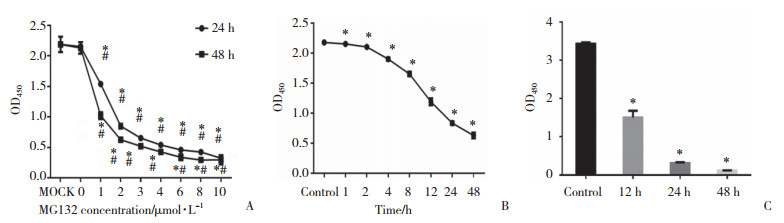
选取药物终浓度2 μmol/L、处理时间24 h为最佳药物干预条件,处理BIU87及T24 2种膀胱癌细胞。BIU87与T24膀胱癌细胞对照组的细胞总凋亡率分别为7.30%±0.36%和11.65%±0.050%,实验组的细胞总凋亡率分别20.23%±0.60%和27.95%±0.55%。2种膀胱癌细胞实验组与对照组比较,细胞总凋亡率均明显升高,差异均有统计学意义(P < 0.05)。见图 2。
|
| A, flow cytometry; B, apoptosis rate in bladder cancer cells treated with MG132. *P < 0.05 vs control group. 图 2 MG132对膀胱癌细胞总凋亡率的影响 Fig.2 The effect of MG132 on apoptosis rate of bladder cancer cells |
2.3 Western blotting检测MG132对caspase-3蛋白表达的影响
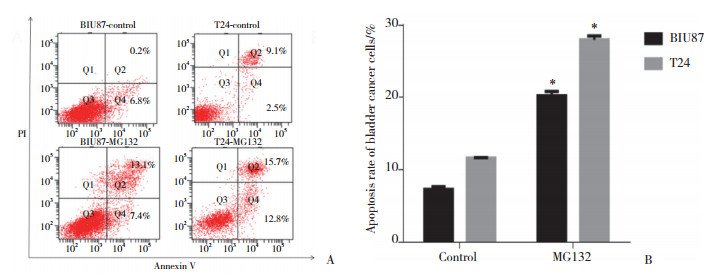
以最佳药物干预条件处理BIU87及T24 2种膀胱癌细胞后,Western blotting检测活化caspase-3(cleaved caspase-3)蛋白表达,定量分析结果显示,BIU87与T24膀胱癌细胞对照组cleaved caspase-3蛋白相对表达量分别为0.27±0.03和0.24±0.01,实验组cleaved caspase-3蛋白相对表达量分别为0.75±0.01和0.92±0.01。2种膀胱癌细胞实验组与对照组比较,实验组cleaved caspase-3蛋白相对表达量明显上调,差异均有统计学意义(P < 0.05)。见图 3。
|
| A, Western blotting; B, cleaved caspase-3 quantification. *P < 0.01 vs control group. 图 3 Cleaved caspase-3蛋白的相对表达量 Fig.3 The relative expression of cleaved caspase-3 |
3 讨论
膀胱癌是世界上第五大常见癌症,同时也是泌尿系统最常见的恶性肿瘤[1, 12]。超过80%的膀胱癌为非肌层浸润性膀胱癌,其余约20%为肌层浸润性膀胱癌或转移性膀胱癌,非肌层浸润性膀胱癌5年生存率约94%,肌层浸润性膀胱癌的5年生存率约50%,而转移性膀胱癌5年生存率则下降到20%以下[13]。早期发现膀胱癌对于改善患者的预后和总体存活率至关重要。同时,膀胱癌治疗的进展也很缓慢。因此,膀胱癌的发生发展机制以及新的治疗方法仍是目前研究的重点。
研究[9, 14]表明,泛素-蛋白酶体系统参与了细胞增殖、细胞凋亡、细胞周期、DNA修复、蛋白质折叠等多种细胞功能,与肿瘤、神经变性性疾病等疾病关系密切,该系统为癌症治疗提供了新的治疗靶点。研究[15-16]显示,使用蛋白酶体抑制剂可促进多种癌细胞的凋亡,如蛋白酶体抑制剂硼替佐米用于治疗多发性骨髓瘤患者、套细胞淋巴瘤,已成为蛋白酶体抑制剂用于抗肿瘤治疗的先例,二代抑制剂目前正处于临床研发阶段。MG132是一种常用的蛋白酶体抑制剂,有文献报道MG132可以诱导骨肉瘤[9]、甲状腺癌[8]、前列腺癌[17]、肺癌[18-19]、胆囊癌[20]等多种肿瘤细胞凋亡,是一种潜在的抗肿瘤药物。本研究运用CCK8及流式细胞术检测MG132对BIU87及T24 2种膀胱癌细胞的增殖活力和凋亡的影响,同时筛选出最佳药物终浓度、最佳药物作用时间。结果显示,MG132可以明显抑制膀胱癌细胞增殖活力及促进细胞凋亡,并呈现出浓度和时间依赖性。本研究还应用Western blotting定量检测分析了MG132对凋亡相关蛋白caspase-3活性的影响。caspase家族在细胞凋亡的过程中起着十分重要的作用,其中,caspase-3是关键的凋亡执行者,正常条件下,caspase-3以酶原的形式存在于细胞内,在多种凋亡信号刺激下,它被激活为cleaved caspase-3,最终导致细胞凋亡[19, 21]。本研究结果显示,与对照组相比较,2种膀胱癌细胞实验组的cleaved caspase-3蛋白相对表达量明显上调,差异均有统计学意义(P < 0.05)。
综上所述,蛋白酶体抑制剂MG132可以明显抑制膀胱癌细胞增殖活力,并呈现出浓度和时间依赖性,同时也可以诱导膀胱癌细胞凋亡。
| [1] |
DAL MORO F, VALOTTO C, GUTTILLA A, et al. Urinary markers in the everyday diagnosis of bladder cancer[J]. Urologia, 2013, 80(4): 265-275. DOI:10.5301/urologia.5000041 |
| [2] |
WIECZOREK E, RESZKA E. mRNA, microRNA and lncRNA as novel bladder tumor markers[J]. Clin Chim Acta, 2017, 477: 141-153. DOI:10.1016/j.cca.2017.12.009 |
| [3] |
ZHU W, LIU J, NIE J, et al. MG132 enhances the radiosensitivity of lung cancer cells in vitro and in vivo[J]. Oncol Rep, 2015, 34(4): 2083-2089. DOI:10.3892/or.2015.4169 |
| [4] |
WANG HQ, ZHANG HY, HAO FJ, et al. Induction of BAG2 protein during proteasome inhibitor-induced apoptosis in thyroid carcinoma cells[J]. Br J Pharmacol, 2008, 155(5): 655-660. DOI:10.1038/bjp.2008.302 |
| [5] |
郭佳, 孟欣, 都镇先, 等. PRDX1在蛋白酶体抑制剂诱导人甲状腺癌细胞凋亡中的作用[J]. 现代肿瘤医学, 2015, 23(4): 440-444. DOI:10.3969/j.issn.1672-4992.2015.04.02 |
| [6] |
倪晓光, 赵平. 泛素-蛋白酶体途径与恶性肿瘤关系的研究进展[J]. 中华肿瘤防治杂志, 2007, 19: 1512-1515. DOI:10.16073/j.cnki.cjcpt.2007.19.025 |
| [7] |
DANG L, WEN F, YANG Y, et al. Proteasome inhibitor MG132 inhibits the proliferation and promotes the cisplatin-induced apoptosis of human esophageal squamous cell carcinoma cells[J]. Int J Mol Med, 2014, 33(5): 1083-1088. DOI:10.3892/ijmm.2014.1678 |
| [8] |
QIANG W, SUI F, MA J, et al. Proteasome inhibitor MG132 induces thyroid cancer cell apoptosis by modulating the activity of transcription factor FOXO3a[J]. Endocrine, 2017, 56(1): 98-108. DOI:10.1007/s12020-017-1256-y |
| [9] |
SUN F, ZHANG Y, XU L, et al. Proteasome inhibitor MG132 enhances cisplatin-induced apoptosis in osteosarcoma cells and inhibits tumor growth[J]. Oncol Res, 2017, 26(4): 655-664. DOI:10.3727/096504017X15119525209765 |
| [10] |
LIU J, SHEN W, TANG Y, et al. Proteasome inhibitor MG132 enhances the antigrowth and antimetastasis effects of radiation in human nonsmall cell lung cancer cells[J]. Tumour Biol, 2014, 35(8): 7531-7539. DOI:10.1007/s13277-014-2012-z |
| [11] |
MA J, YU L, TIAN J, et al. MG132 reverse the malignant characteristics of hypopharyngeal cancer[J]. Mol Med Rep, 2014, 9(6): 2587-2591. DOI:10.3892/mmr.2014.2103 |
| [12] |
BANSAL N, GUPTA AK, GUPTA A, et al. Serum-based protein biomarkers of bladder cancer:a pre-and post-operative evaluation[J]. J Pharm Biomed Anal, 2016, 124: 22-25. DOI:10.1016/j.jpba.2016.02.026 |
| [13] |
CHAN OTM, FURUYA H, PAGANO I, et al. Association of MMP-2, RB and PAI-1 with decreased recurrence-free survival and overall survival in bladder cancer patients[J]. Oncotarget, 2017, 8(59): 99707-99721. DOI:10.18632/oncotarget.20686 |
| [14] |
SUH KS, TANAKA T, SAROJINI S, et al. The role of the ubiquitin proteasome system in lymphoma[J]. Crit Rev Oncol Hematol, 2013, 87(3): 306-322. DOI:10.1016/j.critrevonc.2013.02.005 |
| [15] |
BEDFORD L, LOWE J, DICK LR, et al. Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets[J]. Nat Rev Drug Discov, 2011, 10(1): 29-46. DOI:10.1038/nrd3321 |
| [16] |
SOAVE C L, GUERIN T, LIU J, et al. Targeting the ubiquitin-proteasome system for cancer treatment:discovering novel inhibitors from nature and drug repurposing[J]. Cancer Metastasis Rev, 2017, 36(4): 717-736. DOI:10.1007/s10555-017-9705-x |
| [17] |
SHIRLEY RB, KADDOUR-DJEBBAR I, PATEL DM, et al. Combination of proteasomal inhibitors lactacystin and MG132 induced synergistic apoptosis in prostate cancer cells[J]. Neoplasia, 2005, 7(12): 1104-1111. DOI:10.1593/neo.05520 |
| [18] |
韩玉杰.蛋白酶体抑制剂MG132促进顺铂诱导非小细胞肺癌凋亡机制的研究[D].郑州: 郑州大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10459-1014387205.htm
|
| [19] |
万千, 方震宇, 马南山, 等. 蛋白酶体抑制剂MG132联合顺铂对肺癌细胞凋亡及Caspase-3、Caspase-8蛋白表达的影响[J]. 疑难病杂志, 2016, 15(10): 1057-1060, 1101. DOI:10.3969/j.issn.1671-6450.2016.10.017 |
| [20] |
ZHU W, ZHAN D, WANG L, et al. Proteasome inhibitor MG132 potentiates TRAIL-induced apoptosis in gallbladder carcinoma GBCSD cells via DR5-dependent pathway[J]. Oncol Rep, 2016, 36(2): 845-852. DOI:10.3892/or.2016.4839 |
| [21] |
周昱岐, 叶敏, 吕灿, 等. 消痰散结方对人结直肠癌HCT116细胞增殖和凋亡及Caspase3蛋白表达的影响[J]. 中国中医药信息杂志, 2015, 22(3): 60-64. DOI:10.3969/j.issn.1005-5304.2015.03.016 |
 2019, Vol. 48
2019, Vol. 48