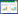文章信息
- 庄莹, 张淑红, 樊伟平, 赵小芳, 孙海燕, 刘爽, 张虎
- ZHUANG Ying, ZHANG Shuhong, FAN Weiping, ZHAO Xiaofang, SUN Haiyan, LIU Shuang, ZHANG Hu
- 乳腺癌中DEAH盒解旋酶16的表达及临床意义
- Analysis of DEAH-Box Helicase 16 Expression and Its Clinical Significance in Breast Cancer
- 中国医科大学学报, 2019, 48(4): 305-308
- Journal of China Medical University, 2019, 48(4): 305-308
-
文章历史
- 收稿日期:2018-06-07
- 网络出版时间:2019-04-16 11:39
2. 佳木斯大学基础医学院生物教研室, 黑龙江 佳木斯 154007;
3. 江苏医药职业学院护理学院内科护理教研室, 江苏 盐城 224005
2. Department of Biology, Basic Medical College, Jiamusi University, Jiamusi 154007, China;
3. Department of Internal Medicine Nursing, College of Nursing, Jiangsu Vocational College of Medicine, Yancheng 224005, China
乳腺癌是较为常见的女性恶性肿瘤之一。据最新统计,中国每年乳腺癌发病数占世界总数的12.2%,每年因乳腺癌死亡的病例数占世界总数的9.6%,且发病率和新发病例数目前仍在增加[1]。随着生活水平的提高,人们对预后的关注度也在提升。DEAH盒解旋酶16(DEAH-box helicase 16,DHX16)是一种蛋白质编码基因,与主要组织相容性抗原同样定位于染色体6p21.3,此区域与肿瘤的发生和自身免疫疾病相关[2]。但是,DHX16在乳腺癌发生和发展过程中的研究未见报道。本研究利用多组学高通量数据,分析DHX16在乳腺癌中的表达情况及表达变化相关因素,为乳腺癌临床研究提供新的思路。
1 材料与方法 1.1 数据来源通过癌症基因组学分析网站cBioPortal[3-4](http://www.cbioportal.org)、癌症芯片数据库UALCAN[5](http://ualcan.path.uab.edu/index.html)、癌症多组学数据平台LinkedOmics[6](http://www.linkedomics.org),分析乳腺癌组织中DHX16基因表达变化、基因表达变化相关因素及其临床意义。
1.2 数据分析方法 1.2.1 mRNA水平变化与基因甲基化相关性的研究方法登录cBioPortal首页,选择实时更新的TCGA浸润性乳腺癌患者数据集,分析DHX16基因突变、拷贝数变化、mRNA水平变化以及DHX16高表达与患者预后的关系。分析DHX16 mRNA水平变化时,选择RNA测序,并选择默认阈值“DHX16:EXP≥2 or DHX16:EXP≤-2”下载分析结果;进一步使用该网站分析DHX16高表达与患者预后的关系,mRNA水平变化与DHX16基因甲基化的相关性。
1.2.2 基因表达变化与癌症分型相关性的研究方法登录TCGA门户网站UALCAN首页,点击“Analysis”,输入基因名称“DHX16”,选择TCGA dataset “Breast invasive carcinoma”,检索,点击“Expression”,记录结果。利用GraphPad 6.0软件作图,统计方法为t检验,P < 0.05为差异有统计学意义。
1.2.3 mRNA水平变化与基因拷贝数变化相关性的研究方法登录LinkedOmics首页,癌症组选择“TCGA_BRCA”,检索数据集选择“HiSeq RNA”,输入目标基因“DHX16”,目标数据集选择“Clinical”,统计方法选择“Non-parametric T test”,提交,在分析结果中选择“P < 0.05”的临床相关指标进行分析;使用该网站分析DHX16 mRNA水平变化与DHX16基因拷贝数变化相关性。
1.3 统计学分析采用GraphPad软件进行统计学处理,计量资料的比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 DHX16在乳腺癌患者中表达的变化及其与预后的关系对1 093例乳腺癌患者样本数据进行分析发现,12%的患者DHX16 mRNA表达上调(图 1A);16%的患者DHX16基因发生改变,包括基因扩增、缺失、错义突变、mRNA下调或上调(图 1B);且DHX16高表达不利于乳腺癌预后(P = 0.004)(图 1C);浸润性乳腺癌中DHX16基因表达较正常乳腺组织显著增加(P < 0.001)(图 1D)。
|
| A, 12% patients express high level of DHX16 mRNA; B, DHX16 changes in 16% breast cancer patients; C, relationship between DHX16 expression and prognosis of breast cancer; D, DHX16 expression in normal tissue and breast cancer tissue. 图 1 DHX16在乳腺癌患者中表达的变化及其与预后的关系 Fig.1 Changes in DHX16 expression in breast cancer patients and its relationship with prognosis |
2.2 乳腺癌患者中DHX16基因表达变化与临床指标的相关性
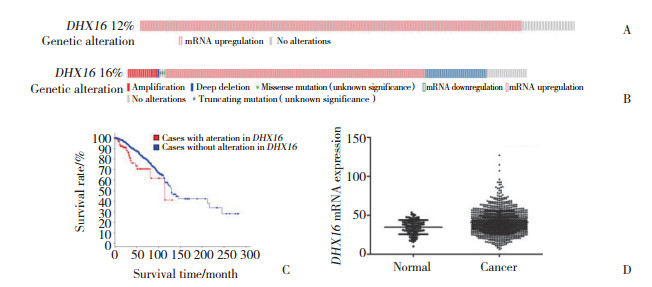
乳腺癌患者中DHX16基因表达在不同PAM50分子亚型、种族、病理分期、M分期、T分期中表达有差异(均P < 0.05)。见图 2。
|
| A, DHX16 mRNA expression across different PAM50 types; B, DHX16 mRNA expression across different human races; C, DHX16 mRNA expression across different pathological stages; D, DHX16 mRNA expression across different M stages; E, DHX16 mRNA expression across different T stages. 图 2 DHX16基因表达与各临床指标的关系 Fig.2 Correlation between DHX16 gene expression and clinical findings |
2.3 DHX16基因拷贝数变化及甲基化影响其表达
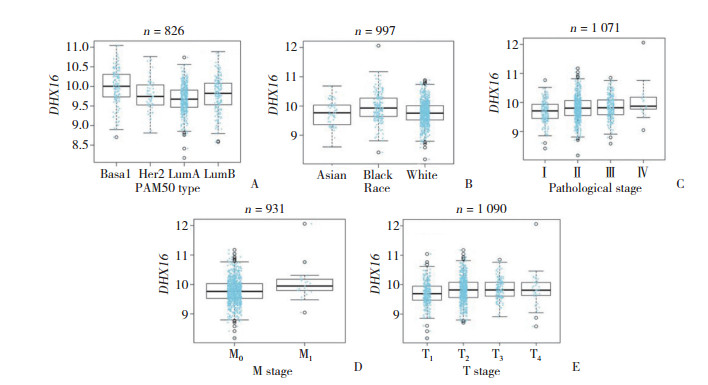
结果显示,DHX16拷贝数变化和DHX16 mRNA水平呈正相关(r = 0.56,P < 0.05)(图 3A);DHX16基因甲基化水平和DHX16 mRNA水平呈负相关(r = -0.32,P < 0.05)(图 3B)。
|
| A, correlation between the change in DHX16 copy number and mRNA expression; B, relationship between DHX16 mRNA expression and gene methylation. 图 3 乳腺癌患者DHX16基因甲基化和拷贝数变化对mRNA水平的影响 Fig.3 Effect of DNA methylation and copy number variation on DHX16 mRNA levels in breast cancer |
3 讨论
乳腺癌是中国女性患病率最高的恶性肿瘤之一,近年来确诊人数一直在增加[7]。随着乳腺癌诊断和治疗水平不断提高,患者的生存时间和生活质量得到了初步改善。由于其发病机制目前仍未完全揭示,因此预后改善程度难以满足临床需要[8]。本研究首次发现DHX16基因在乳腺癌组织中高表达,提示该分子参与乳腺癌发生与进展。本研究对其进行初步研究,为临床乳腺癌预后提供新的思路。
DHX16属于DEAD/H盒解旋酶家族[9]。该家族成员与多种恶性肿瘤及自身免疫性疾病相关[10]。DHX16具有ATP结合RNA解旋酶活性,参与细胞周期的进展和人类前体mRNA剪接过程[9],DHX16的缺失可导致前体mRNA滞留在细胞核内,无法进行蛋白质翻译[11]。另外有文献[12]报道,DHX16通过影响mRNA剪接过程,在肺癌发展中起重要作用。本研究首次发现DHX16高表达不利于乳腺癌预后,其原因可能是DHX16高表达可调节癌基因前体mRNA的剪接、转运出核并表达,促进乳腺癌的发生和进展,不利于乳腺癌预后。
对DHX16表达与临床指标进行相关性分析,发现乳腺癌患者DHX16表达与PAM50不同分子亚型相关,Basal型乳腺癌患者的DHX16表达水平最高,其次是LumB型、Her2型和LumA型乳腺癌患者。乳腺癌患者DHX16表达受种族的影响,表达具有种族特异性。乳腺癌患者DHX16表达与乳腺癌病理分期相关,随着分期增加表达上升,提示DHX16高表达可能促进乳腺癌进展。乳腺癌患者DHX16表达与乳腺癌M分期相关,远处转移M1期高于M0期,提示DHX16高表达可能促进乳腺癌转移。乳腺癌患者DHX16表达与乳腺癌T分期相关,随着肿瘤直径增大表达上升,提示DHX16高表达可能与细胞增殖相关。
基因拷贝数增加通常会引起基因表达上升[13],本研究发现DHX16表达水平与其基因拷贝变化正相关。异常的启动子DNA过度甲基化通常是导致基因沉默的调节因素之一,有研究[14]报道DNA甲基化影响乳腺癌的基因表达谱,从而影响乳腺癌的分型,同时也被作为某些癌症治疗的靶点。本研究中,DHX16基因甲基化水平与其表达水平呈负相关,说明DNA低甲基化促进了DHX16的表达。
本研究运用多组学高通量数据库分析乳腺癌患者样本,基于数据库数据大、随访时间长、组学数据完备,DHX16高表达不利于乳腺癌患者预后这一结果的可信度高,可作为乳腺癌预后的一个潜在标志物。但研究也存在一些不足,如分析结果受到样本来源的限制。后续研究中,本课题组会在更多临床乳腺癌患者样本中验证DHX16的表达差异,并进一步研究DHX16参与乳腺癌进展的分子机制。
| [1] |
FAN L, STRASSER-WEIPP K, LI JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): 279-289. DOI:10.1016/S1470-2045(13)70567-9 |
| [2] |
ZANG S, LIN TY, CHEN X, et al. GPKOW is essential for pre-mRNA splicing in vitro and suppresses splicing defect caused by dominant-negative DHX16 mutation in vivo[J]. Biosci Rep, 2014, 34(6): e00163. DOI:10.1042/BSR20140142 |
| [3] |
CERAMI E, GAO J, DOGRUSOZ U, et al. The cBio cancer genomics portal:an open platform for exploring multidimensional cancer genomics data[J]. Cancer Discov, 2012, 2(5): 401-404. DOI:10.1158/2159-8290.CD-12-0095 |
| [4] |
GAO J, AKSOY BA, DOGRUSOZ U, et al. Integrative analysis of complex cancer genomics and clinical profiles using the cBioPortal[J]. Sci Signal, 2013, 6(269): pl1. DOI:10.1126/scisignal.2004088 |
| [5] |
CHANDRASHEKAR DS, BASHEL B, BALASUBRAMANYA SAH, et al. UALCAN:a portal for facilitating tumor subgroup gene expression and survival analyses[J]. Neoplasia, 2017, 19(8): 649-658. DOI:10.1016/j.neo.2017.05.002 |
| [6] |
VASAIKAR SV, STRAUB P, WANG J, et al. LinkedOmics:analyzing multi-omics data within and across 32 cancer types[J]. Nucleic Acids Res, 2018, 46(D1): D956-D963. DOI:10.1093/nar/gkx1090 |
| [7] |
FAN L, ZHENG Y, YU KD, et al. Breast cancer in a transitional society over 18 years:trends and present status in Shanghai, China[J]. Breast Cancer Res Treat, 2009, 117(2): 409-416. DOI:10.1007/s10549-008-0303-z |
| [8] |
韩璐, 宋丰举, 陈可欣. 乳腺癌预后生物标志物研究进展[J]. 天津医药, 2016, 4(4): 404-407. DOI:10.11958/20150383 |
| [9] |
IMAMURA O, SAIKI K, TANI T, et al. Cloning and characterization of a human DEAH-box RNA helicase, a functional homolog of fission yeast Cdc28/Prp8[J]. Nucleic Acids Res, 1998, 26(9): 2063-2068. DOI:10.1093/nar/26.9.2063 |
| [10] |
文小红, 张淑芳, 张应爱. DEAD-box家族蛋白在癌症中的研究进展[J]. 中南大学学报(医学版), 2017, 42(11): 1311-1315. DOI:10.11817/j.issn.1672-7347.2017.11.011 |
| [11] |
KOVALEV N, BARAJAS D, NAGY PD. Similar roles for yeast Dbp2 and Arabidopsis RH20 DEAD-box RNA helicases to Ded1 helicase in tombusvirus plus-strand synthesis[J]. Virology, 2012, 432(2): 470-484. DOI:10.1016/j.virol.2012.06.030 |
| [12] |
PAN Y, LIU H, WANG Y, et al. Associations between genetic variants in mRNA splicing-related genes and risk of lung cancer:a pathway-based analysis from published GWASs[J]. Sci Rep, 2017, 7: 44634. DOI:10.1038/srep44634 |
| [13] |
LI J, DITTMAR RL, XIA S, et al. Cell-free DNA copy number variations in plasma from colorectal cancer patients[J]. Mol Oncol, 2017, 11(8): 1099-1111. DOI:10.1002/1878-0261.12077 |
| [14] |
YANG X, HAN H, DE CARVALHO DD, et al. Gene body methylation can alter gene expression and is a therapeutic target in cancer[J]. Cancer Cell, 2014, 26(4): 577-590. DOI:10.1016/j.ccr.2014.07.028 |
 2019, Vol. 48
2019, Vol. 48