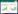文章信息
- 李汉文, 刘玲玲, 李亘松, 朱铄同, 李春雨, 邓欣
- LI Hanwen, LIU Lingling, LI Gensong, ZHU Shuotong, LI Chunyu, DENG Xin
- 油封M2与M16培养液及二甲基亚砜对小鼠双线期阻滞释放期间卵母细胞的影响
- Effects of the Mineral Oil Covered M2 Droplet Culture, M16 Droplet Culture, and DMSO on Release of Mouse Oocytes from Diplotene Arrest
- 中国医科大学学报, 2019, 48(2): 132-135
- Journal of China Medical University, 2019, 48(2): 132-135
-
文章历史
- 收稿日期:2018-05-07
- 网络出版时间:2019-01-02 11:56
2. 中国医科大学基础医学院生理学教研室, 沈阳 110122;
3. 中国医科大学附属第四医院中心实验室, 沈阳 110032
2. Department of Physiology, College of Basic Medical Science, China Medical University, Shenyang 110122, China;
3. Central Laboratory, The Fourth Affiliated Hospital, China Medical University, Shenyang 110032, China
未成熟卵细胞的体外成熟培养(in vitro maturation,IVM)技术已应用多年,但目前IVM后受精率和优质胚胎率低下,妊娠率仅为20%~30%,且流产率较高[1]。IVM的培养条件及培养环境还不够完善,卵母细胞发展成熟机制仍在不断探索中。小鼠卵母细胞取材的质量与数量对于更好地研究卵母细胞成熟机制非常重要。哺乳动物卵母细胞从卵巢卵泡中释放后,自发地恢复减数分裂。在第一次减数分裂之前,卵母细胞从萌发囊泡(germinal vesicle,GV)到胚泡破裂(germinal vesicle break down,GVBD)经历了一个漫长的过程,即双线期阻滞释放进程[2]。GVBD是核分离的开始,它是减数分裂过程中的第一个重要事件,也是卵母细胞成熟的标志[3],这一阶段卵母细胞培养的效果至关重要。因此,本研究拟探讨油封M2液滴培养与传统M16培养对GV期至GVBD期(即双线期阻滞释放期间)卵母细胞的形态及生存率的影响。
二甲基亚砜(dimethyl sulfoxide,DMSO)是一种双极性溶剂,为常用的药物溶媒,具有膜亲和力高的特点,可协助脂溶性药物透过细胞膜,促进细胞对药物的吸收利用。但DMSO具有细胞毒性,在细胞培养中超过一定剂量后会对细胞的分化、生长和凋亡产生影响[4],控制好DMSO的浓度剂量对细胞药物实验结果具有重要的影响。因此,本研究拟探索不同浓度的DMSO对双线期阻滞释放期间卵母细胞的影响。
1 材料与方法 1.1 材料健康SPF级KM雌鼠,3周龄,由中国医科大学实验动物中心提供。M2、M16培养液、矿物质油和DMSO购自中国上海Sigma-Aldrich公司。
1.2 方法 1.2.1 小鼠卵母细胞的分离颈椎脱臼法处死雌鼠。取出卵巢,用2个1 mL注射器在M2培养液中将小鼠卵巢挑破,显微镜下反复冲洗,游离出裸露的GV期卵母细胞。
1.2.2 培养微滴的制备用50 μL移液器在35 mm无菌塑料组织培养皿的底部做20个规则排列的30 μL M16培养微滴,用于直接培养卵母细胞(M16组)。用同样方法制备20滴30 μL M16培养微滴,然后立即在培养微滴上覆盖矿物质油,将培养皿置于37 ℃、5%CO2培养箱内过夜平衡(油封M16组),次日用于培养卵母细胞[5]。用同样方法制备20滴30 μL M2培养微滴,立即在培养微滴上覆盖矿物质油,用于直接培养卵母细胞(油封M2组)。
1.2.3 卵母细胞在不同培养微滴中的分组培养及观察取分离的卵母细胞,随机分为60组,每组30个,在显微镜下将60组卵母细胞随机置入3种各20滴的培养微滴中,置于37 ℃、5%CO2培养箱内培养4 h。显微镜下观察每组卵母细胞生存率及GV期和GVBD期卵母细胞的数目和形态改变。
1.2.4 卵母细胞在不同浓度DMSO中的分组培养及观察取分离的卵母细胞,随机分为30组,每组50个,在显微镜下将细胞随机分入含0%(对照组)、1%和2% DMSO的M2培养微滴中(每种浓度各10组),置于37 ℃、5%CO2培养箱内培养4 h。显微镜下观察每组卵母细胞生存率及GV期和GVBD期卵母细胞的数目。
1.3 统计学分析采用SPSS 16.0软件进行统计分析。2组间均数比较采用t检验,多组间均数比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 不同培养基中小鼠卵母细胞的生存率油封M2组卵母细胞的生存率(98.65%±2%)高于油封过夜M16液滴培养组(90.35%±6%),M16直接培养存活率(32.75%±14%)极低,差异有统计学意义(P < 0.05)。见图 1。
|
| * P < 0.05 vs M2 covered with mineral oil group and M16 group; ** P < 0.01 vs M2 covered with mineral oil group and M16 covered with mineral oil group. 图 1 不同培养基对卵母细胞存活率的影响 Fig.1 Effect of different culture media on survival rate of oocytes |
2.2 不同培养基对小鼠卵母细胞GV期和GVBD期数目的影响
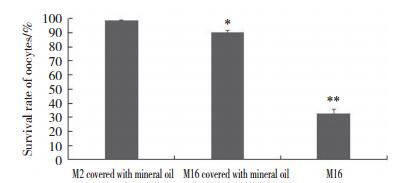
油封M2组与油封M16组停留在GV期的卵母细胞数(油封M2组GV:16.10%±6%;油封M16组GV:14.40%±6%)比较,差异无统计学意义(P > 0.05)。见图 2。
|
| 图 2 M2与M16培养4 h小鼠卵母细胞GV期与GVBD期数量比例 Fig.2 Percentage of GV and GVBD of mouse oocytes cultured in M2 and M16 after 4 h |
2.3 不同培养基对小鼠卵母细胞形态的影响
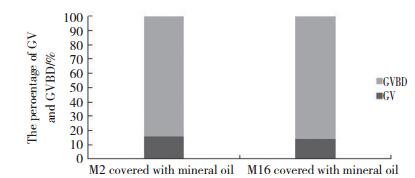
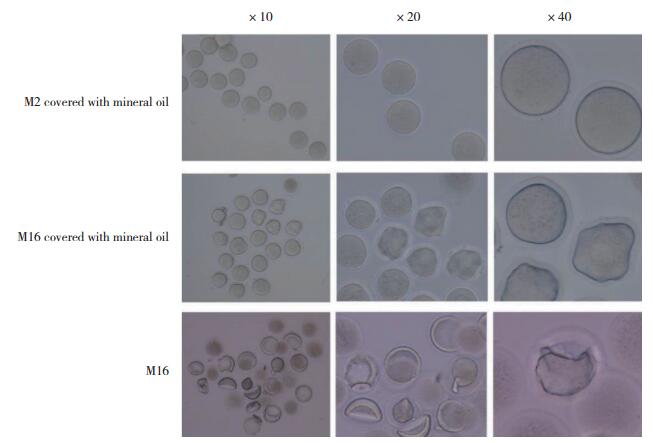
如图 3所示,与油封过夜M16和单纯M16液滴培养的卵母细胞相比,油封M2液滴培养的细胞形态更好更完整。
|
| 图 3 不同培养液对卵母细胞形态的影响 Fig.3 Effect of different culture media on the morphology of oocytes |
2.4 不同浓度DMSO对培养的小鼠卵母细胞存活率的影响
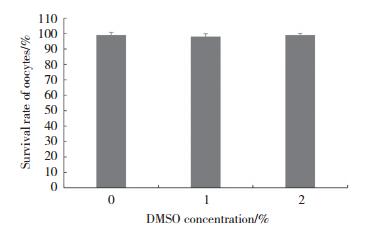
对照组、1%DMSO组和2%DMSO组卵母细胞在双线期阻滞期间的存活率(对照组:98.50%±1.7%;1%DMSO组:97.54%±1.9%;2%DMSO组:99.00%±1.0%)无统计学差异。见图 4。
|
| 图 4 不同浓度DMSO对卵母细胞存活率的影响 Fig.4 Survival rate of oocytes in medium with different concentrations of DMSO |
2.5 不同浓度DMSO对小鼠卵母细胞双线期阻滞释放的影响
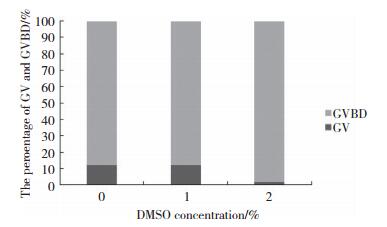
对照组和1%DMSO组卵母细胞培养4 h后,卵母细胞停留在GV期和GVBD期的比例无明显差异(P > 0.05),2%DMSO组卵母细胞停留在GV期的比例显著降低(对照组:11.67%±4.58%;1%DMSO组:12.46%±5.84%;2%DMSO组:2.00%±2.83%,P < 0.01)。表明DMSO浓度达2%时对卵母细胞双线期阻滞释放有促进作用,而1%以下浓度的DMSO对卵母细胞双线期阻滞释放无显著影响。见图 5。
|
| 图 5 不同浓度DMSO培养小鼠卵母细胞4h GV期与GVBD期数目比例 Fig.5 Percentage of GV and GVBD of mouse oocytes cultured in medium with different concentrations of DMSO |
3 讨论
卵母细胞的成熟对哺乳动物的繁殖至关重要。然而,控制卵母细胞成熟的机制一直众说纷纭。哺乳动物卵母细胞成熟与卵泡发育有关,同时细胞核包膜和染色体分离的调控是卵母细胞减数分裂和受精卵有丝分裂的重要事件[6-7]。卵泡颗粒细胞产生的抑制因子能够使卵母细胞被阻滞在第一次减数分裂前期(前期Ⅰ),即GV期,也称双线期阻滞。当卵母细胞从卵泡中释放后,自发地恢复减数分裂[8-9],即双线期阻滞释放,在第一次减数分裂之前,哺乳动物的卵母细胞从GV期发育到了GVBD期。GVBD是核分离的开始,是减数分裂过程中的第一个重要事件,也是卵母细胞成熟的标志。
本研究结果显示,在从GV发育到GVBD期间,油封M2液滴培养的卵母细胞比油封过夜和单纯M16液滴培养的卵母细胞生存率更高,细胞形态更佳。M2培养液中含有4-羟乙基哌嗪乙磺酸[4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPES],该成分能够有效维持培养液pH值,有利于所有配子和胚胎的体外操作[5]。而M16培养液中则不含有HEPES成分,缺乏维持恒定pH值的能力,因此,需要在培养前4~6 h或1 d制作并覆盖矿物质油后放入培养箱内平衡[5]。但本研究结果显示,油封M16液滴培养的卵母细胞的形态及存活率仍不及油封M2组。提示利用油封M2液滴短时间培养卵母细胞,不仅能节省制备培养液的时间,而且更容易获得满意的卵母细胞状态和生存率,有利于提高实验效率与实验结果的准确可信性。
在进行药物细胞实验时,需要将药物溶解后加入细胞培养基中,为了获得准确可信的结果,必须尽量减少溶媒本身对细胞的影响。DMSO是一种常用的药物溶媒,研究发现,DMSO对某些癌细胞的生长具有剂量依赖性和时间依赖性影响,不同种类的癌细胞对DMSO的耐受剂量亦不同[4, 9]。本研究结果显示,1%和2%浓度的DMSO不会影响培养卵母细胞的生存率,但是2%浓度的DMSO能更有效地促进卵母细胞双线期阻滞的释放,因此,在进行卵母细胞发展成熟进程的实验中,应合理控制DMSO的浓度,以确保实验结果的准确性和可信性。
| [1] |
郭剑, 罗萌萌, 崔静. HCG对小鼠卵母细胞体外成熟的影响[J]. 中国煤炭工业医学杂志, 2017, 20(3): 310-311. |
| [2] |
ZHENG P, BAIBAKOV B, WANG XH, et al. PtdIns (3, 4, 5) P3 is constitutively synthesized and required for spindle translocation during meiosis in mouse oocytes[J]. Cell Sci, 2013, 126(Pt 3): 715-721. DOI:10.1242/jcs.118042 |
| [3] |
MENG J, CUI C, LIU Y, et al. The role of 14-3-3εinteraction with phosphorylated Cdc25B at its Ser321 in the release of the mouse oocyte from prophaseⅠarrest[J]. Plos One, 2013, 8(1): e53633. DOI:10.1371/journal.pone.0053633 |
| [4] |
李俊东, 裴晓川, 白春强, 等. 二甲基亚砜(DMSO)对骨髓瘤细胞RPMI8226影响的研究[J]. 吉林医学, 2017, 38(1): 83-84. DOI:10.3969/j.issn.1004-0412.2017.01.029 |
| [5] |
NagyA, GertsensteinM, VinterstenK, 等. 小鼠胚胎操作实验手册[M]. 第3版. 北京: 化学工业出版社, 2006: 1-537.
|
| [6] |
LETE MG, BYRNE RD, ALONSO A, et al. Vesicular PtdIns (3, 4, 5) P3 and Rab7 are key effectors of sea urchin zygote nuclear membrane fusion[J]. Cell Sci, 2017, 130(2): 444-452. DOI:10.1242/jcs.193771 |
| [7] |
ZHAO MH, KIM NH, CUI XS. Zinc depletion activates porcine metaphaseⅡoocytes independently of the protein kinase C pathway[J]. In Vitro Cell Dev Biol Anim, 2014, 50(10): 945-951. DOI:10.1007/s11626-014-9784-8 |
| [8] |
DA ROSA PRA, DE CESARO MP, PEREIRA DAU AM, et al. Reversible meiotic arrest of bovine oocytes by EGFR inhibition and follicular hemisections[J]. Theriogenology, 2017, 99: 53-62. DOI:10.1016/j.theriogenology.2017.05.014 |
| [9] |
ABOUZARIPOUR M, FATHI F, DANESHI E, et al. Combined effect of retinoic acid and basic fibroblast growth factor on maturation of mouse oocyte and subsequent fertilization and development[J]. Int J Fertil Steril, 2018, 12(1): 68. DOI:10.22074/ijfs.2018.5293 |
 2019, Vol. 48
2019, Vol. 48