文章信息
- 孙敬茹, 陈克研, 孙倩, 韩梅
- SUN Jingru, CHEN keyan, SUN Qian, HAN Mei
- 表没食子儿茶素没食子酸酯对糖尿病大鼠心脏的保护作用及对TGF-β1/Smad3信号通路表达的影响
- Protective Effect of Epigallocatechin Gallate on Diabetic Rat Hearts via TGF-β1/Smad3 Signaling Pathway
- 中国医科大学学报, 2019, 48(2): 119-123
- Journal of China Medical University, 2019, 48(2): 119-123
-
文章历史
- 收稿日期:2018-05-08
- 网络出版时间:2019-01-02 15:54
2. 中国医科大学实验动物部, 沈阳 110122
2. Department of Laboratory animal Science, China Medical University, Shenyang 110122, China
糖尿病心肌病(diabetic cardiomyopathy,DC)是糖尿病的一种较常见的并发症,目前已经证明心肌异常和糖尿病之间存在因果关系。据统计,DC约占糖尿病患者的12%,并可能导致心力衰竭和死亡[1-3]。链脲佐菌素(streptozocin,STZ)对胰岛β细胞有细胞毒性作用,短期高糖高脂饮食联合STZ腹腔注射是目前较常用的诱导2型糖尿病动物模型的常用方法[4-6]。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是从绿茶中提取的儿茶素类单体,是茶多酚主要的活性和水溶性成份,是儿茶素中含量最高的组分[7]。因其特殊的化学结构,具有较强的抗氧化能力,目前主要用于抗肿瘤和预防心血管疾病[8]。本研究在建立2型糖尿病大鼠模型的基础上给予EGCG,观察其对糖尿病大鼠心肌损伤的保护作用,进一步探讨其对TGF-β1/Smad3信号通路表达的影响,为DC的防治奠定基础。
1 材料与方法 1.1 实验动物及分组清洁级SD大鼠,雄性,体质量200~220 g,由北部战区总医院实验动物科提供,通过实验动物福利伦理审查,动物自由饮食水。采用随机数字表法将动物平均分成4组,分别为假手术组(Sham组)、2型糖尿病心肌病模型组(DC组)、EGCG组[于糖尿病模型建立成功后,腹腔注射EGCG(100 mg/kg)28 d]和二甲双胍阳性对照组[Met组,于糖尿病模型建立成功后,每天给予大鼠二甲双胍灌胃(140 mg/kg),连续28 d]。
1.2 糖尿病大鼠模型建立大鼠饲喂高脂饲料8周。用0.1 mmol/L无菌枸橼酸缓冲液配置为6.5 g/ L、pH4.3的STZ溶液,腹腔注射40 mg/kg,72 h后检测血糖,血糖≥16.7 mmol/L认为造模成功。
1.3 样本采集与检测于给药28 d后用生理记录仪检测各组大鼠心脏功能,收集血液,一部分送检验科检测甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、糖化血红蛋白(blood hemoglobin ALC,HbAlc)和空腹血糖(fasting blood glucose,FBG),另一部分分离血清用于ELISA检测。另取心脏组织样本,一部分固定于多聚甲醛中,剩余部分于-80 ℃冰箱保存。
1.4 ELISA检测为观察EGCG对DC氧化应激、心功能的影响,采用ELISA试剂盒(南京建成生物技术有限公司)检测超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(methane dicarboxylic aldehyde,MDA)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化酶(glutathione peroxidase,GPX)的含量,具体步骤参照说明书进行:在酶标板上加入标准品,依次倍比稀释;每孔加入血清样本100 μL,37 ℃温育60 min,洗涤液洗涤5次;每孔加入50 μL酶标二抗,37 ℃温育30 min;每孔加入显色剂A和B各50 μL,37 ℃避光显色15 min;每孔加入终止液50 μL;酶标仪检测450 nm处的吸光度值,绘制标准曲线,计算样品浓度。
1.5 Masson染色观察心肌组织甲醛固定组织48 h后,进行脱水、透明、浸蜡后对心肌组织进行石蜡包埋,将包埋好的心肌组织连续切片后,将切片脱蜡至水,用Regaud苏木精染液染色5 min,充分洗涤,盐酸乙醇分化3~5 s,用Masson丽春红酸性复红液染色5 min,以2%冰醋酸水溶液浸洗,1%磷钼酸水溶液分化3 min,光绿液染5 min;以0.2%冰醋酸水溶液浸洗,95%乙醇、无水乙醇、二甲苯透明、中性树胶封固。
1.6 Western blotting检测大鼠心肌组织中转化生长因子β1(transforming growth factor β1,TGF-β1)、pSmad3和Smad3表达将心肌组织置于含有蛋白酶抑制剂的RIPA裂解液中,于冰上对心肌组织进行匀浆,收集上清液后,使用BCA蛋白定量试剂盒对蛋白进行定量,对蛋白进行SDS-PAGE电泳、用PVDF膜转膜后,加入TGF-β1(ab92486),Smad3(ab40854),pSmad3(ab52903)抗体,4 ℃孵育过夜,加入辣根过氧化物酶标记的二抗,室温孵育2 h后,使用ECL发光试剂盒和凝胶成像系统对蛋白进行显色,结果使用Image Tools进行吸光度分析。
1.7 统计学分析采用SPSS 19.0统计软件进行分析,计量资料采用x±s表示,各组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 EGCG对DC大鼠血糖和血脂的影响与Sham组相比,DC组大鼠TG、TC、HbA1c和FBG水平显著升高,差异有统计学意义(P < 0.05);与DC组相比,EGCG组和Met组大鼠TG、TC、HbA1c和FBG水平显著降低,差异有统计学意义(P < 0.05)。见表 1。
| Group | TG(mmmol/L) | TC(mmol/L) | HbA1c(%) | FBG(mmol/L) |
| Sham | 0.682±0.084 | 1.712±0.532 | 25.731±3.224 | 5.272±1.082 |
| DC | 1.374±0.0931) | 5.417±0.6721) | 39.853±2.8821) | 18.531±1.8841) |
| EGCG | 0.871±0.0672) | 3.212±0.4112) | 26.532±1.8312) | 6.742±0.9412) |
| Met | 0.822±0.0692) | 2.182±0.3412) | 25.984±2.1122) | 7.032±1.1162) |
| 1)P < 0.05,compared with Sham group;2)P < 0.05,compared with DC group. | ||||
2.2 EGCG对DC大鼠心脏功能的影响
与Sham组相比,DC组大鼠左心室舒张末期压力(left ventricular end dilated pressure,LVEDP)、左心室收缩压(left ventricular systolic pressure,LVSP)和左心室内压上升段/下降段最大变化速率(maximal rate of the increase/decrease of left ventricular pressure,±dp/dtmax)的绝对值均显著下降,差异有统计学意义(P < 0.05);与DC组相比,EGCG组和Met组大鼠LVEDP、LVSP和±dp/dtmax的绝对值均显著升高,差异有统计学意义(P < 0.05)。见表 2。
| Group | LVEDP(kPa) | LVBP(kPa) | +dp/dtmax(kPa/s) | -dp/dtmax(kPa/s) |
| Sham | 1.573±0.075 | 19.732±1.231 | 1 562.342±184.531 | 1 348.921±219.413 |
| DC | 0.652±0.0841) | 12.842±1.4411) | 785.275±87.9311) | 681.937±73.4941) |
| EGCG | 1.273±0.0922) | 17.617±1.8242) | 1 242.280±113.1172) | 884.441±88.3232) |
| Met | 1.259±0.0772) | 17.942±1.6612) | 1 318.470±109.8422) | 949.821±98.7172) |
| 1)P < 0.05,compared with Sham group;2)P < 0.05,compared with DC group. | ||||
2.3 EGCG对DC大鼠血清SOD、MDA、CAT和GPX水平的影响
与Sham组相比,DC组大鼠血清中MDA水平显著升高,而SOD、CAT和GPX水平显著降低,差异有统计学意义(P < 0.05);与DC组相比,EGCG组和Met组大鼠血清中MDA水平显著降低,而SOD、CAT和GPX水平显著升高,差异有统计学意义(P < 0.05)。见表 3。
| Group | SOD(kU/L) | MDA(μmol/L) | CAT(kU/L) | GPX(kU/L) |
| Sham | 607.531±27.832 | 2.131±0.292 | 658.542±19.231 | 556.812±12.394 |
| DC | 452.440±31.2261) | 7.577±0.2311) | 251.136±14.6541) | 301.180±16.8311) |
| EGCG | 533.430±28.9312) | 5.127±0.1732) | 339.837±16.8342) | 388.920±18.9422) |
| Met | 554.484±21.0402) | 4.994±0.2022) | 349.853±10.9312) | 406.810±15.3362) |
| 1)P < 0.05,compared with Sham group;2)P < 0.05,compared with DC group. | ||||
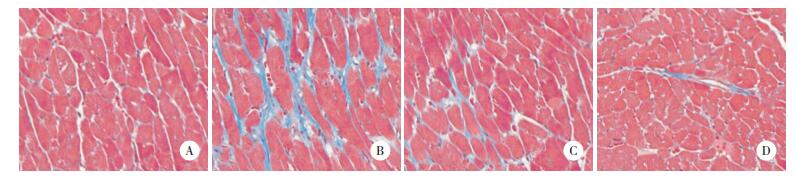
2.4 Masson染色
与Sham组相比,DC组大鼠心肌组织见大量胶原沉积,心肌纤维化程度较重;与DC组相比,EGCG组和Met组偶见少量胶原沉积,心肌纤维化程度明显改善,均趋于正常化。见图 1。
|
| A, Sham group; B, DC group; C, EGCG goup; D, Met group. 图 1 Masson染色检测各组大鼠心肌组织病理学变化×200 Fig.1 Masson staining was used to detect pathological changes in the cardiac muscle tissues of the rats in each group ×200 |
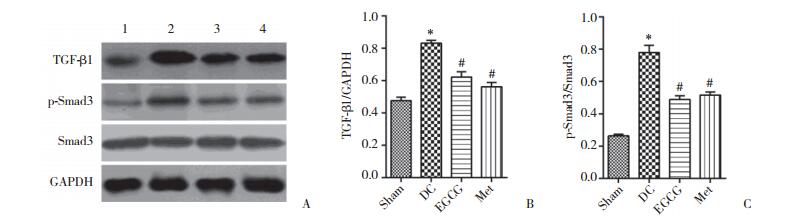
2.5 Western blotting检测TGF-β1、pSmad3和Smad3蛋白表达
与Sham组相比,DC组心肌组织中的TGF-β1、pSmad3表达升高,差异有统计学意义(P < 0.05);与DC组相比,EGCG组和Met组TGF-β1、pSmad3蛋白表达显著降低,差异有统计学意义(P < 0.05);EGCG组和Met组TGF-β1、pSmad3蛋白表达相近,差异无统计学意义(P > 0.05);各组Smad3表达差异均无统计学意义(P > 0.05),见图 2。
|
| A, Western blotting; B, relative expression level of TGF-β1; C, relative activation level of pSmad3. * P < 0.05, compared with Sham group; # P < 0.05, compared with DC group. 1, Sham group; 2, DC group; 3, EGCG group; 4, Met group. 图 2 Western blotting法检测心肌组织中TGF-β1、pSmad3和Smad3蛋白表达水平 Fig.2 Western blotting analysis of the expression levels of TGF-β1, p-Smad3, and Smad3 proteins in rat cardiac muscle tissues |
3 讨论
研究[9]表明,高脂饮食合并STZ诱导的糖尿病大鼠会出现严重的心肌损伤,主要表现为心脏功能障碍、心肌氧化应激增加以及心肌纤维化。本研究利用Masson染色、ELISA和Western blotting等技术观察EGCG对大鼠心脏组织、血糖、血脂、心功能、氧化应激因子及TGF-β1/smad3通路蛋白表达的影响。结果提示,EGCG可以减轻糖尿病导致的心肌损伤,其机制可能与TGF-β1/smad3信号通路有关。糖尿病可以引起严重的心功能损伤,甚至导致心力衰竭和死亡。积极预防DC的发生发展一直都是急需解决的重点和难点。本研究为DC提供了实验理论依据。
糖尿病是一种胰岛素分泌绝对或相对不足的代谢性疾病,常常表现为以高血糖为典型特征的代谢紊乱,并伴随心脏、脑、肾脏等严重并发症,其中心血管并发症已经成为糖尿病主要死亡原因,其临床主要表现为心脏舒张和收缩功能障碍以及心肌结构的改变[10]。有研究[11]表明,DC患者体内氧化应激明显增强,是导致心肌收缩和舒张功能障碍的主要因素。本研究发现,模型建立后,大鼠出现严重的血脂异常和高血糖现象,心脏收缩和舒张障碍,心肌结构损伤严重,大鼠心脏和血清中氧化应激产物MDA含量明显增高,而抗氧化应激酶SOD、CAT和GPX显著降低。提示糖尿病可导致严重的心肌损伤和代谢紊乱,其可能与大鼠体内氧化应激增强有关。
EGCG是从绿茶中提取的一种主要的生物活性多酚,已被发现具有强效的抗氧化剂和自由基清除特性。EGCG对心血管功能具有多种有益作用,包括减少心肌损伤,减轻体外和体内缺血后心肌功能障碍。张妍淞等[12]研究发现,EGCG对阿霉素引起的心血管损伤具有显著的保护作用,其保护作用与降低心肌细胞凋亡,提高抗氧化防御和保护线粒体有关。本研究建立DC大鼠模型,予EGCG干预,发现EGCG可以缓解糖尿病导致的代谢紊乱,对心脏功能结构具有保护作用,能够抑制氧化应激反应。其对糖尿病大鼠心肌的保护作用可能与抑制氧化应激有关。
TGF-β作为调节细胞分化和生长的TGF-β超家族的成员,主要作用为促进成纤维细胞、成骨细胞和雪旺氏细胞的生长[13]。Smad3是TGF-β1/ Smad3信号通路激活的标志,已有研究[14]证实,TGF-β1/ Smad3信号通路途径可调节糖尿病大鼠的氧化应激水平。KO等[15]的研究表明,EGCG能改善慢性阻塞性肺疾病大鼠的肺损伤,其作用机制与调控肺TGF-β /Smad3水平、抑制氧化应激和炎症反应有关。本研究建立2型糖尿病心肌病模型,心肌组织中TGF-β1、smad3表达升高,经EGCG干预后,TGF-β1、smad3蛋白表达显著降低。提示糖尿病所导致的心肌损伤可能与促进TGF-β1、smad3表达,增强氧化应激有关,而EGCG可以通过TGF-β1/Smad3信号通路途径介导氧化应激来保护糖尿病大鼠心肌损伤。
| [1] |
WILLIAMS LJ, NYE BG, WENDE AR. Diabetes-related cardiac dysfunction[J]. Endocrinol Metab, 2017, 32(2): 171-179. DOI:10.3803/EnM.2017.32.2.171 |
| [2] |
JIA G, WHALEY-CONNELL A, SOWERS JR. Diabetic cardiomyopathy:a hyperglycaemia-and insulin-resistance-induced heart disease[J]. Diabetologia, 2018, 61(1): 21-28. DOI:10.1007/s00125-017-4390-4 |
| [3] |
GHOSH N, KATARE R. Molecular mechanism of diabetic cardiomyopathy and modulation of microRNA function by synthetic oligonucleotides[J]. Cardiovasc Diabetol, 2018, 17(1): 43. DOI:10.1186/s12933-018-0684-1 |
| [4] |
GOYAL SN, REDDY NM, PATIL KR, et al. Challenges and issues with streptozotocin-induced diabetes-a clinically relevant animal model to understand the diabetes pathogenesis and evaluate therapeutics[J]. Chem Biol Interact, 2016, 244: 49-63. DOI:10.1016/j.cbi.2015.11.032 |
| [5] |
SZKUDELSKI T. Streptozotocin-nicotinamide-induced diabetes in the rat. Characteristics of the experimental model[J]. Exp Biol Med (Maywood), 2012, 237(5): 481-490. DOI:10.1258/ebm.2012.011372 |
| [6] |
BRITO-CASILLAS Y, MELIAN C, WAGNER AM. Study of the pathogenesis and treatment of diabetes mellitus through animal models[J]. Endocrinol Nutr, 2016, 63(7): 345-353. DOI:10.1016/j.endonu.2016.03.011 |
| [7] |
ENG QY, THANIKACHALAM PV, RAMAMURTHY S. Molecular understanding of Epigallocatechin gallate (EGCG) in cardiovascular and metabolic diseases[J]. J Ethnopharmacol, 2018, 210: 296-310. DOI:10.1016/j.jep.2017.08.035 |
| [8] |
GAN RY, LI HB, SUI ZQ, et al. Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG):an updated review[J]. Crit Rev Food Sci Nutr, 2018, 58(6): 924-941. DOI:10.1080/10408398.2016.1231168 |
| [9] |
WANG XT, GONG Y, ZHOU B, et al. Ursolic acid ameliorates oxidative stress, inflammation and fibrosis in diabetic cardiomyopathy rats[J]. Biomed Pharmacother, 2018, 97: 1461-1467. DOI:10.1016/j.biopha.2017.11.032 |
| [10] |
SHI GJ, SHI GR, ZHOU JY, et al. Involvement of growth factors in diabetes mellitus and its complications:a general review[J]. Biomed Pharmacother, 2018, 101: 510-527. DOI:10.1016/j.biopha.2018.02.105 |
| [11] |
SHARMA A, TATE M, MATHEW G, et al. Oxidative stress and nlrp3-inflammasome activity as significant drivers of diabetic cardiovascular complications:therapeutic implications[J]. Front Physiol, 2018, 9: 114. DOI:10.3389/fphys.2018.00114 |
| [12] |
张妍淞, 李文娟, 宁佳鸣, 等. EGCG表没食子儿茶素没食子酸酯对阿霉素所致小鼠心肌细胞凋亡的影响[J]. 中国食品学报, 2017(10): 16-22. DOI:10.16429/j.1009-7848.2017.10.003 |
| [13] |
DAVID CJ, MASSAGUE J. Contextual determinants of TGFbeta action in development, immunity and cancer[J]. Nat Rev Mol Cell Biol, 2018, 19(7): 419-435. DOI:10.1038/s41580-018-0007-0 |
| [14] |
DING D, DU Y, QIU Z, et al. Vaccination against type 1 angiotensin receptor prevents streptozotocin-induced diabetic nephropathy[J]. J Mol Med (Berl), 2016, 94(2): 207-218. DOI:10.1007/s00109-015-1343-6 |
| [15] |
KO H, SO Y, JRON H, et al. TGF-beta1-induced epithelial-mesenchymal transition and acetylation of Smad2 and Smad3 are negatively regulated by EGCG in human A549 lung cancer cells[J]. Cancer Lett, 2013, 335(1): 205-213. DOI:10.1016/j.canlet.2013.02.018 |
 2019, Vol. 48
2019, Vol. 48