文章信息
- 赵鹏, 朱博, 赵尉, 洪浩然, 邢晓静
- ZHAO Peng, ZHU Bo, ZHAO Wei, HONG Haoran, XING Xiaojing
- 肿瘤基线代谢参数预测弥漫大B细胞淋巴瘤预后的价值
- The Prognostic Value of Baseline Metabolic Parameters of 18F-FDG PET/CT in Predicting the Treatment Efficacy in Patients with Diffuse Large B-Cell Lymphoma
- 中国医科大学学报, 2019, 48(12): 1122-1126
- Journal of China Medical University, 2019, 48(12): 1122-1126
-
文章历史
- 收稿日期:2019-01-03
- 网络出版时间:2019-12-05 14:10
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常见的一种非霍奇金淋巴瘤亚型,占所有非霍奇金淋巴瘤的1/3。随着免疫化学疗法的临床应用,DLBCL成为一种可治愈的疾病[1],但约有20%~40%的患者一线治疗失败,预后极为不良[2]。因此,准确评估并确定早期进展或复发风险高的患者,对制定治疗方案非常重要[3]。美罗华的问世开辟了DLBCL治疗的新时代,大幅延长了淋巴瘤患者的生存期。本研究拟分析代表肿瘤负荷的不同糖代谢参数对预测美罗华时代DLBCL治疗的预后价值,并分析可能与体内肿瘤糖酵解率(total lesion glycolysis,TLG)增强相关的血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平[4]与正电子发射计算机断层扫描(positron emission tomography/computed tomography,PET/CT)葡萄糖代谢显像各代谢参数的相关性。
1 材料与方法 1.1 临床资料回顾性分析2012年8月至2018年2月我院DLBCL病例非特指NOS亚型51例,所有患者均经病理及免疫组化确诊,均于治疗前2周内行基线全身PET/CT糖代谢显像,并接受R-CHOP(利妥昔单抗-环磷酰胺+蒽环类+长春新碱+泼尼松)方案作为一线化疗方案。其中,男25例,女26例,平均年龄(57.37±15.02)岁。Ann Arbor分期Ⅰ~Ⅱ期(早中期)18例(35.3%),Ⅲ~Ⅳ期(中晚期)33例(64.7%)。根据NCCN-IPI评分标准[5],0~3分(低中危)21例(41.2%),4~8分(中高危)30例(58.8%)。免疫组化生发中心来源20例(39.2%),非生发中心来源31例(60.8%)。结外受累26例(51%),无受累25例(49%)。
1.2 扫描显像方法采用美国GE公司Discovery VCT 64 PET/CT设备显像,氟-代脱氧葡萄糖(fluorine-18-fludeoxyglucose,18F-FDG)为我院生产合成,放化纯 > 95%。所有患者禁食8 h以上,注药前测量患者身高、体质量及血糖(控制在10 mmol/L以下)。注药(4.4~5.5 MBq/kg)后,嘱患者平卧静息休息,45~60 min后行全身PET/CT显像;图像采集采用140 kV,自动毫安,容积成像,重建层厚3.75 mm,PET图像根据患者身高采集6~7个床位,每个床位2.5~3 min。采集图像时患者保持平静呼吸,根据CT扫描数据进行PET衰减校正。
1.3 图像分析应用GE AW4.5工作站进行图像处理及代谢指标测量,图像分析由2名核医学医生共同完成。阳性病灶由视觉评估定义为局限性或弥漫的高于周围本底摄取的病灶,并排除正常的解剖或生理性摄取所致的代谢增高[6],最大标准摄取值(maximum standardized uptake value,SUVmax)及平均摄取值(mean standardized uptake value,SUVmean)由AW软件自动测量,肿瘤总代谢体积(total metabolic tumor volume,TMTV)用AW软件41%SUVmax阈值法自动测量,并将所有高代谢病灶的代谢体积相加而成[7]。TLG= TMTV×SUVmean。所有计算结果均由2名医生测量并复核正确。
1.4 统计学分析采用SPSS 20.0软件进行统计分析。计量资料符合正态分布的以均值表示,非正态分布的数据以中位数表示;受试者工作特征(receiver operating characteristic,ROC)曲线分析用于确定SUVmax、SUVmean、TMTV和TLG预测肿瘤进展或复发的可视化界值,相关性分析采用Spearman检验。生存分析应用Kaplan-Meier法,各预后危险因素、NCCN-IPI、SUVmax、TMTV和TLG各组间差异采用χ2检验。多因素分析采用Cox回归分析。双尾P < 0.05被定义为有统计学意义。
1.5 随访通过电话及门诊随访,截止至2018年12月,中位随访时间为12个月,无进展生存(progression-free survival,PFS)期时间为通过病理确诊DLBCL至首次出现病情进展或排除其他因素所致死亡的时间。
2 结果 2.1 患者随访情况至随访结束,51例患者中,20例复发或进展,中位PFS时间为12.0个月(1.0~64.0个月),2年PFS率为25.5 %(13/51)。
2.2 肿瘤代谢参数与血清LDH水平的相关性分析如表 1所示,51例患者的TMTV及TLG与血清LDH水平的相关性较强,而SUVmax及SUVmean与LDH水平相关性较弱。
| Variable | Median/mean | coefficient with LDH | P |
| SUVmax | 19.2 | 0.402 | 0.003 |
| TMTV | 80.0 | 0.587 | < 0.001 |
| SUVmean | 11.3 | 0.407 | 0.003 |
| TLG | 1014.8 | 0.623 | < 0.001 |
2.3 SUVmax、TMTV、SUVmean和TLG预测肿瘤进展或复发的界值
ROC曲线分析结果显示,SUVmax为16.0时,Youden指数最大(0.234),预测肿瘤进展或复发的灵敏度为75.0%,特异度为48.4%,曲线下面积(area under curve,AUC)为0.576;TMTV为153时,Youden指数最大(0.274),预测肿瘤进展或复发的灵敏度为50.0%,特异度为77.4%,AUC为0.608;AVG为8.50时,Youden指数最大(0.237),预测肿瘤进展或复发的灵敏度为85.0%,特异度为35.7%,AUC为0.573;TLG为470.0时,Youden指数最大(0.284),预测肿瘤进展或复发的灵敏度为80.0%,特异度为48.4%,AUC为0.626。
2.4 年龄、LDH水平、体能状态、临床分期、结外淋巴结受累与否、NCCN-IPI评分及FDG PET/CT各代谢指标对患者疾病进展或复发的影响将51例患者分别按年龄、LDH水平、体能状态、Ann Arbor分期、结外受累与否、NCCN IPI评分、SUVmax、TMTV、SUVmean、TLG数值分成2组,并分析其与淋巴瘤进展及复发的相关性。如表 2所示,Ann Arbor分期、NCCN-IPI评分、TMTV能更好地预测疾病的进展及复发,差异有统计学意义(χ2分别为4.568、6.092、4.867,P分别为0.03、0.014、0.027)。其余指标均无统计学意义。
| Factor | n | Progress or recurrence | χ2 | P |
| Age(year) | ||||
| < 60 | 24 | 9 | 0.152 | 0.696 |
| ≥60 | 27 | 11 | ||
| LDH | ||||
| Normal | 17 | 4 | 1.231 | 0.267 |
| Abnormal | 34 | 16 | ||
| (Ecog)performance status | ||||
| 0-1 | 42 | 16 | 0.887 | 0.346 |
| 2-4 | 9 | 4 | ||
| Ann Arbor stage | ||||
| Ⅰ-Ⅱ | 18 | 3 | 4.568 | 0.033 |
| Ⅲ-Ⅳ | 33 | 17 | ||
| Extranodal involvement | ||||
| No | 25 | 7 | 2.623 | 0.105 |
| Yes | 26 | 13 | ||
| NCCN-IPI | ||||
| 0-3 | 21 | 4 | 6.092 | 0.014 |
| 4-8 | 30 | 16 | ||
| SUVmax | ||||
| < 16 | 21 | 6 | 1.530 | 0.216 |
| ≥16 | 30 | 14 | ||
| TMTV | ||||
| < 153 | 34 | 10 | 4.867 | 0.027 |
| ≥153 | 17 | 10 | ||
| SUVmean | ||||
| < 8.50 | 15 | 3 | 1.533 | 0.216 |
| ≥8.50 | 36 | 17 | ||
| TLG | ||||
| < 470.0 | 19 | 4 | 3.403 | 0.065 |
| ≥470.0 | 32 | 16 |
2.5 多因素分析
将单因素方差分析结果纳入Cox多因素生存分析,将P < 0.1的因素纳入,包括Ann Arbor分期(P = 0.033)、TMTV(P = 0.027)、TLG(P = 0.065)及NCCN-IPI评分系统(P = 0.014)。分析结果表明,TMTV为预后的独立危险因素,其比值比为2.822,95%可信区间范围:1.835~9.542(P < 0.05),见表 3。
| Factor | β | SE | Wald | HR | 95%CI | P |
| Ann Arbor | 1.361 | 1.190 | 1.309 | 3.899 | 0.379-40.131 | 0.253 |
| NCCN-IPI | 1.627 | 1.305 | 1.554 | 5.086 | 0.394-65.595 | 0.212 |
| TMTV | 1.038 | 0.622 | 2.787 | 2.822 | 1.835-9.542 | 0.035 |
| TLG | -0.772 | 1.124 | 0.472 | 0.462 | 0.051-4.183 | 0.492 |
2.6 代谢指标的相关性与ROC曲线界值行Kaplan-Meier生存曲线分析结果
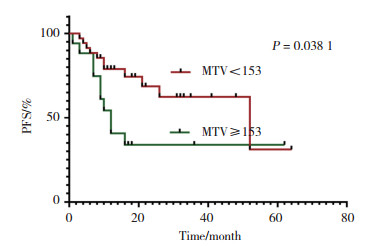
Kaplan-Meier生存曲线分析显示,治疗前高TMTV值的患者预后不良,更倾向于复发和进展(界值为153,P < 0.05)。见图 1。
|
| The red line represents the survival curve when MTV < 153; the green represents the survival curve when MTV≥153. The abscissa is time; the ordinate is pfs rate; + means censoring. 图 1 PFS生存曲线 Fig.1 PFS survival curve |
3 讨论
FDG PET/CT影像检查广泛应用在肿瘤功能显像领域已有十余年[8],常用于淋巴瘤治疗前的分期和再分期、治疗期间及治疗结束后的监测、转化的评估[9]。
SUVmax是临床上广泛应用的半定量评价指标,对DLBCL的PFS有预测价值[10]。但SUVmax反映的是肿瘤最高代谢点的葡萄糖摄取率,不能体现肿瘤的体积参数及全身肿瘤负荷情况,而TMTV及TLG则更倾向于体现全身肿瘤负荷的信息。关于肿瘤代谢参数TMTV、Ann Arbor分期、TLG、NCCN-IPI评分中哪个更能准确评价DLBCL预后,目前仍无定论[11-16]。究竟基线代谢指标是否对预测DLBCL的预后有效,以及究竟哪些代谢参数对其预后有价值,有待进一步研究证实。
临床上常用IPI评分或改良后的NCCN-IPI评分指数对治疗前DLBCL患者进行危险度分级、疗效预测。血清LDH指标被纳入了该评分标准,其含量高低与TLG增强相关[4],但是否与肿瘤代谢参数相关有待证实。本研究分析了不同代谢参数与血清LDH水平的相关性,发现各代谢参数与血清LDH水平均有相关性,但TMTV及TLG的高低能更好地反映肿瘤总的糖酵解水平。
本研究发现,在所有接受R-CHOP化疗方案的DLBCL患者中,Ann Arbor分期、NCCN-IPI评分、TMTV均能有效预测患者的PFS;根据ROC曲线界值发现,TMTV为153时,Youden指数最大(0.274),预测肿瘤进展或复发的灵敏度为50.0%,特异度为77.4%,AUC为0.608。当TMTV > 153时预后不良,与SONG等[11]及SASANELLI等[12]的研究结论一致。TMTV较其它代谢参数能更好、更全面地反映全身肿瘤的负荷情况,对患者的预后更有预测价值。
TMTV的测量方法有很多,包括:(1)固定届值法[11, 17],规定SUV=2.5作为绝对界限,所有>2.5的代谢部分均被计算入代谢体积,但对于本底代谢水平偏高以及肿瘤整体代谢水平偏低的患者,其计算值往往高于真实水平;(2)根据肝脏的平均SUV值±3倍标准差划定代谢体积界限[18],这种以肝脏本底作为参考值的测量方法规避了不同PET/CT系统及人为测量的影响,然而,肝脏弥漫疾病或肿瘤浸润会对测量结果造成较大影响,肝脏平均摄取水平也会随着肝功能的不同而变化;(3)MEIGNAN等[7]研究认为,应用SUVmax的41%作为阈值,评估所得结果与模型实际体积一致性最佳,且在不同观察者之间也有完美的同一性。本研究即采用了阈值法测量肿瘤代谢体积。但该方法参照SUVmax值勾画体积也存在不足之处,如当肿瘤SUVmax值过大时,代谢体积将低估肿瘤实际体积,反之亦然。因此,每种方法都各有优缺点,国际上也没有统一的估测标准指南,仍有待进一步探讨。
由于随访时间不足,本研究仅观察了PFS,尚未能观察到足够的总生存期,部分截尾数据未能观察到终点,有待继续长期随访并充实数据。
综上所述,本研究显示,TMTV是DLBCL的独立预后影响因素,作为分子影像学指标能够更好地预测PFS,未来能否成为新的预后评价标准,有待标准化的图像获取及大量临床数据的归纳。
| [1] |
ZELENETZ AD, GORDON LI, WIERDA WG, et al. Non-Hodgkin's lymphomas, version 4.2014[J]. J Natl Compr Canc Netw, 2014, 12(9): 1282-1303. DOI:10.6004/jnccn.2014.0125 |
| [2] |
CANDELARIA M. Advances in the diagnosis and control of lymphomas[J]. Salud Publica Mex, 2016, 58(2): 296-301. DOI:10.21149/spm.v58i2.7800 |
| [3] |
FRIEDBERG JW. Relapsed/refractory diffuse large B-cell lymphoma[J]. Hematology Am Soc Hematol Educ Program, 2011, 2011: 498-505. DOI:10.1182/asheducation-2011.1.498 |
| [4] |
JUNG SH, YANG DH, AHN JS, et al. Serum lactate dehydrogenase with a systemic inflammation score is useful for predicting response and survival in patients with newly diagnosed diffuse large B-cell lymphoma[J]. Acta Haematol, 2015, 133(1): 10-17. DOI:10.1159/000360068 |
| [5] |
ZHOU Z, SEHN LH, RADEMAKER AW, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era[J]. Blood, 2014, 123(6): 837-842. DOI:10.1182/blood-2013-09-524108 |
| [6] |
CHESON BD, PFISTNER B, JUWEID ME, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol, 2007, 25(5): 579-586. DOI:10.1200/JCO.2006.09.2403 |
| [7] |
MEIGNAN M, SASANELLI M, CASASNOVAS RO, et al. Metabolic tumour volumes measured at staging in lymphoma:methodological evaluation on phantom experiments and patients[J]. Eur J Nucl Med Mol Imaging, 2014, 41(6): 1113-1122. DOI:10.1007/s00259-014-2705-y |
| [8] |
CHESON BD. PET/CT in lymphoma:current overview and future directions[J]. Semin Nucl Med, 2018, 48(1): 76-81. DOI:10.1053/j.semnuclmed.2017.09.007 |
| [9] |
SEAM P, JUWEID ME, CHESON BD. The role of FDG-PET scans in patients with lymphoma[J]. Blood, 2007, 110(10): 3507-3516. DOI:10.1182/blood-2007-06-097238 |
| [10] |
MIYAZAKI Y, NAWA Y, MIYAGAWA M, et al. Maximum standard uptake value of 18F-fluorodeoxyglucose positron emission tomography is a prognostic factor for progression-free survival of newly diagnosed patients with diffuse large B cell lymphoma[J]. Ann Hematol, 2013, 92(2): 239-244. DOI:10.1007/s00277-012-1602-3 |
| [11] |
SONG MK, CHUNG JS, SHIN HJ, et al. Clinical significance of metabolic tumor volume by PET/CT in stages Ⅱ and Ⅲ of diffuse large B cell lymphoma without extranodal site involvement[J]. Ann Hematol, 2012, 91(5): 697-703. DOI:10.1007/s00277-011-1357-2 |
| [12] |
SASANELLI M, MEIGNAN M, HAIOUN C, et al. Pretherapy metabolic tumour volume is an independent predictor of outcome in patients with diffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2014, 41(11): 2017-2022. DOI:10.1007/s00259-014-2822-7 |
| [13] |
KIM TM, PAENG JC, CHUN IK, et al. Total lesion glycolysis in positron emission tomography is a better predictor of outcome than the International Prognostic Index for patients with diffuse large B cell lymphoma[J]. Cancer, 2013, 119(6): 1195-1202. DOI:10.1002/cncr.27855 |
| [14] |
ESFAHANI SA, HEIDARI P, HALPERN EF, et al. Baseline total lesion glycolysis measured with (18) F-FDG PET/CT as a predictor of progression-free survival in diffuse large B-cell lymphoma:a pilot study[J]. Am J Nucl Med Mol Imaging, 2013, 3(3): 272-281. |
| [15] |
ADAMS HJ, DE KLERK JM, FIJNHEER R, et al. Prognostic superiority of the national comprehensive cancer network international prognostic index over pretreatment whole-body volumetric-metabolic FDG-PET/CT metrics in diffuse large B-cell lymphoma[J]. Eur J Haematol, 2015, 94(6): 532-539. DOI:10.1111/ejh.12467 |
| [16] |
XIE MX, ZHAI WH, CHENG SY, et al. Predictive value of F-18 FDG PET/CT quantization parameters for progression-free survival in patients with diffuse large B-cell lymphoma[J]. Hematology, 2016, 21(2): 99-105. DOI:10.1179/1607845415Y.0000000033 |
| [17] |
MIKHAEEL NG, SMITH D, DUNN JT, et al. Combination of baseline metabolic tumour volume and early response on PET/CT improves progression-free survival prediction in DLBCL[J]. Eur J Nucl Med Mol Imaging, 2016, 43(7): 1209-1219. DOI:10.1007/s00259-016-3315-7 |
| [18] |
WAHL RL, JACENE H, KASAMON Y, et al. From RECIST to PERCIST:evolving considerations for PET response criteria in solid tumors[J]. J Nucl Med, 2009, 50(Suppl 1): 122S-150S. DOI:10.2967/jnumed.108.057307 |
 2019, Vol. 48
2019, Vol. 48