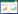文章信息
- 邓秋萍, 刘维新, 来爽, 兰雨桐, 陈轶楠, 杨美琪, 梁增, 李雪梅
- DENG Qiuping, LIU Weixin, LAI Shuang, LAN Yutong, CHEN Yinan, YANG Meiqi, LIANG Zeng, LI Xuemei
- 运动调控TSLP对高脂饮食下葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的作用及机制
- Effects and Mechanism of Exercise-Regulated Thymic Stromal Lymphopoietin on Dextran Sulfate Sodium-Induced Ulcerative Colitis in Mice under High-Fat Diet
- 中国医科大学学报, 2019, 48(12): 1100-1105
- Journal of China Medical University, 2019, 48(12): 1100-1105
-
文章历史
- 收稿日期:2019-06-24
- 网络出版时间:2019-12-05 16:11
炎症性肠病是一种以腹痛、腹泻为主要症状的慢性复发性肠道炎症性疾病,包括溃疡性结肠炎和克罗恩病,其发病机制尚未明确,且目前尚无针对性的特效疗法。近年来,我国炎症性肠病的患病率和发病率呈上升趋势,可能和我国经济发展、人们饮食习惯西式化改变密切相关[1]。其中高脂饮食导致的肥胖,通过脂类在消化道的代谢产物损伤肠道微环境,诱发结肠黏膜炎症[2-3]。
本课题组前期研究[4]发现,自主运动可以通过上调糖皮质激素介导的过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)来减轻肠道炎症,但是具体机制尚未明确。胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)是一类上皮细胞合成的细胞因子,有研究[5-6]发现TSLP基因在肥胖人群及小鼠中表达减少,TSLP下降在一定程度上加重了肠道炎症。但是TSLP在炎症性肠病中的促炎和抑炎作用尚存在争议,有研究[7]发现肠道黏膜中的炎症通过促炎因子Th2触发肠道上皮细胞释放TSLP,导致溃疡性结肠炎恶化,然而大多数研究[8-9]认为TSLP在炎症性肠病中表现为抗炎作用。本研究拟通过建立小鼠运动模型,并予以高脂饮食、PPAR-γ抑制剂(GW9662)及PPAR-γ激动剂(吡格列酮)等药物处理,采用葡聚糖硫酸钠(dextran sodium sulfate,DSS)建立小鼠溃疡性结肠炎,进一步探讨TSLP在溃疡性结肠炎中的作用及机制,为临床治疗和预防提供新思路。
1 材料与方法 1.1 实验动物选用雄性6~8周龄Balb/c小鼠80只,体质量24~ 27 g,购自北京维通利华实验动物技术有限公司,自由饮食水,适应性喂养1周,恒温(23±2)℃,恒湿50%±10%,昼夜循环。
1.2 材料分子量(36~50)×103的DSS,购自美国MP-BIO公司。GW9662购自美国MCE公司,吡格列酮购自北京索莱宝科技有限公司。小鼠白细胞介素(interleukin,IL)-6、IL-1β及TSLP酶联免疫吸附试验(ELISA)试剂盒,购自上海沪宇生物科技有限公司。Trizol、cDNA反转录试剂盒及PCR试剂盒,均购自日本TaKaRa公司。引物序列由武汉金开瑞生物工程有限公司合成。高脂饲料:基础饲料+15%猪油+15%蔗糖,购自北京维通利华实验动物技术有限公司。其余材料均为实验室自备。
1.3 方法 1.3.1 造模及分组适应性喂养1周后,将随机小鼠分为静止(sedentary,SED)对照组、SED+DSS组、SED+ GW9662+DSS组、SED+吡格列酮+DSS组、运动(exercise,EXE)对照组、EXE+DSS组、EXE+GW9662+DSS组、EXE+吡格列酮+DSS组,每组10只。小鼠予高脂饮食,自由饮食水,各运动组小鼠每天在跑步机上运动40 min,余静止组不做运动处理,SED+GW9662+DSS组及EXE+GW9662+DSS组小鼠予GW9662(隔天1 mg/kg)腹腔注射,SED+吡格列酮+DSS组及EXE+吡格列酮+DSS组予吡格列酮(每日10 mg/kg)灌胃处理。30 d运动周期结束后,除SED对照组及EXE对照组外,其余各组小鼠均予3% DSS水自由饮用7 d,每天更换新鲜配置的DSS水。
1.3.2 疾病活动指数(disease activity index,DAI)的评估自建模起每日观察并记录小鼠造模后的精神状态、运动、进食情况及毛发数量、密度以及光泽,定时称量小鼠体质量,观察大便性状和便血情况(四甲基联苯胺法)。DAI=体质量下降分数+大便性状分数+便血分数。评分标准包括体质量下降百分率(< 1%为0分,1%~ < 5%为1分,5%~ < 10%为2分,10%~ < 15%为3分,≥15%为4分)、大便黏稠度(正常为0分,松散大便为2分,腹泻为4分)和大便出血(正常为0分,隐血阳性为2分,显性出血为4分)。计算总评分,以评估疾病活动情况。
1.3.3 标本采集于造模结束后禁食24 h,采用颈椎脱臼法处死小鼠。处死前自由饮用水1 h,采用摘眼球法取血,放入EP管中,静置2 h后,4 ℃、12 000 r/min离心20 min,取血清-80 ℃冰箱保存备用。将每只小鼠整段结肠取出,沿纵轴切开,用PBS冲净后明确炎症部位,截取1 cm组织固定于10%甲醛溶液中,常规石蜡包埋、制作组织切片、HE染色后封片,光镜下观察结肠组织病理改变的情况,余组织快速置于液氮中,转至-80 ℃冰箱保存备用。
1.3.4 组织病理学损伤及评分在光镜下观察结肠组织切片。组织病理评分标准:上皮组织无损伤破坏,无炎症浸润,0分;少量杯状细胞破坏,浸润至隐窝基底周围,各1分;广泛杯状细胞破坏,浸润至黏膜肌层,各2分;广泛杯状细胞破坏及少量腺体破坏,黏膜肌层广泛浸润并水肿增厚,各3分;大量腺体消失,浸润至黏膜下层,各4分。合计总分,评估组织损伤情况。
1.3.5 ELISA法检测血清中IL-6、IL-1β及TSLP表达情况取小鼠血清,充分解冻后,严格按照ELISA试剂盒说明书检测血清中IL-6、IL-1β及TSLP表达情况。
1.3.6 实时PCR法检测组织中PPAR-γ mRNA表达水平取适量结肠组织,Trizol提取结肠组织总RNA,利用cDNA反转录试剂盒将其反转录合成cDNA,并将合成的cDNA为模板进行实时PCR检测。PPAR-γ正反引物序列分别为5’-GCCTCCCTGATGAATAAAGA TG-3’和5’-AGGCTCCATAAAGTCACCAAAG-3’。反应体系中包含1 μL的cDNA,5 μL的SYBR Premix,0.4 μL的上下游引物各一个,3.2 μL去离子水。置于LCS480系统进行PCR,反应条件:95 ℃ 30 s预变性,95 ℃ 5 s,60 ℃ 30 s增殖,共进行40个循环,95 ℃ 10 s,65 ℃ 10 s,95 ℃溶解曲线,40 ℃ 30 s冷却。记录目的基因和内参基因的Ct值,采用相对定量的方法(2-△△Ct法)计算PPAR-γ mRNA相对表达量。
1.4 统计学分析采用SPSS 24.0软件进行统计分析,计量资料以x±s表示。2组间比较采用t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况及DAI开始造模时,小鼠体质量上升明显,15 d后体质量逐渐趋于恒定。见图 1A。30 d运动及药物处理结束后,在小鼠饮用水中加或不加3%DSS,自由饮用7 d(即造模第31~37天)。其中饮用水中未加DSS的SED对照组及EXE对照组小鼠体质量无明显变化,余各组小鼠体质量从造模第35天(即加入DSS第5天)均开始下降,其中SED+GW9662+DSS组、EXE+GW9662+DSS组小鼠体质量下降明显。见图 1B。
|
| A, changes in body weight from day 0 to day 30;B, changes in body weight from day 31 to day 37 after adding 3% DSS or not. Data from appropriate control groups of mice are also plotted. 图 1 各组小鼠体质量变化情况 Fig.1 Changes in body weight for each group of mice |
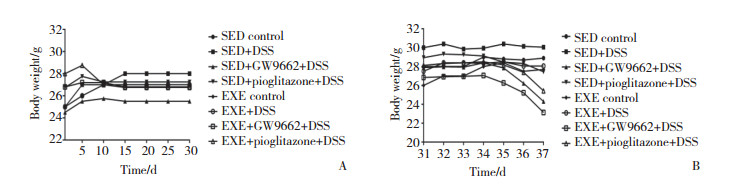
加入DSS后,开始时小鼠精神、毛发及饮食状态良好,体质量在造模第35天(加入DSS后第5天)开始下降;从造模第33天(加入DSS后第3天)开始小鼠逐渐出现大便隐血弱阳性,从第35天开始,小鼠出现精神倦怠、黏液便及隐血阳性,SED+GW9662+DSS组小鼠开始出现便血等。但饮用水中未知DSS的SED对照组及EXE对照组小鼠运动、饮食及精神状态良好,大便正常,为成形颗粒便。SED对照组和EXE对照组小鼠DAI无明显变化;与SED对照组比较,SED+DSS组、SED+GW9662+DSS组、SED+吡格列酮+DSS组DAI明显增加,与EXE对照组比较,EXE+DSS组、EXE+ GW9662+DSS组及EXE+吡格列酮+DSS组DAI明显增加,差异均有统计学意义(P < 0.05)。见图 2。
|
| *P < 0.05 vs EXE control group; #P < 0.05 vs SED control group. 图 2 各组小鼠DAI变化情况 Fig.2 Changes in DAI for each group of mice |
2.2 结肠组织病理学情况
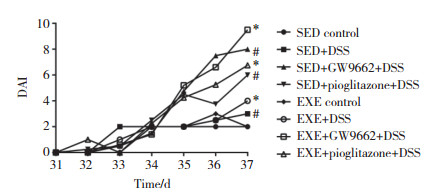
光镜下看,SED对照组及EXE对照组可见少量白细胞浸润;SED+DSS组炎症浸润至隐窝基底周围,少量杯状细胞破坏,EXE+DSS组可见明显炎症浸润至黏膜肌层,少量腺体破坏;SED+GW9662+DSS组见广泛杯状细胞破坏及少量腺体破坏,黏膜肌层广泛浸润并水肿增厚,EXE+GW9662+DSS组见大量腺体消失,浸润至黏膜下层;SED+吡格列酮+DSS组见大量腺体消失,黏膜肌层广泛浸润,EXE+吡格列酮+DSS组见大量腺体消失,浸润至黏膜下层。见图 3。各组小鼠结肠组织病理学评分结果可见,各运动组小鼠组织病理学评分均高于对应的静止组,其中SED+GW9662+DSS组和SED对照组、EXE+ GW9662+DSS组和EXE对照组、SED+DSS组和EXE+ DSS组、SED+GW9662+DSS组和EXE+GW9662+DSS组比较,差异均有统计学意义(P < 0.05)。见表 1。
|
| A, SED control group; B, SED + DSS group; C, SED + GW9662 + DSS group; D, SED + pioglitazone + DSS group; E, EXE control group; F, EXE + DSS group; G, EXE + GW9662 + DSS group; H, EXE + pioglitazone + DSS group. 图 3 各组小鼠光镜下结肠组织病理图片 ×100 Fig.3 Pathological picture of colon tissue under a microscope for each group of mice ×100 |
| Group | Histopathological score | IL-6(pg/mL) | IL-1β(ng/L) | TSLP(pg/mL) |
| SED control | 1.00±0.00 | 221.82±0.15 | 76.74±3.41 | 380.39±24.31 |
| SED+DSS | 2.00±0.00 | 251.47±19.82 | 87.02±5.33 | 381.36±41.96 |
| SED+GW9662+DSS | 4.00±1.411) | 231.62±24.191) | 82.86±7.47 | 366.58±37.79 |
| SED+pioglitazone+DSS | 4.25±2.63 | 256.85±20.601),3) | 88.93±11.51 | 361.81±38.18 |
| EXE control | 2.00±0.00 | 275.54±14.741) | 80.63±1.06 | 350.90±8.07 |
| EXE+DSS | 3.00±0.002) | 304.15±52.172) | 90.71±16.23 | 313.66±25.162) |
| EXE+GW9662+DSS | 5.40±1.673),5) | 303.79±30.833) | 91.48±6.713),5) | 315.09±50.903) |
| EXE+pioglitazone+DSS | 4.67±2.08 | 341.53±32.444),5),6) | 99.62±13.78 | 299.56±32.634) |
| 1)P < 0.05 vs SED control group;2)P < 0.05 vs SED+DSS group;3)P < 0.05 vs SED+GW9662+DSS group;4)P < 0.05 vs SED+pioglitazone+DSS group;5)P < 0.05 vs EXE control group;6)P < 0.05 vs EXE+GW9662+DSS group. | ||||
2.3 血清中IL-6、IL-1β及TSLP表达情况 2.3.1 IL-6表达
各运动组血清IL-6表达均高于对应的静止组,差异均有统计学有意义(P < 0.05);与SED对照组比较,SED+GW9662+DSS组及SED+吡格列酮+DSS组表达升高,与EXE对照组比较,EXE+吡格列酮+DSS组表达升高,差异有统计学意义(P < 0.05);且SED+GW9662+DSS组低于SED+吡格列酮+DSS组,EXE+GW9662+DSS组低于EXE+吡格列酮+DSS组,差异有统计学意义(P < 0.05)。见表 1。
2.3.2 IL-1β表达各运动组血清IL-1β表达均高于对应的静止组,其中SED+GW9662+DSS组和EXE+ GW9662+DSS组比较,差异有统计学有意义(P < 0.05),其余差异无统计学意义(P > 0.05);与SED对照组比较,SED+DSS组、SED+GW9662+DSS组及SED+吡格列酮+DSS组表达均升高,但差异无统计学意义(P > 0.05);与EXE对照组比较,EXE+DSS组、EXE+GW9662+DSS组及EXE+吡格列酮+DSS组表达均升高,其中EXE对照组和EXE+GW9662+DSS组比较,差异有统计学意义(P < 0.05),其余差异无统计学意义(P > 0.05)。见表 1。
2.3.3 TSLP表达各运动组血清TSLP表达均低于对应的静止组,除对照组外,差异均有统计学意义(P < 0.05)。SED+GW9662+DSS组及SED+吡格列酮+DSS组低于SED对照组,EXE+GW9662+DSS组及EXE+吡格列酮+DSS组低于EXE对照组,SED+吡格列酮+DSS组低于SED+GW9662+DSS组,EXE+吡格列酮+DSS组低于EXE+GW9662+DSS组,但差异无统计学意义(P > 0.05)。见表 1。
2.4 结肠组织中PPAR-γ mRNA表达情况实时PCR法检测各组结肠组织中PPAR-γ mRNA表达,EXE对照组(2.36±0.01)与SED对照组(1.00±0.00)相比、EXE+DSS组(1.53±0.14)与SED+DSS组(1.00±0.00)相比、EXE+GW9662+DSS组(21.79±5.94)与SED+GW9662+DSS组(1.00±0.00)相比、EXE+吡格列酮+DSS组(4.23±0.19)与SED+吡格列酮+DSS组(1.00±0.00)相比表达升高,差异均有统计学意义(P < 0.05),其中EXE+GW9662+DSS组升高最为显著。
3 讨论近年来,我国炎症性肠病呈现出发病率急剧上升、年轻化趋势明显、漏诊率和误诊率高的特点,目前炎症性肠病的病因和发病机制尚未明确。由于疾病的特殊性、持续性、复发性,尽管目前有很多新型药物投入使用,但炎症性肠病的治疗仍是一个亟待解决的难题。我国炎症性肠病发病率升高,考虑与饮食习惯、生活习惯的改变息息相关。
适度运动可以提高免疫功能,抗炎和预防炎症疾病。本课题组前期研究[4]发现,自主运动可以减轻高脂饮食下DSS诱导的小鼠溃疡性结肠炎。此外,ALLEN等[10]研究发现,自主运动通过改变肠道微生物群减轻DSS诱导的小鼠肠道炎症,主要表现在减少结肠缩短,减少黏液消耗以及增加组织再生中涉及的细胞因子的表达来减轻肠道炎症,而强迫运动会加剧肠道炎症。MAZUR-BIALY等[11]证明了自主运动通过释放保护性鸢尾素、恢复血浆脂联素来减轻高脂饮食诱导的小鼠结肠损伤,并且发现高脂饮食加重小鼠肠炎可能与结肠微环境下降以及血浆中促炎标志物和肠系膜脂肪含量增加相关。此外,DEFILIPPIS等[12]将250例炎症性肠病患者纳入研究,记录运动情况、疾病活动情况、炎症标志物以及临床表现,发现患者可能从运动中受益,但是由于炎症性肠病复发和缓解的性质以及有患者在常规运动中受到障碍,仍需更大的样本来论证。本研究中,小鼠在跑步机上运动属于被动运动,结果发现运动组小鼠在饮用水中加入DSS后DAI逐渐上升,光镜下观察结肠组织病理情况,结果发现各运动组小鼠结肠组织病理表现及评分均高于对应的静止组,其中SED+GW9662+DSS组和SED对照组、EXE+GW9662+DSS组和EXE对照组、SED+DSS组和EXE+DSS组、SED+GW9662+DSS组和EXE+GW9662+DSS组比较,差异有统计学意义(P < 0.05)。各运动组血清IL-6表达均高于对应的静止组,且差异有统计学有意义(P < 0.05);与SED对照组比较,SED+GW9662+DSS组及SED+吡格列酮+DSS组IL-6表达升高,与EXE对照组比较,EXE+吡格列酮+DSS组IL-6表达升高,差异有统计学意义(P < 0.05);且SED+GW9662+DSS组IL-6表达低于SED+吡格列酮+ DSS组,EXE+GW9662+DSS组IL-6表达低于EXE+吡格列酮+DSS组,差异有统计学意义(P < 0.05)。各运动组血清IL-1β表达均高于对应的静止组,其中SED+GW9662+DSS组和EXE+GW9662+DSS组比较,差异有统计学有意义(P < 0.05),其余差异无统计学意义(P > 0.05);与EXE对照组比较,EXE+ GW9662+DSS组IL-1β表达升高,差异有统计学意义(P < 0.05)。从各组小鼠DAI、结肠组织病理情况、血清IL-6和IL-1β表达的差异情况,表明运动加重了小鼠肠道炎症,考虑可能和被动运动改变了小鼠的生理习性等相关,并且PPAR-γ抑制剂(GW9662)和激动剂(吡格列酮)均加重了小鼠肠道炎症,其中加入激动剂的小鼠炎症加重更为显著,提示PPAR-γ可能是运动介导肠道炎症改变的重要因素。
TSLP主要由上皮细胞合成分泌,目前国内外对TSLP的研究主要对各种变应性疾病如哮喘、特应性皮炎、慢性阻塞性肺疾病等,甚至是癌症,但是对炎症性肠病的研究不多并且存在争议[13]。已有研究[14]发现,与在过敏性疾病中的作用不同,TSLP在炎症性肠病中起抗炎作用,TSLP在溃疡性结肠炎患者中表达减少,对溃疡性结肠炎患者有保护作用。并且有研究敲除了小鼠TSLP基因,发现在DSS诱导结肠炎过程中炎症没有恶化,但是疾病恢复受到TSLP/TSLP受体信号通路的阻碍,明确TSLP在炎症性肠病中的保护作用[8]。这与本研究结果相同,本研究发现在炎症较轻的各静止组小鼠血清中TSLP表达较炎症较重的运动组高,提示TSLP在溃疡性结肠炎中起保护作用。
TSLP在炎症性肠病中主要由短链TSLP发挥抗炎作用。有研究[15]发现,结肠中短链TSLP受到PPAR-γ调控。本研究试图证明运动调控TSLP的机制及对肠道炎症的影响,建立了运动后DSS诱导的小鼠溃疡性结肠炎模型。结果发现,血清中TSLP表达各运动组均低于对应的静止组,除对照组外,差异均有统计学意义(P < 0.05);SED+GW9662+DSS组及SED+吡格列酮+DSS组低于SED对照组,EXE+GW9662+DSS组及EXE+吡格列酮+DSS组低于EXE对照组,SED+吡格列酮+DSS组低于SED+GW9662+DSS组,EXE+吡格列酮+DSS组低于EXE+GW9662+DSS组,但差异无统计学意义(P > 0.05)。以各静止组为对照,对应的运动组PPAR-γ mRNA表达均相对升高(P < 0.05),其中EXE+GW9662+DSS组升高最为显著。TSLP可能作为抑炎因子在肠道起保护作用,在运动组中TSLP表达均高于相应的静止组,考虑与运动上调PPAR-γ 从而下调TSLP有关。本研究发现,和对照组比较,使用PPAR-γ抑制剂和激动剂的小鼠血清中TSLP表达均较低,并且使用激动剂的小鼠TSLP表达更低,表明TSLP的表达受PPAR-γ的调控。
综上所述,本研究发现运动通过上调PPAR-γ下调TSLP从而加重肠道炎症,TSLP在溃疡性结肠炎中起抗炎作用,可能成为治疗的新靶点。
| [1] |
JIANG XL, CUI HF. An analysis of 10218 ulcerative colitis cases in China[J]. World J Gastroenterol, 2002, 8(1): 158-161. DOI:10.3748/wjg.v8.i1.158 |
| [2] |
周凤, 刘维新, 于艳红, 等. 高脂饮食对AOM/DSS诱导的小鼠不同周期溃疡性结肠炎的影响及白细胞介素6的改变[J]. 中国医科大学学报, 2017, 46(3): 232-237. DOI:10.12007/j.issn.0258-4646.2017.03.010 |
| [3] |
ELLEGÅRD L, BOSAEUS I, ANDERSSON H. Will recommended changes in fat and fibre intake affect cholesterol absorption and sterol excretion? An ileostomy study[J]. Eur J Clin Nutr, 2000, 54(4): 306-313. DOI:10.1038/sj.ejcn.1600940 |
| [4] |
LIU WX, ZHOU F, WANG Y, et al. Voluntary exercise protects against ulcerative colitis by up-regulating glucocorticoid-mediated PPAR-γ activity in the colon in mice[J]. Acta Physiol (Oxf), 2015, 215(1): 24-36. DOI:10.1111/apha.12534 |
| [5] |
RIMOLDI M, CHIEPPA M, SALUCCI V, et al. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells[J]. Nat Immunol, 2005, 6(5): 507-514. DOI:10.1038/ni1192 |
| [6] |
MA WS, LU SM, SUN T, et al. Twist 1 regulates the expression of PPARγ during hormone-induced 3T3-L1 preadipocyte differentiation:a possible role in obesity and associated diseases[J]. Lipids Health Dis, 2014, 13: 132. DOI:10.1186/1476-511X-13-132 |
| [7] |
TANAKA J, SAGA K, KIDO M, et al. Proinflammatory Th2 cytokines induce production of thymic stromal lymphopoietin in human colonic epithelial cells[J]. Dig Dis Sci, 2010, 55(7): 1896-1904. DOI:10.1007/s10620-009-0979-x |
| [8] |
REARDON C, LECHMANN M, BRÜSTLE A, et al. Thymic stromal lymphopoetin-induced expression of the endogenous inhibitory enzyme SLPI mediates recovery from colonic inflammation[J]. Immunity, 2011, 35(2): 223-235. DOI:10.1016/j.immuni.2011.05.015 |
| [9] |
SHEN ZH, ZHU CX, QUAN YS, et al. Insights into Roseburia intestinalis which alleviates experimental colitis pathology by inducing anti-inflammatory responses[J]. J Gastroenterol Hepatol, 2018, 33(10): 1751-1760. DOI:10.1111/jgh.14144 |
| [10] |
ALLEN JM, MAILING LJ, COHRS J, et al. Exercise traininginduced modification of the gut microbiota persists after microbiota colonization and attenuates the response to chemically-induced colitis in gnotobiotic mice[J]. Gut Microbes, 2018, 9(2): 115-130. DOI:10.1080/19490976.2017.1372077 |
| [11] |
MAZUR-BIALY AI, BILSKI J, WOJCIK D, et al. Beneficial effect of voluntary exercise on experimental colitis in mice fed a high-fat diet:the role of irisin, adiponectin and proinflammatory biomarkers[J]. Nutrients, 2017, 9(4): E410. DOI:10.3390/nu9040410 |
| [12] |
DEFILIPPIS EM, TABANI S, WARREN RU, et al. Exercise and self-reported limitations in patients with inflammatory bowel disease[J]. Dig Dis Sci, 2016, 61(1): 215-220. DOI:10.1007/s10620-015-3832-4 |
| [13] |
MARTINI E, KRUG SM, SIEGMUND B, et al. Mend your fences:the epithelial barrier and its relationship with mucosal immunity in inflammatory bowel disease[J]. Cell Mol Gastroenterol Hepatol, 2017, 4(1): 33-46. DOI:10.1016/j.jcmgh.2017.03.007 |
| [14] |
TAHAGHOGHI-HAJGHORBANI S, AJAMI A, GHORBANALIPOOR S, et al. Protective effect of TSLP and IL-33 cytokines in ulcerative colitis[J]. Auto Immun Highlights, 2019, 10(1): 1. DOI:10.1186/s13317-019-0110-z |
| [15] |
MARTIN MENA A, LANGLOIS A, SPECA S, et al. The expression of the short isoform of thymic stromal lymphopoietin in the colon is regulated by the nuclear receptor peroxisome proliferator activated receptor-gamma and is impaired during ulcerative colitis[J]. Front Immunol, 2017, 8: 1052. DOI:10.3389/fimmu.2017.01052 |
 2019, Vol. 48
2019, Vol. 48