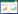文章信息
- 刘宇, 石云, 张旭, 高妍, 王欢, 王斌
- LIU Yu, SHI Yun, ZHANG Xu, GAO Yan, WANG Huan, WANG Bin
- PEDF基因修饰骨髓干细胞对糖尿病心肌梗死大鼠心肌损伤的作用及其对Wnt/β-catenin信号通路的影响
- Effect of PEDF-Modified Bone Marrow Stem Cells on Myocardial Injury in Diabetic Rats Suffering from Myocardial Infarction and on Wnt/β-Catenin Signaling Pathway
- 中国医科大学学报, 2019, 48(12): 1091-1095, 1099
- Journal of China Medical University, 2019, 48(12): 1091-1095, 1099
-
文章历史
- 收稿日期:2018-12-09
- 网络出版时间:2019-12-05 16:06
糖尿病对人类健康造成严重的威胁,可引发多种并发症,其中冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)是最严重的并发症之一,而心肌梗死是死亡率最高的并发症[1]。糖尿病所致的胰岛素抵抗及高胰岛素血症致使血管中的大量炎性细胞因子作用于冠状动脉,加重了冠状动脉病变,进而使糖尿病合并冠状动脉粥样硬化性心脏病患者的死亡风险增大。骨髓干细胞(marrow-derived stem cell,MSC)可以分化成心肌细胞,移植MSC可以取代坏死的心肌细胞,刺激血管新生,进而通过改善心室重塑而改善心功能[2]。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)是具有多种生物学功能的分泌性糖蛋白,在机体多种组织中均有表达,在心肌组织中高表达[3]。PEDF作为抗新生血管分子,其活性要强于其他的抗新生血管因子[4]。PEDF可以抑制血管内皮细胞的移行和增殖[5-6],影响他们的生物学行为,继而有可能在多种心血管疾病的病理过程中发挥重要作用。Wnt/连环蛋白(β-catenin)信号通路参与血管内皮损伤及血管重塑等重要病理生理活动,在心血管疾病的发生发展中发挥重要作用[7-8]。本研究通过构建糖尿病大鼠心肌梗死模型,探讨沉默PEDF基因的MSC对糖尿病大鼠心肌梗死的作用及其对Wnt/β-catenin信号通路相关蛋白表达的影响,旨在为糖尿病合并心肌梗死的防治奠定基础。
1 材料与方法 1.1 实验动物及分组SPF级SD雄性大鼠40只,体质量350~450 g,由北部战区总医院实验动物科提供,并由北部战区总医院实验动物伦理委员会审查通过。采用随机数字表法分为4组:糖尿病组(DM组)、糖尿病心肌梗死组(DMI组)、移植PEDF-/MSC的糖尿病心肌梗死组(PM组,造成心肌梗死后移植50 μL PEDF-/MSC,注射于心肌梗死周边2点)及注射Wnt/β-catenin抑制剂并移植PEDF-/MSC的糖尿病心肌梗死组[WPM组,造成心肌梗死后转移50 μL PEDF-/MSC,注射于心肌梗死周边2点,30 min后静脉注射HY-15597(8 mg/kg)],每组10只。
1.2 方法 1.2.1 糖尿病大鼠心肌梗死模型建立大鼠饲喂高糖高脂饲料8周,腹腔注射链脲佐菌素(streptozotocin,STZ)溶液(65 mg/kg),72 h后检测血糖,血糖≥16.7 mmol/L即造模成功。将造模成功的糖尿病大鼠麻醉后连接小动物心电图机,气管插管,将大鼠左侧第4肋间中线处横切开,剪开心尖搏动最明显处的肋间肌,找到前降支,结扎冠状动脉。心肌颜色变白,心电图示ST段抬高判定为心肌梗死模型制作成功。
1.2.2 样本采集大鼠术后24 h静脉取血(5 mL),4周后彩超采集数据后将大鼠麻醉置管,经右颈内静脉取血(5 mL),离心法分离出血清,-80 ℃保存待测;同时立即取心脏组织,一半置于-80 ℃冰箱保存待测;另一半置于甲醛中浸泡。
1.2.3 心功能检测移植后4周,各组大鼠进行心脏超声检查来评估心功能。图像采集在左心室短轴乳头肌平面行M型超声检查,测量计算左心室射血分数(left ventricular ejection fraction,LVEF);抽取血液送检,采用全自动血液生化检测仪检测肌酸激酶(creatine kinase,CK)、肌酸激酶MB(creatine kinase-MB,CK-MB)、脑钠肽(brain natriuretic peptide,BNP)水平。
1.2.4 HE染色将甲醛中固定的组织样本分别置于不同浓度(70%、80%、90%、95%、100%)乙醇中,二甲苯透明,浸蜡、包埋成蜡块,切片机器切片(4 μm)后脱蜡,苏木精染色(5 min),PBS清洗,1%盐酸乙醇分化,伊红染液30 s,梯度乙醇脱水、透明处理,中性树胶封片,光镜下观察各组大鼠心肌组织的病理变化。
1.2.5 免疫荧光检测血管内皮生长因子(vascular endothelial growth factor,VEGF)将心肌组织蜡块切片脱蜡至水后,浸于3%过氧化氢溶液15 min后,PBS清洗切片,枸缘酸钠溶液修复抗原;山羊血清封闭,37 ℃孵育30 min,倾去血清,勿洗,加入VEGF(ab32152,美国Abcam公司)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1);ab39398,美国Abcam公司),PDGF B(ab181341,美国Abcam公司)抗体,4 ℃孵育过夜;PBS清洗切片,加入荧光标记的二抗,37 ℃孵育30 min后PBS清洗切片,加入DAPI染细胞核,室温孵育10 min,PBS清洗切片,中性树胶封片,荧光显微镜下观察。
1.2.6 Western blotting检测Wnt/β-catenin通路相关蛋白的表达将心肌组织及细胞匀浆后,加入预冷的RIPA(89900,美国Thermo公司)裂解液,冰上裂解30 min,收集上清液,使用BCA(23225,美国Thermo公司)蛋白定量试剂盒对收集的蛋白液进行浓度测定,SDS-PAGE电泳蛋白后进行转膜,加入wnt3a(ab219412,美国Abcam公司),β-catenin(ab16051,美国Abcam公司)及survivin(ab469,美国Abcam公司)一抗,4 ℃孵育过夜,PBS清洗PVDF膜后,加二抗,室温孵育2 h后ECL发光试剂盒显色,凝胶成像系统成像,Quantity One软件读取灰度值。
1.3 统计学分析采用SPSS 19.0软件进行统计学分析,计量资料采用x±s表示,组间比较采用方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠心功能情况比较结果显示,在MSC移植4周后,DM组、DMI组、PM组、WPM组LVEF分别为(69.48±5.23)%、(42.31±4.40)%、(61.52±2.15)%、(45.32±3.98)%。DMI组LVEF较DM组明显降低(P < 0.05);而PM组LVEF较DMI组明显升高(P < 0.05),WPM组LVEF较PM组降低(P < 0.05)。
术后24 h CK、CK-MB、BNP水平检测结果显示,DMI组CK、CK-MB、BNP明显高于DM组(P < 0.05),PM组较DMI组明显降低(P < 0.05),WPM组较PM组则明显增高(P < 0.05)。术后4周CK、CK-MB、BNP水平检测结果显示,与24 h结果比较,DMI组和PM组各项指标均下降(P < 0.05);与DMI组比较,PM组各项指标下降更显著(P < 0.05)。见表 1。
| Group | 24 h after surgery(U/L) | 4 weeks after surgery(U/L) | |||||
| CK | CK-MB | BNP | CK | CK-MB | BNP | ||
| DM | 101±7.12 | 21±1.21 | 0.272±0.083 | 98±8.91 | 18±1.06 | 0.262±0.071 | |
| DMI | 256±5.631) | 48±2.161) | 1.414±0.2871) | 194±7.794) | 39±1.234) | 0.956±0.1314) | |
| PM | 177±6.612) | 36±5.122) | 0.818±0.1172) | 159±6.924) | 27±2.124) | 0.692±0.0994) | |
| WPM | 223±8.863) | 46±1.103) | 1.312±0.0663) | 188±7.72 | 37±0.45 | 0.949±0.045 | |
| 1)P < 0.05 vs DM group at the same time;2)P < 0.05 vs DMI group at the same time;3)P < 0.05 vs PM group at the same time;4)P < 0.05 vs the same group at 24 h after surgeny. | |||||||
2.2 各组大鼠心肌组织HE染色结果
结果显示,DM组心肌细胞排列比较规则,心肌细胞边界较清晰、细胞核完整;DMI组心肌细胞分布大量炎症细胞,未见完整的心肌细胞形态,心肌肌横纹严重破坏,肌纤维断裂、溶解、坏死,心肌细胞间质充血水肿,间隙明显増大,局部有炎症细胞浸润;PM组心肌细胞改善,损伤程度好转,心肌细胞形态尚完整,肌纤维排列有序,心肌组织充血、肿胀减轻。WPM组心肌组织形态同DM组相似,存在大量炎症细胞,细胞形态不完整,细胞间质水肿,间隙增大。见图 1。
|
| A, DM group; B, DMI group; C, PM group; D, WPM group. 图 1 各组大鼠心肌组织HE染色结果 ×200 Fig.1 HE staining of myocardial tissue from rats in each group ×200 |
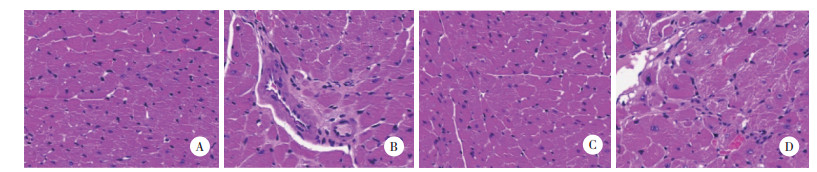
2.3 各组大鼠VEGF、IGF-1、PDGF B表达比较
免疫荧光检测结果显示,与DM组比较,DMI组大鼠VEGF、IGF-1、PDGF B的表达明显减少(P < 0.05);与DMI组比较,PM组VEGF、IGF-1、PDGF B表达明显增加(P < 0.05);与PM组比较,WPM组VEGF、IGF-1、PDGF B表达明显减少(P < 0.05)。见表 2、图 2。
| Group | VEGF | IGF-1 | PDGF B |
| DM | 46±3.12 | 38±5.37 | 29±4.21 |
| DMI | 19±3.231) | 22±3.171) | 19±5.281) |
| PM | 39±6.122) | 34±3.452) | 26±5.122) |
| WPM | 21±4.16 | 25±2.41 | 20±3.21 |
| 1)P < 0.05 vs DM group;2)P < 0.05 vs DMI group. | |||
|
| A, VEGF; B, IGF-1;C, PDGF B. 图 2 各组大鼠VEGF、IGF-1、PDGF B表达情况 ×200 Fig.2 Expression of VEGF, IGF-1, and PDGF B in each group ×200 |
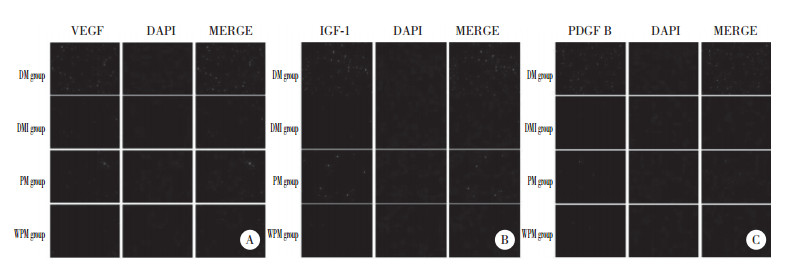
2.4 各组大鼠Wnt/β-catenin通路相关蛋白的表达
Western blotting检测结果显示,DMI组心肌组织Wnt3a、β-catenin、survivin表达较DM组明显增加(P < 0.05);PM组心肌组织Wnt3a、β-catenin、survivin表达较DMI组明显降低(P < 0.05);WPM组心肌组织Wnt3a、β-catenin、survivin表达与DMI组比较无统计学差异(P > 0.05)。见表 3、图 3。
| Group | Wnt3a | β-catenin | Survivin |
| DM | 0.27±0.012 | 0.16±0.021 | 0.12±0.033 |
| DMI | 0.62±0.0331) | 0.88±0.1301) | 0.46±0.0271) |
| PM | 0.41±0.0292) | 0.37±0.0222) | 0.31±0.0692) |
| WPM | 0.59±0.041 | 0.89±0.099 | 0.61±0.037 |
| 1)P < 0.05 vs DM group;2)P < 0.05 vs DMI group. | |||
|
| 1, DM group; 2, DMI group; 3, PM group; 4, WPM group. 图 3 Western blotting检测各组大鼠Wnt/β-catenin通路相关蛋白的表达 Fig.3 The expression of proteins related to the Wnt/β-catenin pathway in each group by Western blotting |
3 讨论
已有研究[9-11]证明,成人MSC是心肌梗死细胞治疗的重要来源,MSC可能通过旁分泌机制发挥治疗作用,即分泌多种细胞因子来促进血管新生、抗凋亡、抗纤维化,改善心室重塑,进而改善心脏功能。前期的研究[12]发现糖尿病可能会抑制MSC治疗心肌梗死的效果,但其原因和机制不明。本研究建立糖尿病大鼠心肌梗死模型,检测大鼠心功能,血管生成因子及Wnt/β-catenin信号通路相关蛋白,探究沉默PEDF的MSC对糖尿病大鼠心肌梗死的发生和进展过程中的作用。
作为一种多潜能干细胞,MSC可以诱导分化为多种细胞(心肌细胞和内皮细胞等[13])。以往多项研究[3, 13-14]表明MSC可以分泌血管新生相关因子,血管新生相关因子在心肌梗死治疗中发挥作用。研究[9-11]表明,移植后的MSC可以分泌多种因子,包括VEGF、IGF、PDGF、肝细胞生长因子(hepatocyte growth factor,HGF),基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1),碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),白细胞介素-1(interleukine-1,IL-1)。这些因子通过促进血管新生、细胞存活,移植心室重塑等来改善心脏功能[9-10]。也有研究[9-11]发现,PEDF是已知功能最强大的抑制新生血管因子,它可以持续活化诱导血管内皮细胞的凋亡,与心肌梗死后心肌损伤关系密切。本研究发现沉默PEDF的MSC可以显著上调VEGF、IGF-1、PDGF B的表达,提示沉默PEDF的MSC可以减轻糖尿病大鼠心肌梗死的心肌损伤程度,改善心功能,其作用机制可能与其上调VEGF、IGF-1、PDGF B表达有关。
Wnt/β-catenin信号通路是参与胚胎和器官发育的主要信号传导途径之一。Wnt家族基因主要编码分泌型信号蛋白,与肿瘤发生、脂肪形成有关。此外,它还参与调节胚胎发育过程中的细胞分化。Wnt3a是Wnt家族的一员,有研究[15]发现Wnt3a、Wnt5a在心肌肥大小鼠心肌细胞中表达上升,并且可能与心肌细胞凋亡有关。还有研究发现Wnt3a可以抑制小鼠心脏侧群干细胞的增殖,阻断内源性心肌细胞再生,损伤心脏功能。survivin是凋亡抑制蛋白分子家族之一[7]。有研究发现survivin在心肌细胞中可以促进DNA合成,改善细胞周期进程[8, 15]。并且己有研究[16]证实在DOX诱导的心力衰竭大鼠模型静脉注射survivin DNA质粒可以改善左心室收缩功能障碍,有望成为基因治疗的重要靶点。
本研究以糖尿病心肌梗死大鼠心肌损伤模型为研究对象,探讨PEDF对大鼠心肌损伤的机制,研究发现沉默PEDF的MSC可以显著下调心肌组织Wnt3a、β-catenin、survivin表达,而加入抑制剂后,这种下调作用显著被抑制,提示沉默PEDF的MSC可以通过下调Wnt3a、β-catenin、survivin表达来抑制血管内皮损伤,从而减轻糖尿病大鼠心肌梗死后心功能损伤。
综上所述,沉默PEDF的MSC可以减轻糖尿病大鼠心肌梗死的心肌损伤程度,改善心功能;其作用机制可能是通过调控Wnt/β-catenin信号通路相关蛋白表达抑制血管内皮损伤来实现的。
| [1] |
PALUMBO C, NICOLACI N, LA MANNA AA, et al. Association between central diabetes insipidus and type 2 diabetes mellitus[J]. Medicina (B Aires), 2018, 78(2): 127-130. |
| [2] |
LIN YH, CHEN CY, CHOU LY, et al. Enhancement of bone marrow-derived mesenchymal stem cell osteogenesis and new bone formation in rats by obtusilactone A[J]. Int J Mol Sci, 2017, 18(11): E2422. DOI:10.3390/ijms18112422 |
| [3] |
RYCHLI K, KAUN C, HOHENSINNER PJ, et al. The anti-angiogenic factor PEDF is present in the human heart and is regulated by Anoxia in cardiac myocytes and fibroblasts[J]. J Cell Mol Med, 2010, 14(1/2): 198-205. DOI:10.1111/j.1582-4934.2009.00731.x |
| [4] |
DAWSON DW, VOLPERT OV, GILLIS P, et al. Pigment epithelium-derived factor:a potent inhibitor of angiogenesis[J]. Science, 1999, 285(5425): 245-248. DOI:10.1126/science.285.5425.245 |
| [5] |
DUH EJ, YANG HS, SUZUMA I, et al. Pigment epithelium-derived factor suppresses ischemia-induced retinal neovascularization and VEGF-induced migration and growth[J]. Invest Ophthalmol Vis Sci, 2002, 43(3): 821-829. |
| [6] |
CRAWFORD SE, STELLMACH V, RANALLI M, et al. Pigment epithelium-derived factor (PEDF) in neuroblastoma:a multifunctional mediator of Schwann cell antitumor activity[J]. J Cell Sci, 2001, 114(Pt 24): 4421-4428. |
| [7] |
POLAKIS P. Drugging wnt signalling in cancer[J]. EMBO J, 2012, 31(12): 2737-2746. DOI:10.1038/emboj.2012.126 |
| [8] |
CLEVERS H, NUSSE R. Wnt/β-catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-1205. DOI:10.1016/j.cell.2012.05.012 |
| [9] |
CHEN LL, ZHANG SS, BARNSTABLE CJ, et al. PEDF induces apoptosis in human endothelial cells by activating P38 MAP kinase dependent cleavage of multiple caspases[J]. Biochem Biophys Res Commun, 2006, 348(4): 1288-1295. DOI:10.1016/j.bbrc.2006.07.188 |
| [10] |
TANG YL, ZHAO Q, QIN XY, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J]. Ann Thorac Surg, 2005, 80(1): 229-236. DOI:10.1016/j.athoracsur.2005.02.072 |
| [11] |
TAKAHASHI M, LI TS, SUZUKI R, et al. Cytokines produced by bone marrow cells can contribute to functional improvement of the infarcted heart by protecting cardiomyocytes from ischemic injury[J]. Am J Physiol Heart Circ Physiol, 2006, 291(2): H886-H893. DOI:10.1152/ajpheart.00142.2006 |
| [12] |
刘宇, 刘涛, 薛晓东, 等. 糖尿病与非糖尿病冠心病患者骨髓间充质干细胞治疗大鼠急性心肌梗死的比较[J]. 中华胸心血管外科杂志, 2014, 30(2): 86-89. DOI:10.3760/cma.j.issn.1001-4497.2014.02.007 |
| [13] |
LI WZ, MA N, ONG LL, et al. Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J]. Stem Cells, 2007, 25(8): 2118-2127. DOI:10.1634/stemcells.2006-0771 |
| [14] |
GNECCHI M, HE HM, LIANG OD, et al. Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells[J]. Nat Med, 2005, 11(4): 367-368. DOI:10.1038/nm0405-367 |
| [15] |
HE J, CAI Y, LUO LM, et al. Expression of Wnt and NCX1 and its correlation with cardiomyocyte apoptosis in mouse with myocardial hypertrophy[J]. Asian Pac J Trop Med, 2015, 8(11): 930-936. DOI:10.1016/j.apjtm.2015.10.002 |
| [16] |
LEE PJ, RUDENKO D, KULISZEWSKI MA, et al. Survivin gene therapy attenuates left ventricular systolic dysfunction in doxorubicin cardiomyopathy by reducing apoptosis and fibrosis[J]. Cardiovasc Res, 2014, 101(3): 423-433. DOI:10.1093/cvr/cvu001 |
 2019, Vol. 48
2019, Vol. 48