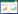文章信息
- 黄倩, 柳懿鹏
- HUANG Qian, LIU Yipeng
- 不同程度肾积水家兔模型在不同压力肾盂灌注下的肾损伤
- Nephron Injuries under Different Levels of Perfusion Pressure in Rabbit Models with Different Degrees of Hydronephrosis
- 中国医科大学学报, 2019, 48(12): 1085-1090
- Journal of China Medical University, 2019, 48(12): 1085-1090
-
文章历史
- 收稿日期:2018-10-15
- 网络出版时间:2019-12-05 10:56
输尿管镜碎石术和经皮肾镜碎石术已广泛用于治疗上尿路结石,比起传统的开放手术,具有并发症少、患者住院时间短的优势[1]。这些腔内手术需要冲洗,以保持清晰的手术视野并冲出结石碎屑。研究[2]报道,肾盂压力超过30 mmHg时,可能会出现肾盂静脉淋巴回流,在某些情况下,可能会导致严重的肾损伤。所以,目前一些研究[3]建议将灌注压力维持在50~300 mmHg。这一压力区间跨度较大,不同程度积水的肾脏,其术中能承受的肾盂灌注压力可能会不同。因此,本研究建立不同程度肾积水的家兔模型,对比观察不同压力的肾盂灌注对肾脏的损伤程度。
1 材料与方法 1.1 动物及分组54只清洁健康成年雄性新西兰白兔,体质量(2.2±0.2)kg,购自武汉生物制品研究所,生产批号:2017RN93。按照实验室标准方法饲养1周。将家兔随机分为对照组(n = 6)和实验组(n = 48)。实验组通过手术操作分别形成轻度(M组,n = 24)和重度(S组,n = 24)肾盂积水模型,M组和S组均细分为4个亚组,即M0~M3组和S0~S3组(每个亚组n = 6),M0、S0组未进行灌注,M1~M3、S1~S3组分别以20、60、100 mmHg的压力进行肾盂灌注。对照组家兔进行麻醉和手术,但不造成肾积水。
1.2 手术操作家兔禁食8 h,称重,通过耳缘静脉注射戊巴比妥(30 mg/kg)麻醉后,将家兔以仰卧位固定在电热毯上,维持正常体温,腹部正中切口暴露左输尿管、腰大肌。M组中,将左输尿管的上四分之一包埋在腰大肌中;S组中,将左输尿管的上三分之二包埋在腰大肌中[4];对照组家兔暴露左输尿管、腰大肌,但不包埋输尿管,然后关闭腹腔。手术后2周,用B超观察肾积水情况,M和S组中肾盂扩张分别为(0.98±0.31)cm和(1.72±0.32)cm,实质厚度分别为(0.31±0.08)cm和(0.23±0.05)cm。2组比较,肾盂扩张程度及肾实质厚度的差异均有统计学意义(P < 0.05)。
观察肾积水情况后,进行再次手术,暴露积水肾脏,将0.7G头皮针插入肾盂,并连接压力记录仪(MP150型,美国Biopac公司),记录肾盂压力。灌注前,测量M和S组的肾盂压力,分别为(9.43±1.86)mmHg和(15.91±2.79)mmHg,差异有统计学意义(P < 0.05)。将另一个0.7G头皮针插入肾盂,连接压力泵(UDS64-Ⅲ型,加拿大Laborie公司),用37 ℃生理盐水进行灌注,M1~M3组和S1~S3组灌注压力分别为20、60、100 mmHg,灌注8 min后停止2 min,重复操作4次,而M0组和S0组未进行灌注。灌注后,将包埋入腰大肌的输尿管松解,关闭腹腔。48 h后处死家兔,收集左肾,观察各项指标。
1.3 中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)表达的检测采用免疫组织化学方法染色及评估:用10%甲醛固定组织10 h,随后用石蜡包埋组织,切成5 μm厚的切片,再将组织切片浸入二甲苯中进行脱蜡,然后用乙醇再水化,微波抗原修复和灭活内源酶后,加一抗(美国Santa Cruz Biotechnology公司)在4 ℃的温箱中培养过夜,然后加入生物素化的二抗、辣根过氧化物酶及3,30-二氨基联苯胺,苏木精复染后,用1%盐酸乙醇纯化切片,经梯度乙醇脱水,再用二甲苯清洗,装于凝胶中。于光镜下观察,每个视野选择5个区域,每个区域观察100个肾小管上皮细胞,观察每个切片上阳性染色细胞百分比。切片评分如下:0,无染色;1,染色 < 25%;2,染色25%~ < 50%;3,染色50%~ < 75%;4,染色≥75% [5]。3位病理学家通过倒置相差显微镜(IX70-81FZ型,日本Olympus公司)对所有切片进行评分。
1.4 超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)水平的测定将组织放入20 mmol/L氨丁三醇缓冲剂中,用分散机(IKA T25型,德国Staufen公司)将组织均质化,为防止均质化过程中可能出现的脂质过氧化反应,加入5 mmol/L的丁羟甲苯。在4 ℃环境下,以12 000 g离心均浆,用上清液测量SOD和MDA活性。根据测定条件,将每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时对应的SOD量为一个SOD活性单位,SOD活性单位以U/mg表示[6]。根据MDA-TBA复合物的吸光系数计算MDA,单位以μmol/g表示[7]。
1.5 线粒体膜电位(mitochondrial membrane potential,MMP)水平的检测将肾组织放入EDTA胰蛋白酶溶液(中国碧云天生物技术研究所)中消化,然后加入小牛血清终止消化。收集悬浮细胞,于37 ℃下用MMP荧光探针JC-1(C25H27Cl4IN4)加载20 min,用流式细胞仪(FACS Aria Ⅲ型,美国BD公司)洗涤并分析细胞。MMP水平较低时,JC-1主要作为单体存在,发出绿色荧光(激发波长490 nm,发射波长530 nm),MMP水平较高时,JC-1主要作为聚合物存在,发出红色荧光(激发波长525 nm,发射波长590 nm)[8]。用红色荧光强度与绿色荧光强度之比,表示肾组织MMP的水平。
1.6 线粒体空泡化比例用2.5%戊二醛将切分好的肾组织固定,在0.1 mol/L磷酸钠缓冲液中漂洗3次,然后在1%锇酸固定液中固定,再用0.1 mol/L磷酸钠缓冲液漂洗,随后在梯度乙醇中使组织脱水,将脱水组织嵌入到环氧树脂中,用超微切片机(LKB-5型,瑞典Bromma公司)切割组织薄片,用醋酸铀和枸橼酸铅染色。使用透射电子显微镜(H-600型,日本日立公司)观察超微结构变化,计算每个切片的5个随机视野中空泡化线粒体的百分比[9]。
1.7 细胞凋亡的检测在10%缓冲甲醛中将组织固定一夜,将组织嵌入到石蜡块中,切成5 μm厚的切片,将切片浸入二甲苯中进行脱腊,用梯度乙醇再水化。通过原位细胞凋亡检测试剂盒(瑞士Roche Applied Science公司)检测细胞凋亡情况。根据每个组织切片的5个高倍镜视野中的凋亡细胞百分比,计算凋亡指数。
1.8 统计学分析采用SPSS 19.0软件进行统计学处理,数据均以x±s表示,组间比较采用方差分析,并进行SNK检验,P < 0.05为差异有统计学意义。
2 结果 2.1 NGAL的表达对照组中肾小管上皮细胞NGAL表达极低。M0、M1、M2组中NGAL的表达较对照组增加(P < 0.05),但M0、M1、M2组3组间比较无统计学差异(P > 0.05)。M3组与对照组比较NGAL表达明显增加(P < 0.01),M3组与M0、M1、M2组比较NGAL表达也明显增加(P < 0.05)。S0、S1组中NGAL表达较对照组增加(P < 0.05),但S0、S1组2组间比较无统计学差异(P > 0.05)。S2、S3组与对照组比较NGAL表达明显增加(P < 0.01),S2、S3组与S0、S1组比较NGAL表达也明显增加(P < 0.05),而S2、S3组2组间比较NGAL表达无统计学差异(P > 0.05)。见图 1、表 1。
|
| A, control group; B, M0 group; C, M1 group, D, M2 group; E, M3 group; F, S0 group; G, S1 group; H, S2 group; I, S3 group. 图 1 各组肾组织NGAL表达情况 ×400 Fig.1 Renal expression of NGAL in each group × 400 |
| Group | n | NGAL immunostaining score | SOD(U/mg) | MDA(μmol/g) | MMP value | Percentage of vacuolar mitochondria (%) |
Apoptotic index |
| Control | 6 | 0.31±0.06 | 461.59±24.37 | 0.13±0.06 | 1.82±0.26 | 8.12±1.15 | 5.37±1.02 |
| M0 | 6 | 0.53±0.121) | 427.31±22.191) | 0.23±0.081) | 1.66±0.251) | 17.63±3.101) | 8.25±1.381) |
| M1 | 6 | 0.66±0.131) | 413.98±23.741) | 0.25±0.061) | 1.66±0.231) | 18.85±3.261) | 8.31±1.421) |
| M2 | 6 | 0.72±0.151) | 402.33±21.381) | 0.29±0.111) | 1.63±0.181) | 18.89±3.211) | 8.39±1.451) |
| M3 | 6 | 2.52±0.312),3) | 296.10±23.152),3) | 0.79±0.132),3) | 0.94±0.112),3) | 52.39±7.482),3) | 68.54±5.162),3) |
| S0 | 6 | 0.64±0.171) | 390.32±23.891) | 0.32±0.121) | 1.58±0.191) | 20.15±3.721) | 6.36±1.151) |
| S1 | 6 | 0.77±0.291) | 388.24±21.311) | 0.34±0.131) | 1.53±0.171) | 21.42±3.911) | 7.13±1.221) |
| S2 | 6 | 2.89±0.262),4) | 242.13±15.962),4) | 1.03±0.162),4) | 0.75±0.142),4) | 75.17±12.932),4) | 72.67±6.392),4) |
| S3 | 6 | 3.18±0.352),4) | 239.76±14.632),4) | 1.15±0.192),4) | 0.71±0.132),4) | 79.32±13.522),4) | 75.38±7.052),4) |
| 1)P < 0.05 vs control group;2)P < 0.01 vs control group;3)P < 0.05 vs M0 group;4)P < 0.05 vs S0 group. | |||||||
2.2 SOD和MDA的含量
高压灌注导致肾组织的SOD水平降低,MDA水平升高。M0、M1、M2组中SOD含量较对照组降低(P < 0.05),而MDA含量较对照组增加(P < 0.05),但M0、M1、M2组3组间比较无统计学差异(P > 0.05)。M3组与对照组比较SOD含量明显降低(P < 0.01),MDA含量明显增加(P < 0.01);M3组与M0、M1、M2组比较SOD含量明显降低(P < 0.05),MDA含量明显增加(P < 0.05)。S0、S1组中SOD含量较对照组降低(P < 0.05),MDA含量较对照组增加(P < 0.05),但S0、S1组2组间比较无统计学差异(P > 0.05)。S2、S3组与对照组比较SOD含量明显降低(P < 0.01),MDA含量明显增加(P < 0.01);S2、S3组与S0、S1组比较SOD含量也明显降低(P < 0.05),MDA含量也明显增加(P < 0.05);S2、S3组2组间比较,SOD和MDA含量无统计学差异(P > 0.05)。见表 1。
2.3 MMP的水平M0、M1、M2组中MMP水平较对照组降低(P < 0.05),但M0、M1、M2组3组间比较无统计学差异(P > 0.05)。M3组与对照组比较MMP水平明显降低(P < 0.01),M3组与M0、M1、M2组比较MMP水平也明显降低(P < 0.05)。S0、S1组中MMP表达较对照组降低(P < 0.05),但S0、S1组2组间比较无统计学差异(P > 0.05)。S2、S3组与对照组比较MMP水平明显降低(P < 0.01),S2、S3组与S0、S1组比较MMP水平也明显降低(P < 0.05),而S2、S3组2组间比较MMP水平无统计学差异(P > 0.05)。见表 1。
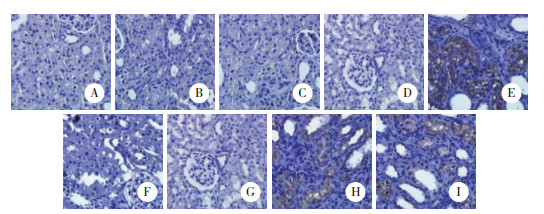
2.4 线粒体空泡化比例电镜下观察发现,M0、M1、M2组中线粒体空泡化比例较对照组增高(P < 0.05),但M0、M1、M2组3组间比较无统计学差异(P > 0.05)。M3组与对照组比较线粒体空泡化比例明显增高(P < 0.01),M3组与M0、M1、M2组比较线粒体空泡化比例也明显增高(P < 0.05)。S0、S1组中线粒体空泡化比例较对照组增高(P < 0.05),但S0、S1组2组间比较无统计学差异(P > 0.05)。S2、S3组与对照组比较线粒体空泡化比例明显增高(P < 0.01),S2、S3组与S0、S1组比较线粒体空泡化比例也明显增高(P < 0.05),而S2、S3组2组间比较线粒体空泡化比例无统计学差异(P > 0.05)。见图 2、表 1。
|
| A, control group; B, M0 group; C, M1 group, D, M2 group; E, M3 group; F, S0 group; G, S1 group; H, S2 group; I, S3 group. 图 2 电镜下观察各组肾组织肾小管上皮细胞线粒体 ×10 000 Fig.2 Mitochondria of renal tubular epithelial cells examined under an electron microscope in each group ×10 000 |
2.5 细胞凋亡指数
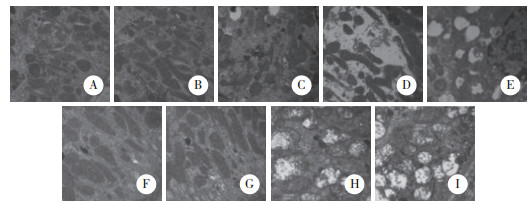
高压灌注导致明显的肾小管细胞凋亡。对照组中可观察到凋亡细胞极少。M0、M1、M2组中细胞凋亡指数较对照组增高(P < 0.05),但M0、M1、M2组3组间比较无统计学差异(P > 0.05)。M3组与对照组比较细胞凋亡指数明显增高(P < 0.01),M3组与M0、M1、M2组比较细胞凋亡指数也明显增高(P < 0.05)。S0、S1组中细胞凋亡指数较对照组增高(P < 0.05),但S0、S1组2组间比较无统计学差异(P > 0.05)。S2、S3组与对照组比较细胞凋亡指数明显增高(P < 0.01),S2、S3组与S0、S1组比较细胞凋亡指数也明显增高(P < 0.05),而S2、S3组2组间比较细胞凋亡指数无统计学差异(P > 0.05)。见图 3、表 1。
|
| A, control group; B, M0 group; C, M1 group, D, M2 group; E, M3 group; F, S0 group; G, S1 group; H, S2 group; I, S3 group. 图 3 各组肾组织肾小管上皮细胞凋亡情况 ×400 Fig.3 Apoptosis of renal tubular epithelial cells in each group ×400 |
3 讨论
经皮肾镜、输尿管镜等常常需要高压灌注。本研究结果表明,一定阀值以上的灌注压力会导致肾氧化损伤;同时,一定程度的肾积水也会导致肾氧化损伤,而肾积水的程度也会影响肾组织对灌注压力的承受能力,积水重的肾脏更容易在肾盂高压灌注中受到氧化损伤。
研究表明,肾盂灌注压力超过30 mmHg可能会引起肾盂静脉回流,而经皮肾镜、输尿管镜等手术通常所用的灌注压力为50~300 mmHg[10]。肾盂静脉回流增加了静脉内压力,肾微血管回流受阻,组织缺血缺氧,从而导致肾脏缺血再灌注损伤。肾静脉梗阻比肾动脉梗阻导致的损伤更严重[11]。
NGAL是急性肾损伤过程中的敏感标志物,在肾损伤后3 h内出现在近曲小管中,在12 h内逐渐释放到血浆中[12]。本研究中,对轻度积水肾脏施加100 mmHg灌注压力以及对重度积水肾脏施加60和100 mmHg灌注压力,均可看到NGAL表达明显增加。本研究结果表明,积水严重的肾脏更容易受到肾盂高压灌注的损伤。
活性氧是组织损伤的重要介质,活性氧的集聚对细胞的危害极大[13]。SOD是一种抗氧化酶,它能对抗活性氧的损伤作用。所以,本研究将SOD水平作为反映组织抗氧化能力的指标。MDA是肾组织中活性氧作用于脂质导致的过氧化作用的产物,MDA的水平反映了组织中氧化损伤的程度[14]。本研究中,相对于对照组,所有肾积水组的SOD活性都较高,而MDA水平都较低,而轻度肾积水模型施加100 mmHg灌注压力时,或重度肾积水模型施加60和100 mmHg灌注压力时,可观察到SOD活性明显下降,MDA水平明显上升。结果表明,积水可导致肾组织出现氧化损伤;积水越重,对肾盂灌注压力耐受能力越差,更容易在肾盂灌注中出现氧化损伤。
保持MMP的稳定对细胞活性十分重要,MMP下降使得线粒体膜通透性转换孔开放,小分子流入,导致线粒体肿胀和空泡化,包括细胞色素C等一些凋亡物质被释放入胞质,触发细胞凋亡[15]。MMP下降被看作是早期细胞凋亡指标。本研究中,100 mmHg灌注压力下,轻度肾积水组MMP明显下降,60和100 mmHg灌注压力下,重度肾积水组MMP明显下降,同时在电镜下观察到这几组肾小管上皮细胞线粒体肿胀和空泡化比例明显增加,这些结果与本研究测得的细胞凋亡指数是一致的。严重积水的肾组织在受到高压肾盂灌注时更容易出现细胞凋亡。
本研究在兔模型上模拟了人体输尿管镜和经皮肾镜手术肾盂灌注的状态,但现有的动物模型也存在一些局限性:由于肾组织耐受性差异,本研究所用的灌注压力与人体手术中所用的肾盂灌注压力在生理上不相关;此外,本研究没有量化肾积水程度,积水程度可能与人体在手术中的具体情况有所不同。本研究没有研究灌注导致的某些肾损伤是否可逆,但是本研究结果证实了严重积水肾脏比轻度积水肾脏对肾盂灌注压力耐受性要差。根据这一结果,需进一步研究导致灌注压力耐受性下降的机制,指导临床手术中使用最佳肾盂灌注压力来保持清楚的视野和冲洗结石碎屑,同时防止或减少肾脏的氧化损伤。
综上所述,肾盂高压灌注可导致肾损伤,而积水程度越重的肾脏对于肾盂灌注的耐受力越差。
| [1] |
SODHA S, NAZARIAN S, ADSHEAD JM, et al. Effect of pneumoperitoneum on renal function and physiology in patients undergoing robotic renal surgery[J]. Curr Urol, 2016, 9(1): 1-4. DOI:10.1159/000442842 |
| [2] |
JANSSEN C, JÄGER W, MOSKALEV I, et al. Erythropoietin accelerates the regeneration of ureteral function in a murine model of obstructive uropathy[J]. J Urol, 2015, 193(2): 714-721. DOI:10.1016/j.juro.2014.08.110 |
| [3] |
徐汉江, 郝宗耀, 曾国华. 肾下盏解剖结构对输尿管软镜碎石术疗效影响的研究进展[J]. 临床泌尿外科杂志, 2018, 33(2): 129-131. DOI:10.13201/j.issn.1001-1420.2018.02.013 |
| [4] |
CEKANOVA M, FERNANDO RI, SIRIWARDHANA N, et al. BCL-2 family protein, BAD is down-regulated in breast cancer and inhibits cell invasion[J]. Exp Cell Res, 2015, 331(1): 1-10. DOI:10.1016/j.yexcr.2014.11.016 |
| [5] |
STAUB D, PARTOVI S, IMFELD S, et al. Novel applications of contrast-enhanced ultrasound imaging in vascular medicine[J]. VASA, 2013, 42(1): 17-31. DOI:10.1024/0301-1526/a000244 |
| [6] |
刘刚, 唐瑭, 谭凡, 等. 肾静态显像诊断上尿路感染的临床研究[J]. 现代生物医学进展, 2016, 16(6): 1124-1127. DOI:10.13241/j.cnki.pmb.2016.06.036 |
| [7] |
ZHANG SW, ZHANG Q, JI CW, et al. Improved split renal function after percutaneous nephrostomy in young adults with severe hydronephrosis due to ureteropelvic junction obstruction[J]. J Urol, 2015, 193(1): 191-195. DOI:10.1016/j.juro.2014.07.005 |
| [8] |
邓飞, 许文德, 姚子明, 等. 经皮肾镜取石术在老年复杂性肾结石中的应用[J]. 中国老年学杂志, 2016, 36(19): 4832-4833. DOI:10.3969/j.issn.1005-9202.2016.19.073 |
| [9] |
程跃, 刘冠琳. 输尿管软镜治疗上尿路结石的现状与进展[J]. 现代泌尿外科杂志, 2014, 19(5): 285-288. DOI:10.3969/j.issn.1009-8291.2014-05-002 |
| [10] |
柳懿鹏, 曹智修, 向威. 肾衰合剂对家兔急性肾盂高灌注压损伤保护作用的实验研究[J]. 中华中医药学刊, 2017, 35(10): 2661-2663. DOI:10.13193/j.issn.1673-7717.2017.10.050 |
| [11] |
COOK J, LAMB BW, LETTIN JE, et al. The epidemiology of urolithiasis in an ethnically diverse population living in the same area[J]. Urol J, 2016, 13(4): 2754-2758. DOI:10.22037/uj.v13i4.3336 |
| [12] |
曹全富, 王洛夫, 兰卫华, 等. C-反应蛋白检测在上尿路结石合并肾脏化脓性感染诊治中的应用价值[J]. 检验医学与临床, 2016, 13(21): 3091-3093. DOI:10.3969/j.issn.1672-9455.2016.21.044 |
| [13] |
ZANETTI SP, BOERI L, CATELLANI M, et al. Retrograde intrarenal surgery (RIRS), regular and small sized percutaneous nephrolithotomy (PCNL) in daily practice:European Association Of Urology Section of Urolithiasis (EULIS) survey[J]. Di, 2016, 88(3): 212-216. DOI:10.4081/aiua.2016.3.212 |
| [14] |
AYDIN M, HAKAN N, DEVECI U, et al. Comment on the paper entitled'Erythropoietin ameliorates oxidative stress and tissue injury following renal ischemia/reperfusion in rat kidney and lung'[J]. Med Princ Pract, 2014, 23(5): 485. DOI:10.1159/000362338 |
| [15] |
FAIZAH MZ, HAMZAINI AH, KANAHESWARI Y, et al. Contrast enhanced Voiding Urosonography (ce-VUS) as a radiation-free technique in the diagnosis of vesicoureteric reflux:our early experience[J]. Med J Malaysia, 2015, 70(5): 269-272. DOI:10.1007/978-3-540-35280-8_647 |
 2019, Vol. 48
2019, Vol. 48