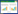文章信息
- 王西强, 杨丹丹, 刘静, 范修德, 马爱群, 刘平
- WANG Xiqiang, YANG Dandan, LIU Jing, FAN Xiude, MA Aiqun, LIU Ping
- 双链DNA与急性ST段抬高型心肌梗死的相关性分析
- Correlation between Double-Stranded DNA and Acute ST Segment Elevation Myocardial Infarction
- 中国医科大学学报, 2019, 48(11): 990-994, 998
- Journal of China Medical University, 2019, 48(11): 990-994, 998
-
文章历史
- 收稿日期:2018-09-17
- 网络出版时间:2019-11-21 13:39
2. 浙江大学医学院第二附属医院心血管内科, 杭州 310000;
3. 西安交通大学第一附属医院感染性疾病科, 西安 710061;
4. 陕西省分子心脏病学重点实验室, 西安交通大学, 西安 710061;
5. 环境与疾病相关基因教育部重点实验室, 西安 710061
2. Department of Cardiovascular Medicine, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310000, China;
3. Department of infectious diseases, The First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China;
4. Key Laboratory of Molecular Cardiology, Xi'an Jiaotong University, Xi'an 710061, China;
5. Key Laboratory of Environment and Genes Related to Diseases of Ministry of Education, Xi'an 710061, China
在冠状动脉病变的基础上,斑块破裂、血栓碎片释放入血,内源性和外源性凝血途径启动,以及随后冠状动脉内血栓形成,是急性心肌梗死发生发展的病理生理学基础,其中中性粒细胞发挥了重要作用[1-2]。研究[3]发现,在动脉粥样硬化的进程中,循环中性粒细胞及构成血管壁的细胞DNA更容易受到损伤,受损细胞通过细胞程序性死亡释放出大量胞外DNA和核小体。通过这种特殊的细胞程序性死亡[4],中性粒细胞、巨噬细胞、单核细胞等释放出球状颗粒串于丝状纤维上,并相互缠绕成网状陷阱样结构,即中性粒细胞外诱捕网(neutrophil extracellular traps,NETs),并促进急性心肌梗死时冠状动脉内血栓形成。NETs结构上的丝状纤维主要由细胞核内的DNA去致密化而来,为非浓缩的双链脱氧核苷酸(double-stranded DNA,dsDNA)纤维,丝状纤维dsDNA构成了NETs的骨架结构[4-5]。有研究[6-9]发现,NETs具有重要的抗感染作用,并在自身免疫性疾病、肿瘤、深静脉血栓、败血症的发生发展中具有重要作用。近期,BORISSOFF等[10]研究发现,在冠状动脉粥样硬化疾病状态下,由体内免疫细胞释放的dsDNA与严重冠状动脉粥样硬化性患者的预后相关,并且可能是促进冠状动脉粥样硬化心脏病发生的病理生理基础。但dsDNA是否与急性ST段抬高型心肌梗死(acute ST-segment elevation myocardial infarction,STEMI)发生相关仍属未知。本研究拟通过分析STEMI患者dsDNA含量与心肌梗死相关指标,探讨dsDNA与STEMI发生的相关性。
1 材料与方法 1.1 研究对象选取2015年6月至12月发病12 h内入住西安交通大学第一附属医院心血管内科重症监护室的STEMI患者共145例,以及健康对照者3例。标本采集前告知并征得研究对象或其委托人同意,并签署知情同意书。本研究经西安交通大学第一附属医院伦理委员会批准,并在其监督下完成。
纳入标准:根据最新中国STEMI诊断及治疗指南[11]诊断为STEMI,发病12 h内,并接受急诊冠状动脉支架植入术开通罪犯血管的患者。排除标准:伴肾功能不全且血清肌酐 > 20 mg/L;伴肝炎、肝硬化,近期出现或持续存在的肝功能异常;伴骨关节炎、类风湿性关节炎、溃疡性肠病、肌炎/肌病、系统性红斑狼疮等系统性疾病;有瓣膜性心脏病、持续性心房纤颤等心血管疾病;不同意及不配合完成本研究者。
1.2 研究方法 1.2.1 记录基线资料包括性别、年龄、身高、体质量、既往病史等基本资料。
1.2.2 采集标本STEMI患者入院后立即于桡动脉或股动脉处取外周动脉血,于术中采集梗死相关冠状动脉血;采集健康对照者外周动脉血。采用EDTA抗凝管取血。
1.2.3 检查生化指标抽血后立即送检血常规、肝肾功、心肌酶谱、肌钙蛋白、血脂全套等常规检查,使用Sysmex XE-5000全自动血液分析仪及配套试剂进行检测。
1.2.4 分离STEMI患者冠状动脉血、外周动脉血及正常人外周血中性粒细胞采用中性粒细胞分离试剂盒进行分离。向15 mL离心管中加入试剂A 5 mL,向分离液液面上加入血液标本,500~550 g高速离心10 min,可见离心管中标本分为单个核细胞层及中性粒细胞层,吸取离心管中中性粒细胞。若中性粒细胞中混杂有红细胞,则加入红细胞裂解液,即可得目的细胞。转移目的细胞至一新的15 mL离心管,并加入10 mL清洗液,250 g高速离心10 min,获得目的细胞。
1.2.5 免疫荧光染色观察STEMI患者梗死相关动脉、外周动脉及健康对照者外周动脉NETs结构并计数分析4%多聚甲醛固定中性粒细胞30 min,用0.1%TX-100作用于中性粒细胞5 min,使细胞膜通透,用BSA封闭1 h,一抗孵育过夜。用PBS清洗细胞,使用DAPI对中性粒细胞细胞核进行着色,封片,使用荧光显微镜观察NETs结构,对不同视野下NETs结构进行计数,并计算NETs结构占总细胞数比例。
1.2.6 检测梗死相关动脉及外周动脉血浆中NETs相关结构dsDNA含量使用荧光染料Sytox Green DNA检测。将标准品与样品按照试剂盒说明书稀释后,用含有0.1%BSA的PBS将血浆标本稀释50倍,用100 μL荧光染料与等体积的稀释样品混合后,加入96孔板中,最终标准品的终浓度为1,0.5,0.25,0.125,0.062 5,0.031 25,0.015 625,0 μg/mL。在激发光为488 nm,发射光为525 nm处,使用荧光读数仪检测信号强度,标本加完后尽快上机,以防止荧光淬灭。
1.3 统计学分析采用SPSS 18.0软件进行统计学分析。符合正态分布的计量资料采用x±s表示,不符合正态分布的计量资料采用中位数表示。2组计量资料符合正态分布及方差齐性的比较采用两独立样本t检验,2组计量资料不符合正态分布与方差齐性的比较采用非参数Mann-Whitney U检验。满足双变量正态分布资料采用Pearson相关系数分析;不满足双变量正态分布或等级资料采用Spearman相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 STEMI患者基线资料入组STEMI患者的基线资料见表 1。
| Variable | STEMI patients(n = 145) | Healthy control(n = 3) |
| Age(year) | 58.69±12.25 | 53.36±11.02 |
| Male [n (%)] | 115(82.1) | 3(100) |
| Hypertension [n (%)] | 52(35.4) | 1(33.3) |
| Diabetes mellitus [n (%)] | 29(20.7) | 0 |
| Smoking [n (%)] | 85(60.7) | 2(66.6) |
| Myocardial infarction [n (%)] | 8(6.4) | 0 |
| Revascularization [n (%)] | 10(7.1) | 0 |
| Chronic heart failure [n (%)] | 2(1.4) | 0 |
| Cerebrovascular disease [n (%)] | 5(3.6) | 0 |
| Onset to admission(h) | 5.40±3.26 | - |
| Admission to the PCI(min) | 52.06±10.30 | - |
| cTnT(ng/mL) | 1.104±2.19 | - |
| CKMB(U/L) | 116.47±146.79 | - |
| Peak CKMB(U/L) | 329.64±212.97 | - |
| Hb(g/L) | 143.37±21.44 | - |
| PLT(×109/L) | 209.54±75.52 | - |
| WBC(×109/L) | 11.26±3.69 | - |
| MONO(×109/L) | 0.47±0.50 | - |
| NEUT(×109/L) | 11.52±13.43 | - |
| NTpro-BNP(pg/mL) | 1 256.83±2 634.31 | - |
| cTnT,cardiac troponin T;CK-MB,creative kinase isoenzyme-MB;Hb,hemoglobin;PCI,percutaneous coronary intervention;PLT,platelets;WBC,white blood cell;MONO,monocyte;NEUT,neutrophil;NT-proBNP,NT-pro brain natriuretic peptide. | ||
2.2 免疫荧光染色结果
梗死相关冠状动脉中可见大量NETs骨架结构生成,见图 1。选取不同视野计数NETs骨架结构占总细胞数比例并进行统计学分析,结果显示,STEMI患者梗死相关冠状动脉中NETs骨架结构(32.33%±4.6%)明显多于STEMI患者外周动脉及健康对照者外周动脉(17.87%±1.017%,7.55%±1.95%),差异有统计学意义(P = 0.037,P = 0.027),见图 2。

|
| A, NETs of polymorphonuclear neutrophils obtained from infarct-related coronary artery; B, NETs of polymorphonuclear neutrophils obtained from peripheral artery of STEMI patients; C, NETs of polymorphonuclear neutrophils obtained from peripheral artery of health people. STEMI-P, peripheral artery of STEMI patients; STEMI-C, infarct related coronary artery of STEMI patients; control, peripheral artery of healthy people. 图 1 免疫荧光染色观察NETs的生成 ×20 Fig.1 Analysis NETs formation by immunofluorescence staining ×20 |
|
| STEMI-P, peripheral artery of STEMI patients; STEMI-C, infarct related coronary artery of STEMI patients; control, peripheral artery of healthy people. 图 2 梗死相关冠状动脉、外周动脉及健康对照者外周动脉NETs生成量 Fig.2 Neutrophil extracellular traps of polymorphonuclear neutrophils obtained from infarct-related coronary artery, peripheral artery, and control peripheral artery |
2.3 免疫酶标仪定量分析结果
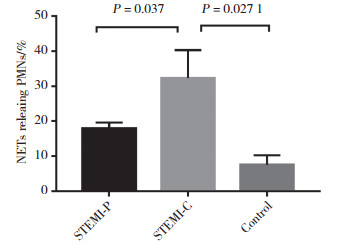
用荧光分光光度仪测定标准品和外周动脉血游离dsDNA含量,绘制标准曲线,R2=0.998 1,见图 3。STEMI患者冠状动脉中dsDNA含量明显高于STEMI患者外周动脉,差异有统计学意义(P = 0.038)。
|
| 图 3 dsDNA标准曲线 Fig.3 Standard curve of dsDNA |
2.4 dsDNA与心肌梗死相关指标的散点图分析
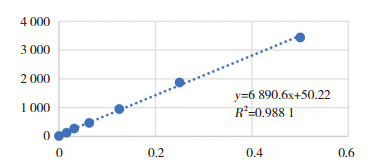
dsDNA与磷酸肌酸激酶(creatine kinase,CK)、磷酸肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)、肌钙蛋白T(troponin T,cTnT)、白细胞(white blood cell,WBC)检测结果行散点图分析,结果见图 4。
|
| A, scatter diagram of dsDNA and CK; B, scatter diagram of dsDNA and CK-MB; C, scatter diagram of dsDNA and cTnT; D, scatter diagram of dsDNA and WBC.CK, creatine kinase; CK-MB, creatine kinase isoenzyme-MB; cTnT, troponin T; WBC, white blood cell. 图 4 磷酸肌酸激酶、磷酸肌酸激酶同工酶、肌钙蛋白T、白细胞计数与dsDNA散点图 Fig.4 Scatter chart of dsDNA and CK, CK-MB, cTnT and WBC |
2.5 dsDNA与心肌梗死相关指标的相关性分析
相关性分析结果显示,CK、CK-MB、cTnT、WBC与dsDNA含量呈正相关,差异有统计学意义,见表 2。
| Variable | coefficient | P |
| CK | 0.185 | 0.030 |
| CK-MB | 0.168 | 0.049 |
| cTnT | 0.337 | 0.003 |
| WBC | 0.181 | 0.033 |
| CK,creatine kinase;CK-MB,creatine kinase isoenzyme-MB;cTnT,troponin T;WBC,white blood cell. | ||
3 讨论
STEMI是冠状动脉粥样硬化性心脏病患者死亡的主要原因[12-13],其发生机制尚不清楚[1, 14]。研究显示,循环中的WBC,特别是单核细胞在动脉粥样硬化血栓形成过程中起重要作用[15],且中性粒细胞是急性心肌梗死患者死亡的独立预测因子[16];中性粒细胞在急性心肌梗死患者冠状动脉血栓中大量聚集[17],并且是预测急性心肌梗死患者远期预后的重要指标[17-19]。但中性粒细胞如何参与上述疾病的发生仍有待进一步探讨。
既往研究[4]显示,中性粒细胞可以通过形成NETs捕获并杀灭病原体。近期的研究[20]发现,NETs不仅对感染性疾病具有保护作用,而且还在动脉粥样硬化以及动脉粥样硬化血栓形成中具有重要作用。本研究检测了STEMI患者梗死相关冠状动脉、外周动脉血中NETs骨架结构、dsDNA含量,结果显示,STEMI患者梗死相关冠状动脉血中NETs骨架结构明显多于STEMI患者外周动脉及健康对照者外周动脉,且STEMI患者冠状动脉中NETs骨架结构dsDNA含量明显高于STEMI患者外周动脉,差异有统计学意义。并对dsDNA含量与心肌酶谱、cTnT、WBC等提示STEMI发生的相关性指标行相关性分析,结果显示,CK、CK-MB、cTnT、WBC与血浆中dsDNA呈正相关,且差异有统计学意义,提示中性粒细胞可能以NETs的形式参与了STEMI的发生,NETs的骨架结构dsDNA可能与STEMI的发生相关,可能为治疗STEMI提供新的思路与靶点。
研究[20]发现,应用动脉粥样硬化小鼠模型,可见中性粒细胞在胆固醇结晶的刺激诱导下形成NETs,巨噬细胞被NETs激活并分泌相关细胞因子,如白细胞介素-1β,在相关细胞因子的作用下,辅助性T细胞17被激活,扩大免疫细胞在粥样硬化灶的聚集,引起慢性炎症反应,为NETs参与冠状动脉粥样硬化的形成、斑块炎症活动提供了可能的机制。研究[21]显示,过度产生的循环DNA、核小体和组蛋白等NETs相关结构在血栓形成、肺炎以及败血症中能够促进疾病的发展,加重病情。由于强有力的细胞毒和促血栓形成作用,胞外DNA可能是炎症和血栓形成之间的桥梁。而且在急性心肌梗死中,中性粒细胞可释放NETs,并暴露有活性的组织因子,激活外源性凝血途径,从而促进急性心肌梗死时血栓的形成[22]。在动脉粥样硬化中,胆固醇刺激NETs的生成,NETs参与并扩大慢性炎症反应,胞外DNA作为炎症和血栓之间的桥梁,促进急性心肌梗死时血栓形成,可能是NETs致STEMI发生的主要机制。因此,中性粒细胞可能以NETs的形式参与了STEMI的发生。
| [1] |
WEBER C, NOELS H. Atherosclerosis:current pathogenesis and therapeutic options[J]. Nat Med, 2011, 17(11): 1410-1422. DOI:10.1038/nm.2538 |
| [2] |
CARBONE F, NENCIONI A, MACH F, et al. Pathophysiological role of neutrophils in acute myocardial infarction[J]. Thromb Haemost, 2013, 110(3): 501-514. DOI:10.1160/TH13-03-0211 |
| [3] |
MAHMOUDI M, MERCER J, BENNETT M. DNA damage and repair in atherosclerosis[J]. Cardiovasc Res, 2006, 71(2): 259-268. DOI:10.1016/j.cardiores.2006.03.002 |
| [4] |
BRINKMANN V, REICHARD U, GOOSMANN C, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303(5663): 1532-1535. DOI:10.1126/science.1092385 |
| [5] |
FUCHS TA, ABED U, GOOSMANN C, et al. Novel cell death program leads to neutrophil extracellular traps[J]. J Cell Biol, 2007, 176(2): 231-241. DOI:10.1083/jcb.200606027 |
| [6] |
HOPPENBROUWERS T, BOEDDHA NP, EKINCI E, et al. Neutrophil extracellular traps in children with meningococcal sepsis[J]. Pediatr Crit Care Med, 2018, 19(6): e286-e291. DOI:10.1097/PCC.0000000000001496 |
| [7] |
DYER MR, CHEN QW, HALDEMAN S, et al. Deep vein thrombosis in mice is regulated by platelet HMGB1 through release of neutrophil-extracellular traps and DNA[J]. Sci Rep, 2018, 8(1): 2068. DOI:10.1038/s41598-018-20479-x |
| [8] |
ROTHER N, PIETERSE E, LUBBERS J, et al. Acetylated histones in apoptotic microparticles drive the formation of neutrophil extracellular traps in active lupus nephritis[J]. Front Immunol, 2017, 8: 1136. DOI:10.3389/fimmu.2017.01136 |
| [9] |
ABDOL RAZAK N, ELASKALANI O, METHAROM P. Pancreatic cancer-induced neutrophil extracellular traps:A potential contributor to cancer-associated thrombosis[J]. Int J Mol Sci, 2017, 18(3): E487. DOI:10.3390/ijms18030487 |
| [10] |
BORISSOFF JI, JOOSEN IA, VERSTEYLEN MO, et al. Elevated levels of circulating DNA and chromatin are independently associated with severe coronary atherosclerosis and a prothrombotic state[J]. Arterioscler Thromb Vasc Biol, 2013, 33(8): 2032-2040. DOI:10.1161/ATVBAHA.113.301627 |
| [11] |
中华医学会心血管病学分会. 急性ST段抬高型心肌梗死诊断和治疗指南[J]. 中华心血管病杂志, 2015, 43(5): 380-393. DOI:10.3760/cma.j.issn.0253-3758.2015.05.003 |
| [12] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2016》概要[J]. 中国循环杂志, 2017, 32(6): 521-528. DOI:10.3969/j.issn.1000-3614.2017.06.001 |
| [13] |
ROGER VL, GO AS, LLOYD-JONES DM, et al. Executive summary:heart disease and stroke statistics:2012 update:a report from the American Heart Association[J]. Circulation, 2012, 125(1): 188-197. DOI:10.1161/CIR.0b013e3182456d46 |
| [14] |
SOEHNLEIN O. Multiple roles for neutrophils in atherosclerosis[J]. Circ Res, 2012, 110(6): 875-888. DOI:10.1161/CIRCRESAHA.111.257535 |
| [15] |
LIBBY P, RIDKER PM, HANSSON GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347): 317-325. DOI:10.1038/nature10146 |
| [16] |
SHAH AD, DENAXAS S, NICHOLAS O, et al. Neutrophil counts and initial presentation of 12 cardiovascular diseases:A CALIBER cohort study[J]. J Am Coll Cardiol, 2017, 69(9): 1160-1169. DOI:10.1016/j.jacc.2016.12.022 |
| [17] |
DISTELMAIER K, WINTER MP, DRAGSCHITZ F, et al. Prognostic value of culprit site neutrophils in acute coronary syndrome[J]. Eur J Clin Invest, 2014, 44(3): 257-265. DOI:10.1111/eci.12228 |
| [18] |
TIAN JF, LIU Y, LIU YF, et al. Prognostic association of circulating neutrophil count with No-reflow in patients with ST-segment elevation myocardial infarction following successful primary percutaneous intervention[J]. Dis Markers, 2017, 2017: 8458492. DOI:10.1155/2017/8458492 |
| [19] |
KONG T, KIM TH, PARK YS, et al. Usefulness of the delta neutrophil index to predict 30-day mortality in patients with ST segment elevation myocardial infarction[J]. Sci Rep, 2017, 7(1): 15718. DOI:10.1038/s41598-017-15878-5 |
| [20] |
WARNATSCH A, IOANNOU M, WANG Q, et al. Inflammation. Neutrophil extracellular traps license macrophages for cytokine production in atherosclerosis[J]. Science, 2015, 349(6245): 316-320. DOI:10.1126/science.aaa8064 |
| [21] |
BRILL A, FUCHS TA, SAVCHENKO AS, et al. Neutrophil extracellular traps promote deep vein thrombosis in mice[J]. J Thromb Haemost, 2012, 10(1): 136-144. DOI:10.1111/j.1538-7836.2011.04544.x |
| [22] |
STAKOS DA, KAMBAS K, KONSTANTINIDIS T, et al. Expression of functional tissue factor by neutrophil extracellular traps in culprit artery of acute myocardial infarction[J]. Eur Heart J, 2015, 36(22): 1405-1414. DOI:10.1093/eurheartj/ehv007 |
 2019, Vol. 48
2019, Vol. 48