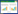文章信息
- 徐婷婷, 白伟良, 谭海燕, 王枭维
- XU Tingting, BAI Weiliang, TAN Haiyan, WANG Xiaowei
- 雷帕霉素对体外培养的鼻息肉细胞增殖的影响
- Effect of Rapamycin on the Proliferation of Nasal Polyp Cells in vitro
- 中国医科大学学报, 2019, 48(11): 978-982
- Journal of China Medical University, 2019, 48(11): 978-982
-
文章历史
- 收稿日期:2018-11-21
- 网络出版时间:2019-11-20 13:33
2. 铁岭市中心医院耳鼻咽喉科, 辽宁 铁岭 112000
2. Department of Otolaryngology, Tieling Central Hospital, Tieling 112000, China
鼻息肉为鼻部常见疾病,鼻塞、流涕、嗅觉障碍等诸多临床症状严重影响患者的生存质量。病因的多元性和术后复发倾向严重危害患者健康,迄今为止,外用和口服皮质类固醇、鼻窦手术是主要的治疗手段[1-2]。鼻息肉形成是多种细胞因子协同作用的结果,很可能受基因调控,在鼻腔外侧壁这个特殊微环境中表达上调,但确切机制尚未明确[3]。研究[4]表明约14%患者有鼻息肉病家族史。前期研究[5]发现PTEN/PI3K/Akt信号通路在鼻息肉中存在Akt激活。PTEN/PI3K/Akt信号通路在鼻息肉发生、发展中可能起重要作用。哺乳动物雷帕霉素蛋白(mammalian target of rapamycin,mTOR)是丝氨酸/苏氨酸蛋白激酶,在感受营养信号、调节细胞生长与增殖中起着关键性作用。mTOR作为PI3K/Akt的下游基因,其表达及活性有可能受到影响。已有研究[6]证明鼻息肉组织中PI3K、Akt和mTOR表达均上调,三者有协同表达关系,提示可能是通过PI3K/Akt/mTOR信号传导通路使炎症细胞凋亡抑制,导致慢性炎症反应,最终形成鼻息肉。
雷帕霉素是一种高效低毒的大环内酯类免疫抑制药。细胞胞质内的激酶mTOR是雷帕霉素已知的主要靶体,它也是mRNA翻译的启动调控因子。Kip1是一种周期素依赖性激酶的抑制剂,能降低活化的T细胞内G1期的周期素与其依赖性激酶复合物的水平。雷帕霉素通过阻断Kip1的下调而将细胞阻滞于G1期[4]。mTOR的信号通路在鼻息肉中的作用机制尚不明确,本研究探讨雷帕霉素对鼻息肉细胞增殖的影响,分析mTOR信号通路在鼻息肉发生发展中的作用。
1 材料与方法 1.1 标本选取标本取自2013年11月至2015年4月期间中国医科大学附属盛京医院耳鼻咽喉科行鼻内镜下鼻息肉切除手术中取得的鼻息肉组织。所有鼻息肉标本均由2名病理学医师证实,本研究符合医学伦理学原则,并取得患者的知情同意。
1.2 实验方法 1.2.1 鼻息肉细胞原代培养于手术室将术中的鼻息肉标本立即用生理盐水冲洗干净,放入培养皿中,取适量0.25%蛋白酶加入培养皿中,置4 ℃冰箱中消化20 h,加入适量胎牛血清终止消化。将细胞悬液1 500 r/min离心5 min,然后用10%胎牛血清培养基离心洗涤2次,加入适量10%胎牛血清培养基制成细胞悬液,以吸管吸少许细胞悬液(3~5滴)滴至EP管中,加入等量1%台盼蓝2 min,微量移液器吸取100 μL细胞悬液滴于盖好玻片的细胞计数板上,观察细胞活性并计数。台盼蓝染色证明细胞活性 > 90%,稀释细胞悬液至1×106/mL,接种于25 cm2细胞培养瓶中,置37 ℃,5%CO2细胞培养箱中孵育15~20 min。根据ABC贴壁法去除鼻黏膜上皮细胞中的大部分成纤维细胞及红细胞,10%胎牛血清培养基培养约40 h后,更换为无血清含8种生长因子培养基(培养基中含100 UI/mL青链霉素,50 μg/mL庆大霉素,2.5 μg/mL两性霉素B)。倒置显微镜下观察细胞形态、增殖及生长情况,并进行拍照。
1.2.2 流式细胞术检测取37 ℃、5%CO2、饱和湿度条件下细胞贴壁生长良好的原代培养6 d的鼻息肉细胞,PBS清洗2次,弃去上清,加入适当体积的0.25%胰酶消化细胞,待细胞变圆后,加入完全培养基终止反应。收集混合液至15 mL试管,800 r/min离心3 min。将收集到的所有细胞用含5%BSA的PBS洗涤2次,800 r/min离心5 min收集细胞,每管细胞样品中加入500 μL PBS轻轻重悬细胞。将细胞分2组,实验组加入5 μL细胞角蛋白抗体(Alexa Fluor® 647Mouse Anti-Human Cytokeratin),混匀;对照组不做处理,37 ℃避光孵育30 min后进行流式细胞术检测。
1.2.3 MTT法检测细胞增殖以含8种生长因子的DMEM/F2(1:1)培养基原代培养的鼻息肉细胞,取对数生长期细胞以5%蛋白酶消化后,3×103/mL的浓度接种到96孔板上,每孔200 μL,置于37 ℃,5%CO2培养箱中培养。取出96孔板小心吸尽每孔培养基,并加入含不同浓度雷帕霉素的培养基,每个浓度的雷帕霉素设5个复孔,6个实验组加入雷帕霉素终浓度分别为0、3、10、100、300、1 000、3 000、10 000、30 000 ng/mL。以不加药物的细胞悬液为阴性对照组,以不含细胞的培养基为空白组用于仪器校零。加药后的96孔板继续置于37 ℃,5%CO2培养箱中培养48 h。向培养板中每孔加入180 μL DMEM/F2(1:1)培养基,再加入20 μL MTT工作液(0.2 mg/mL),置于培养箱中培养4 h。取出96孔板,每孔加入200 μL DMSO,置于摇床上低速振荡10 min,将96孔板置于酶标仪上,在490 nm处测量各孔吸光值。
1.3 统计学分析采用SPSS 16.0软件进行数据分析,计量资料采用x±s表示,组间比较采用t检验,应用改良的寇氏法[7]计算雷帕霉素半抑制浓度(half-inhibitory concentration,IC50),计算细胞的抑制率。P < 0.05为差异有统计学意义。
2 结果 2.1 鼻息肉细胞原代培养结果结果显示,细胞原代培养1 d后开始贴壁,3~4 d细胞部分融合,6~7 d基本完全融合。原代培养6 d的鼻息肉细胞呈单层融合生长,大部分细胞呈鹅卵石状(图 1A),少量梭形细胞存在,细胞分裂相明显(图 1B),细胞呈椭圆形,细胞膜上纤毛倒伏,镜下可见纤毛摆动,细胞核类圆形,胞质内有分泌颗粒及空泡形成(图 1C)。
|
| A, polyp cells show paving stone-like fusion growth×4;B, ← spindle cells (×10);C, ↘ the cells in division phase (×10);D, → secretory granules, ↓vacuoles, ↖cilia (×20). 图 1 倒置显微镜下观察原代培养6 d的鼻息肉细胞的形态结构 Fig.1 The morphological structure of nasal polyp cells was observed under an inverted microscope after 6 days of primary culture |
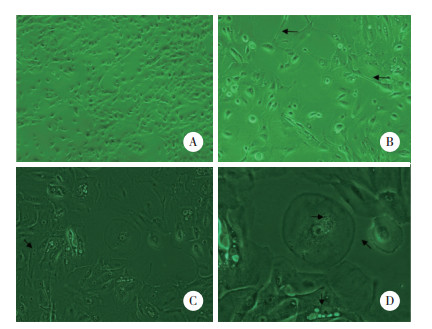
2.2 流式细胞术检测结果
结果显示,对照组阳性细胞率为(4.8±0.9)%,实验组阳性细胞率为(60.9±4.7)%,2组差异有统计学意义(t = 26.214,P < 0.001)。见图 2。
|
| A, control group; B, experimental group. 图 2 流式细胞术鉴定结果 Fig.2 Results of flow cytometry |
2.3 鼻息肉细胞增殖及雷帕霉素IC50结果
结果显示,阴性对照组(0 ng/mL雷帕霉素)、3、10、100、300、1 000、3 000、10 000、30 000 ng/mL雷帕霉素组细胞抑制率分别为(0.0±0.0)%、(11.6±0.4)%、(21.78±1.2)%、(31.8±4.8)%、(42.8±5.4)%、(82.9±6.5)%、(91.2±6.8)%、(96.2±6.4)%、(98.2±7.1)%。与阴性对照组比较,100 ng/mL和300 ng/mL雷帕霉素组抑制率明显增加(均P < 0.05);1 000 ng/mL及以上浓度组抑制率均在80%左右,对细胞抑制率增大更明显(均P < 0.05)。可见,雷帕霉素呈浓度依赖方式抑制细胞的增殖。
将MTT获得的数据(0~1 000 ng/mL)代入到改良的窛式法公式中,求得IC50=495.800 ng/mL。
3 讨论鼻息肉是常见的慢性鼻黏膜炎症疾病,发病率较高,易复发,严重影响患者的日常生活质量。近年来研究[8-9]表明,鼻息肉组织中有大量的细胞因子、趋化因子和黏附分子的表达,这些化学因子介导炎症细胞的趋化、聚积、活化和抗凋亡过程,直接导致疾病的发生。鼻息肉的病理学改变包括上皮细胞增殖、嗜酸性粒细胞浸润、细胞外基质增加、血管通透性增加。上皮细胞增殖的增强在鼻息肉的发病过程中起重要作用,并与炎症有关[10]。由炎症介质引起的上皮细胞的损伤可通过上皮细胞的修复而被诱导增殖[11]。息肉最初形成时基底膜及覆盖的上皮层局部破裂,随后固有层的炎症结缔组织经上皮缺损处膨出,然后该处周围边缘的上皮细胞分化使膨出的组织再上皮化,这一黏膜的再生过程导致息肉黏膜突起。组织水肿是血管通透性增高的结果。鼻息肉的病理改变提示研究鼻息肉形成机制的切入点可在诱导鼻腔黏膜发生改变的因素中寻找。
mTOR可磷酸化p70S6K和4E-BP1,促进蛋白质合成。mTOR的活性受氨基酸尤其是亮氨酸浓度的调节,生长因子及能量水平也能通过AMPK调节mTOR活性。PI3K/Akt和Akt/TSC1-TSC2两条信号通路都可调控mTOR活性,进而调节细胞的生长与增殖[12]。在PI3K/ Akt/ mTOR信号通路中,PI3K可被激活的Ras通路以及一些生长因子及细胞因子(胰岛素样生长因子、表皮生长因子、血小板源性生长因子、集落刺激因子等[13])激活。活化的PI3K使Akt的308位的Thr磷酸化,在PDK-2的存在下,其473位的Ser再被磷酸化从而使Akt完全激活。Akt活化后可磷酸化TSC-2的Ser939和Thr1462,抑制了TSC-1/ TSC-2复合物的形成,从而解除了对Rheb的抑制作用,使mTOR激活。有研究[6]证明鼻息肉组织中PI3K、Akt和mTOR表达均上调,三者有协同表达关系,提示可能是通过PI3K/Akt/mTOR信号转导通路使炎症细胞凋亡受到抑制,导致慢性炎症反应,最终形成鼻息肉。
雷帕霉素在细胞外的受体为FK506结合蛋白FKBP-12。近年来,雷帕霉素在脏器移植术后[14]、肿瘤治疗[15]及预防冠状动脉支架成形术后再狭窄[16]等方面的作用得到了广泛研究,并且已成功应用于临床。本研究结果显示,原代培养方法培养的鼻息肉细胞生长良好,大量铺路石样细胞经鉴定为鼻息肉黏膜上皮细胞,少量梭形细胞可能为成纤维细胞。与阴性对照组比较,100 ng/mL和300 ng/mL雷帕霉素组抑制率明显增加(P < 0.05);1 000 ng/mL及以上浓度组抑制率均在80%左右,对细胞抑制率增大更明显(均P < 0.05)。可见,雷帕霉素呈浓度依赖方式抑制细胞的增殖。MTT实验中细胞抑制率达80%时,增大药物浓度后细胞抑制率不再发生明显变化,可能是因为原代培养的鼻息肉细胞中大部分细胞为黏膜上皮细胞,雷帕霉素抑制的细胞可能为此部分细胞。剩余未被抑制的细胞可能为少部分鼻息肉中的成纤维细胞及其他种类细胞。提示雷帕霉素可能对鼻息肉黏膜细胞作用较为显著,但具体作用机制还有待进一步研究。
综上所述,雷帕霉素可以抑制鼻息肉细胞的增殖。并且随药物浓度增大,对细胞增殖的抑制力明显增强。认为mTOR信号通路在鼻息肉的发生发展中可能起一定的作用。本实验中因取材的部位不同,处理时间不同等因素可能导致原代培养的细胞成分组成差异较大,因此可能对雷帕霉素抑制鼻息肉细胞增殖的作用有一定影响。
| [1] |
刘承耀, 王向东, 郑铭, 等. 鼻用糖皮质激素对变应性鼻炎和非变应性鼻炎患者鼻呼吸道一氧化氮浓度的影响[J]. 中国耳鼻咽喉头颈外科, 2018, 25(6): 309-314. DOI:10.16066/j.1672-7002.2018.06.007 |
| [2] |
朱晓燕, 杨明, 何新亚, 等. 鼻内镜手术术后处理方法与鼻-鼻窦良性病变转归关系的研究[J]. 检验医学与临床, 2017, 14(7): 966-968. DOI:10.3969/j.issn.1672-9455.2017.07.021 |
| [3] |
王彤, 臧洪瑞, 李云川, 等. MAPK信号通路在慢性鼻-鼻窦炎伴鼻息肉和不伴鼻息肉的黏膜上皮修复机制中的作用[J]. 临床耳鼻咽喉头颈外科杂志, 2018, 32(21): 17-21. DOI:10.13201/j.issn.1001-1781.2018.21.004 |
| [4] |
陶源, 陆兴, 曾沛英. 初次与再次手术鼻-鼻窦炎鼻息肉患者的生存质量调查[J]. 中国耳鼻咽喉颅底外科杂志, 2017, 23(3): 251-255. DOI:10.11798/j.issn.1007-1520.201703014 |
| [5] |
LEE DS, LEE CM, PARK SK, et al. Anti-inhibitory potential of an ethanolic extract of Distromium decumbens on pro-inflammatory cytokine production in Pseudomonas aeruginosa lipopolysaccharide-stimulated nasal polyp-derived fibroblasts[J]. Int J Mol Med, 2017, 40(6): 1950-1956. DOI:10.3892/ijmm.2017.3182 |
| [6] |
林董, 林海, 戴雄雄, 等. PI3K/Akt/mTOR信号转导通路在鼻息肉中的表达[J]. 贵阳医学院学报, 2012, 37(6): 597-600. DOI:10.3969/j.issn.1000-2707.2012.06.004 |
| [7] |
李询, 罗军强, 周捷, 等. 紫苏醇对肺癌细胞的体外药效作用及毒理学评价[J]. 广东药学院学报, 2010, 26(3): 287-291. DOI:10.3969/j.issn.1006-8783.2010.03.018 |
| [8] |
朱荣飞, 江剑桥, 杨何. 不同亚型鼻息肉患者组织中Th细胞亚群及相关细胞因子表达水平分析[J]. 中国煤炭工业医学杂志, 2018, 21(1): 44-47. DOI:10.11723/mtgyyx1007-9564201801010 |
| [9] |
刘洋, 崔永华, 俞琳琳, 等. 缺氧诱导因子1α在鼻息肉组织中的表达及其与血管内皮生长因子和诱导性一氧化氮合酶的相关性[J]. 中华耳鼻咽喉头颈外科杂志, 2005, 40(5): 366-370. DOI:10.3760/j.issn:1673-0860.2005.05.013 |
| [10] |
邓慧仪, 李美娇, 王玮豪, 等. Yes相关蛋白在慢性鼻窦炎伴鼻息肉中的表达及与细胞增殖的相关性分析[J]. 新医学, 2017, 48(11): 779-783. DOI:10.3969/j.issn.0253-9802.2017.11.007 |
| [11] |
郝从芳, 谢亚栋, 马世鑫, 等. 锌指蛋白CXXC5通过调节肠上皮细胞的增殖修复以控制肠炎的发生[J]. 免疫学杂志, 2018, 34(8): 674-682. DOI:10.13431/j.cnki.immunol.j.20180104 |
| [12] |
邹冬梅, 王少华. mTOR信号通路与支气管肺发育不良[J]. 国际儿科学杂志, 2016, 43(1): 41-44. DOI:10.3760/cma.j.issn.1673-4408.2016.01.011 |
| [13] |
李妍妍, 张辉, 秦晓毅, 等. PI3K/Akt信号通路激活抑制细胞凋亡的研究进展[J]. 浙江临床医学, 2013(4): 574-577. DOI:10.3969/j.issn.1008-7664.2013.04.074 |
| [14] |
郝晓军. 雷帕霉素用于男性肾移植术后治疗癌症发生率的Meta分析[J]. 中国药物与临床, 2017, 17(1): 122-124. DOI:10.11655/zgywylc2017.01.052 |
| [15] |
陈建斌, 陈国勇, 孙建军, 等. 索拉非尼治疗肝癌肝移植术后肿瘤复发的临床疗效观察[J]. 器官移植, 2013, 4(2): 98-101. DOI:10.3969/j.issn.1674-7445.2013.02.008 |
| [16] |
钟继明, 黄学成, 张景昌, 等. 冠状动脉雷帕霉素涂层支架植入术后支架内再狭窄临床预测因素探讨[J]. 介入放射学杂志, 2017, 26(10): 874-877. DOI:10.3969/j.issn.1008-794X.2017.10.003 |
 2019, Vol. 48
2019, Vol. 48