文章信息
- 姜佳蕾, 蒋昆谕, 牛慧敏, 董松涛, 王诗琪, 孟胜男
- JIANG Jialei, JIANG Kunyu, NIU Huimin, DONG Songtao, WANG Shiqi, MENG Shengnan
- 内质网应激对白藜芦醇代谢的影响
- Effects of Endoplasmic Reticulum Stress on Resveratrol Metabolism
- 中国医科大学学报, 2019, 48(11): 961-964
- Journal of China Medical University, 2019, 48(11): 961-964
-
文章历史
- 收稿日期:2018-11-19
- 网络出版时间:2019-11-20 11:36
内质网是细胞蛋白质合成和折叠的重要场所。各种生理或病理因素都能干扰蛋白质合成过程,从而使未折叠和错误折叠蛋白在腔内聚集,引起内质网应激(endoplasmic reticulum stress,ERS)[1-2]。ERS是慢性代谢疾病的重要标志,也是连接免疫系统与代谢系统的桥梁[3-4],但ERS对药物代谢是否有影响目前尚不清楚。肝脏是最重要的代谢和解毒器官,肝细胞富含内质网,是ERS最为敏感的细胞之一[5]。目前,ERS对药物Ⅰ相代谢影响的研究比较活跃[6],但ERS对药物Ⅱ相代谢影响的研究较少。随着药物代谢研究的深入和发展,药物Ⅱ相代谢对药物处置的重要性越来越受到重视[7]。尿苷二磷酸葡萄糖酸转移酶(UDP-glucuronosyltransferases,UGTs)是最重要的Ⅱ相药物代谢酶,UGTs介导的葡萄糖醛酸化结合反应对药物的生物利用度、解毒及药物相互作用等有非常重要的作用[4, 8-9]。肝脏中的UGTs表达量很高,且位于内质网膜上,如果机体发生ERS,可能会直接造成UGTs表达和活性的改变。白藜芦醇具有抗肿瘤、免疫调节及类雌激素样活性等广泛的药理作用[10],是目前新药开发研究中极具应用前景和临床价值的热点化合物之一[11]。研究[12-13]显示,白藜芦醇的体内外代谢模式主要是UGTs介导的Ⅱ相代谢,且UGT1A1及UGT1A9在其代谢中发挥重要作用。因此,本研究选择白藜芦醇作为模型药物,以考察ERS对白藜芦醇代谢的影响,并探讨ERS是否对UGTs介导的葡萄糖醛酸化代谢产生影响。
1 材料与方法 1.1 材料 1.1.1 药物及试剂反式-白藜芦醇(98%,上海诺特生物科技有限公司);毒胡萝卜素(thapsigargin,Tg,98%,美国APExBIO公司);蛇床子素(98%,大连美伦生物技术有限公司);Bip抗体(美国Cell Signaling Technology公司);UGT1A1抗体、UGT1A9抗体(中国Absin公司);辣根过氧化物酶标记的山羊抗兔Ig(H+L)二抗(中国ABBKIN公司);HepG2细胞正常组裂解液及Tg诱导模型组裂解液(自提,1.28 mg/mL);辅因子UDPGA、丙甲菌素(美国Sigma-Aldrich公司);DMEM、胎牛血清、胰酶(美国Invitrogen公司);非必需氨基酸、青-链霉素双抗溶液(美国Hyclone公司);乙腈(色谱纯,天津康科德公司);其他试剂为分析纯,超纯水。
1.1.2 仪器UPLC-Waters,Waters 2996 PDA检测器(美国Waters公司);Aquasonic 150D超声波仪(美国VWR Scientific公司);凝胶成像系统(以色列DNR公司)。
1.2 方法 1.2.1 ERS细胞模型制备用含10%胎牛血清的DMEM培养液在37℃、5% CO2恒温培养箱中培养肝癌HepG2细胞(本实验室保存)。取对数期HepG2细胞,随机分为正常组和模型组,模型组细胞用1 μmol/L Tg处理24 h,诱导制备ERS模型,收集细胞。
1.2.2 Westem blotting检测葡萄糖调节蛋白78(glucose regulated protein,GRP78)表达水平的变化裂解HepG2野生型及诱导型细胞,收集蛋白。行SDS-PAGE(分离胶浓度12%),转膜,5%脱脂奶粉封闭1 h;分别加入GRP78、UGT1A1、UGT1A9的多克隆抗体,4℃缓慢震荡孵育过夜;洗膜后,加入山羊抗兔二抗,室温孵育1 h;再次洗膜后,ECL发光显像。GAPDH作内参照蛋白。
1.2.3 色谱色谱柱为CQUITY UPLC BEH C18(1.7 µm,2.1 mm×50 mm);流动相为乙酸铵水溶液(A)(2.5 mmol/L,pH7.4),乙腈(B)(色谱级)。采取梯度洗脱,0~0.5 min,7% B;0.5~1.5 min,7%~15% B;1.5~3.5 min,15%~50% B;3.5~4.0 min,50%~85% B;4.0~4.5 min,85%~7% B;4.5~6.0 min,7% B;进样量10 μL,流速0.25 mL/min,柱温35℃,内标为蛇床子素。
1.2.4 样品处理及体外孵育实验 1.2.4.1 细胞培养及细胞裂解液的制备胰酶消化融合达90%~95%的HepG2细胞,将细胞混悬液(2×105/mL)种植于10 cm培养皿中,培养3 d,PBS洗3次,加入1 mL PBS后将细胞刮下,4℃ 3 000 r/min离心8 min,在冰冷水浴中用Aquasonic 150D超声波仪以最大功率(135平均瓦特)的短脉冲超声处理细胞悬浮液8 min,收获所得细胞裂解液并测定浓度。
1.2.4.2 白藜芦醇肝细胞裂解液体外葡萄糖醛酸化代谢孵育实验制终浓度分别为100、500、1 000 μmol/L的白藜芦醇-甲醇溶液。分别取白藜芦醇的储备液,KPI缓冲溶液、UGDPA、丙甲菌素、细胞裂解酶蛋白按3:186:42:53:16混合,反应体系总体积为200 μL,37 ℃恒温振荡水浴箱中孵育,根据反应速率设定不同的孵育时间。孵育结束后立即取出置于冰浴中,加冰甲醇终止反应,加入内标蛇床子素溶液50 μL,4℃、15 000 r/min离心20 min,取上清进行色谱检测(检测波长306 nm)。
1.3 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。所有数据点均为3次测定的平均值,以x±s表示。2组间差异比较采用Student’s t检验,P < 0.05为差异有统计学意义。
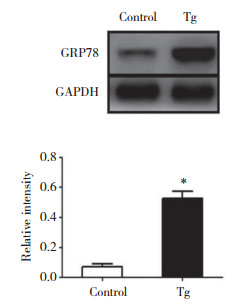
2 结果 2.1 ERS细胞模型的验证通过Western blotting检测ERS标志性蛋白GRP78的表达变化,验证模型是否构建成功。结果显示,经Tg诱导的模型组HepG2细胞中GRP78蛋白表达增加至正常组的7.35倍,差异有统计学意义(P < 0.001),证明ERS细胞模型构建成功,见图 1。
|
| *P < 0.001, compared with control group. 图 1 Tg对HepG2细胞GRP78蛋白表达水平的影响 Fig.1 The effect of Tg on the expression of GRP78 in HepG2 cells |
2.2 ERS对UGT1A1和UGT1A9蛋白表达的影响
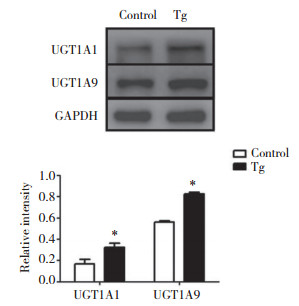
与正常组相比,模型组HepG2细胞中Ⅱ相药物代谢酶UGT1A1、UGT1A9蛋白表达分别增高了1.96倍、1.47倍,差异有统计学意义(P < 0.05),见图 2。表明ERS可以上调UGT1A1、UGT1A9的蛋白表达。
|
| *P < 0.05, compared with control group. 图 2 Tg对HepG2细胞UGT1A1和UGT1A9蛋白表达水平的影响 Fig.2 The effect of Tg on the expression of UGT1A1 and UGT1A9 in HepG2 cells |
2.3 ERS对白藜芦醇葡萄糖醛酸化代谢反应速率的影响
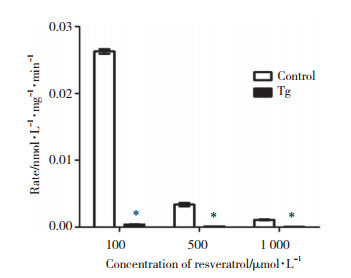
细胞裂解液孵育实验结果显示,白藜芦醇在正常组HepG2中有代谢产物生成,而在模型组中代谢产物则很少(图 3)。白藜芦醇药物浓度为100、500、1 000 μmol/L时,正常组代谢速率分别是模型组的61.89倍、25.58倍、20.21倍,有统计学差异(P < 0.001),见图 3。证实ERS可导致白藜芦醇的葡萄糖醛酸化代谢显著减弱。
|
| *P < 0.001, compared with control group. 图 3 白藜芦醇在正常组和模型组HepG2细胞裂解液中孵育的葡萄糖醛酸化代谢速率 Fig.3 Glucuronidation metabolism rate of resveratrol in wild-type HepG2 cell lysate and Tg-induced cell lysate |
3 讨论
肝脏是机体最重要的药物代谢器官,内、外源性化合物(包括药物和毒物)通过Ⅰ相和Ⅱ相代谢完成生物转化。肝脏富含药物Ⅰ相和Ⅱ相代谢酶,介导Ⅰ相和Ⅱ相代谢的2个非常重要的酶系,即细胞色素P450酶(cytochrome P450,CYP450)和UGTs均定位于肝细胞内质网中。因此,内质网功能的正常维持对药物代谢具有重要的生物学意义。研究[14]证明,肝损伤及疾病,如肝纤维化、病毒性肝炎、药物性肝炎、非酒精性脂肪肝等可以影响药物代谢酶的表达和功能,且这些损伤和疾病都会引发ERS。因此,明确ERS对药物代谢的影响,对临床提高药物疗效、减少药物不良反应、避免药物相互作用具有重要意义,也是药物精准治疗的迫切需要。
本研究重点探讨了ERS对Ⅱ相药物代谢酶UGTs表达和功能的影响。本研究选用了肝癌HepG2细胞,原因在于肝脏是人体内最重要的代谢和解毒器官。由于正常人体肝脏的细胞株奇缺或难于购买,故本研究选择了目前药物代谢研究中应用广泛、非常活跃、稳定且癌性较低的HepG2细胞。另外,研究[15]证实,HepG2细胞中有较完整的Ⅰ相和Ⅱ相代谢酶的表达,这是选择该种细胞的另一个重要原因。
本研究仅从多个UGTs亚型中选择了UGT1A1和UGT1A9作为研究对象,是由于有多篇文献[16-17]证实两者是白藜芦醇的主要代谢酶。本研究结果显示,ERS可导致这2种主导代谢酶的表达发生显著改变,并且UGTs介导的酶学孵育实验结果也证实白藜芦醇代谢速率的变化趋势与UGT1A1和UGT1A9蛋白表达变化的趋势一致。提示ERS条件下UGT1A1和UGT1A9仍在白藜芦醇的代谢中发挥主要作用。后续研究将通过应用UGT1A1或UGT1A9抑制剂及靶基因调控实验进一步确定2种酶的具体作用机制。
目前,常用的制备ERS细胞模型的诱导剂有衣霉素和Tg。但由于UGT1A9的活性可受衣霉素造成的非糖基化影响而失活,而Tg没有非糖基化效应[18]。因此,本研究选择Tg作为ERS模型制备的工具药。
总之,本研究结果证实,ERS可引起UGTs介导的白藜芦醇Ⅱ相代谢发生变化。今后将深入探究ERS对其他Ⅱ相代谢的影响,并综合阐释ERS对药物代谢的作用。
| [1] |
BRAVO R, PARRA V, GATICA D, et al. Endoplasmic reticulum and the unfolded protein response:dynamics and metabolic integration[J]. Int Rev Cell Mol Biol, 2013, 301: 215-290. DOI:10.1016/B978-0-12-407704-1.00005-1 |
| [2] |
林丽, 唐朝枢, 袁文俊. 内质网应激[J]. 生理科学进展, 2003, 34(4): 333-335. DOI:10.3321/j.issn:0559-7765.2003.04.010 |
| [3] |
SUYAMA K, WATANABE M, SAKABE K, et al. Overexpression of GRP78 protects glial cells from endoplasmic reticulum stress[J]. Neurosci Lett, 2011, 504(3): 271-276. DOI:10.1016/j.neulet.2011.09.045 |
| [4] |
MRÓZ A, MAZERSKA Z. Glucuronidation of antitumour therapeutics:detoxification, mechanism of resistance or prodrug formation?[J]. Postepy Hig Med Dosw (Online), 2015, 69: 1462-1477. |
| [5] |
丁娇, 马向华, 沈捷. 内质网应激与代谢性疾病[J]. 江苏医药, 2012, 38(3): 332-334. DOI:10.19460/j.cnki.0253-3685.2012.03.032 |
| [6] |
LUOMA PV. Gene-activation mechanisms in the regression of atherosclerosis, elimination of diabetes type 2, and prevention of dementia[J]. Curr Mol Med, 2011, 11(5): 391-400. DOI:10.2174/156652411795976556 |
| [7] |
JANCOVA P, ANZENBACHER P, ANZENBACHEROVA E. Phase Ⅱdrug metabolizing enzymes[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2010, 154(2): 103-116. DOI:10.5507/bp.2010.017 |
| [8] |
ZENG XH, CAI DK, ZENG QH, et al. Selective reduction in the expression of UGTs and SULTs, a novel mechanism by which piperine enhances the bioavailability of curcumin in rat[J]. Biopharm Drug Dispos, 2017, 38(1): 3-19. DOI:10.1002/bdd.2049 |
| [9] |
ZHANG N, LIU Y, JEONG H. Drug-drug interaction potentials of tyrosine kinase inhibitors via inhibition of UDP-glucuronosyltransferases[J]. Sci Rep, 2015, 5: 17778. DOI:10.1038/srep17778 |
| [10] |
GLIEMANN L. What are the chances that resveratrol will be the drug of tomorrow?[J]. Pharmacol Res, 2018, 129: 139-140. DOI:10.1016/j.phrs.2018.02.004 |
| [11] |
GOUTHAM G, MANIKANDAN R, BEULAJA M, et al. A focus on resveratrol and ocular problems, especially cataract:from chemistry to medical uses and clinical relevance[J]. Biomedecine Pharmacother, 2017, 86: 232-241. DOI:10.1016/j.biopha.2016.11.141 |
| [12] |
SUN Z, SHI S, LI H, et al. Evaluation of resveratrol sensitivities and metabolic patterns in human and rat glioblastoma cells[J]. Cancer Chemother Pharmacol, 2013, 72(5): 965-973. DOI:10.1007/s00280-013-2274-y |
| [13] |
BÖHMDORFER M, SZAKMARY A, SCHIESTL RH, et al. Involvement of UDP-glucuronosyltransferases and sulfotransferases in the excretion and tissue distribution of resveratrol in mice[J]. Nutrients, 2017, 9(12): E1347. DOI:10.3390/nu9121347 |
| [14] |
WOOLBRIGHT BL, JAESCHKE H. Xenobiotic and endobiotic mediated interactions between the cytochrome P450 system and the inflammatory response in the liver[J]. Adv Pharmacol, 2015, 74: 131-161. DOI:10.1016/bs.apha.2015.04.001 |
| [15] |
肖文璟, 王广基, 阿基业. 肿瘤细胞中药物代谢酶表达和活性的研究与进展[J]. 药学学报, 2014, 49(10): 1377-1386. DOI:10.16438/j.0513-4870.2014.10.015 |
| [16] |
SABOLOVIC N, HUMBERT AC, RADOMINSKA-PANDYA A, et al. Resveratrol is efficiently glucuronidated by UDP-glucuronosyltransferases in the human gastrointestinal tract and in Caco-2 cells[J]. Biopharm Drug Dispos, 2006, 27(4): 181-189. DOI:10.1002/bdd.498 |
| [17] |
MENG J, GUO FQ, XU HY, et al. Combination therapy using Co-encapsulated resveratrol and paclitaxel in liposomes for drug resistance reversal in breast cancer cells in vivo[J]. Sci Rep, 2016, 6: 22390. DOI:10.1038/srep22390 |
| [18] |
NAKAJIMA M, KOGA T, SAKAI H, et al. N-Glycosylation plays a role in protein folding of human UGT1A9[J]. Biochem Pharmacol, 2010, 79(8): 1165-1172. DOI:10.1016/j.bcp.2009.11.020 |
 2019, Vol. 48
2019, Vol. 48