文章信息
- 钟宇, 田芳, 邹明宇, 杨本强, 刘文源
- ZHONG Yu, TIAN Fang, ZOU Mingyu, et al
- IgG4相关性疾病的影像学特征分析
- Imaging Characteristics of IgG4-Related Diseases
- 中国医科大学学报, 2019, 48(10): 939-943
- Journal of China Medical University, 2019, 48(10): 939-943
-
文章历史
- 收稿日期:2019-04-07
- 网络出版时间:2019-09-27 14:55
IgG4相关性疾病(IgG4-related disease,IgG4-RD)是一组累及全身多组织器官的系统性慢性自身免疫性疾病。2011年波士顿会议将此类疾病命名为“IgG4-RD”,如IgG4相关性胰腺炎,IgG4相关性硬化性胆管炎等[1]。IgG4-RD多见于中老年人,男女比例约2:1,常见受累器官或部位有胰腺、胆道系统、肾脏、肝脏、腹膜后、肺、乳腺、涎腺、泪腺、眶周组织、主动脉、消化道及淋巴结[2]。可累及单个器官或同时累及多个器官。受累器官表现为慢性炎症、肿大或增生病变、纤维化,不同组织器官临床表现出多样化。治疗首选激素,临床效果良好。
IgG4-RD主要临床特征是血清IgG4升高(≥135 mg/dL),大量淋巴细胞和IgG4+浆细胞广泛浸润组织器官,导致受累组织器官肿胀、纤维化[3]。目前,影像学检查可以观察病变形态、范围,同时可对激素治疗效果进行评价,因此影像学检查在IgG4-RD诊断和治疗中十分重要[4]。本研究收集本院9例确诊为IgG4-RD患者的临床及影像学资料,分析其CT和MR影像特征,旨在为提高IgG4-RD的诊断水平提供参考。
1 材料与方法 1.1 临床资料收集2016年1月至2019年3月本院诊治的9例IgG4-RD患者的临床资料,其中男7例,女2例,年龄37~68岁(平均55.1岁),主要临床表现为腹痛或上腹不适(8例)、梗阻性黄疸及肝功异常(4例)、低热(1例)。合并糖尿病3例。血清学检查IgG升高(≥135 mg/dL,8例)、IgG4升高(≥135 mg/dL,6例),CA199升高(≥37 U/mL,2例)。
1.2 影像检查9例均行腹部平扫及增强扫描,CT检查4例,MR检查8例,磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)7例,同时行CT及MR检查3例。胸部CT检查3例。头颈部CT检查3例。
CT检查采用GE Discovery CT750 HD扫描仪,管电压120 kV、管电流400 mAs,层厚5 mm,螺距1。检查前空腹,患者仰卧位屏气扫描。对比剂为碘海醇,经肘静脉注射,剂量80~100 mL,注射速率3 mL/s。注射对比剂后分别延迟35 s、85 s行动脉期和门静脉期扫描。
磁共振检查采用SIEMENS 3.0T Verio扫描仪,体部相控阵表面线圈,检查前空腹,自由呼吸。对比剂为Gd-DTPA,经肘静脉注射,剂量20 mL,注射速率3 mL/s。MRI序列及参数如下:(1)T1 3D VIBE序列:TR=2.4 ms,TE=2.31 ms,矩阵210×320,FOV 37 cm×37 cm;(2)T2WI抑脂序列:TR=2 000 ms,TE=78 ms,层厚3 mm,层间隔3 mm,矩阵240×320,FOV 33 cm×33 cm;(3)DWI序列:TR=2 245 ms,TE=90 ms,b为50、400、1 000 s/mm2;(4)增强动态3期采取轴位抑脂T1 3D VIBE扫描,屏气扫描。其中动脉期18 s,门脉期50 s,延迟期180 s。
1.3 图像分析由两名具有丰富工作经验的影像医生共同阅片,观察各组织器官受累情况及其影像表现,包括胰腺,胆道系统,肾脏,肝脏,脾脏,消化道,胰周、肠系膜及腹膜后淋巴结,主动脉,肺及纵隔、肺门淋巴结,头颈部腺体、眶周组织、垂体及颈部淋巴结等,观察病变部位、数量、形态、范围、密度及信号、强化方式,随诊对比病灶变化。同时注意与恶性肿瘤、原发性硬化性胆管炎、结节病、干燥综合征等鉴别诊断。
1.4 诊断标准参照IgG4-RD综合诊断标准2011[5],具体包括:(1)临床及影像:累及一个或多个器官的弥漫性/局限性肿大或占位性病变。(2)血液学:血清IgG4≥135 mg/dL。(3)组织病理学:①大量淋巴细胞、浆细胞浸润及纤维化;② IgG4+浆细胞浸润:IgG4+/IgG+ > 40%且IgG4+浆细胞数 > 10个/高倍镜视野。确诊,(1)+(2)+(3);很可能,(1)+(3);可能,(1)+(2)。注意与恶性肿瘤(癌、淋巴瘤等)、相似病变(干燥综合征、原发性硬化性胆管炎、巨淋巴结增生症、继发性腹膜后纤维化、Wegener肉芽肿、结节病、Churg-Strauss综合征)鉴别诊断。对很可能及可能的患者,若符合特异性器官诊断标准(IgG4相关性胰腺炎[6],IgG4相关性肾病[7],IgG4相关性Mikulicz病[8]),即可做出IgG4-RD明确诊断。
2 结果9例均表现为胰腺受累为主,同时合并胰腺外组织器官受累,包括胆管受累(6例)、胆囊受累(4例)、肾脏受累(3例)、肝脏受累(1例)、头颈部腺体受累(3例)、肺组织受累(1例)、淋巴结受累(4例)。
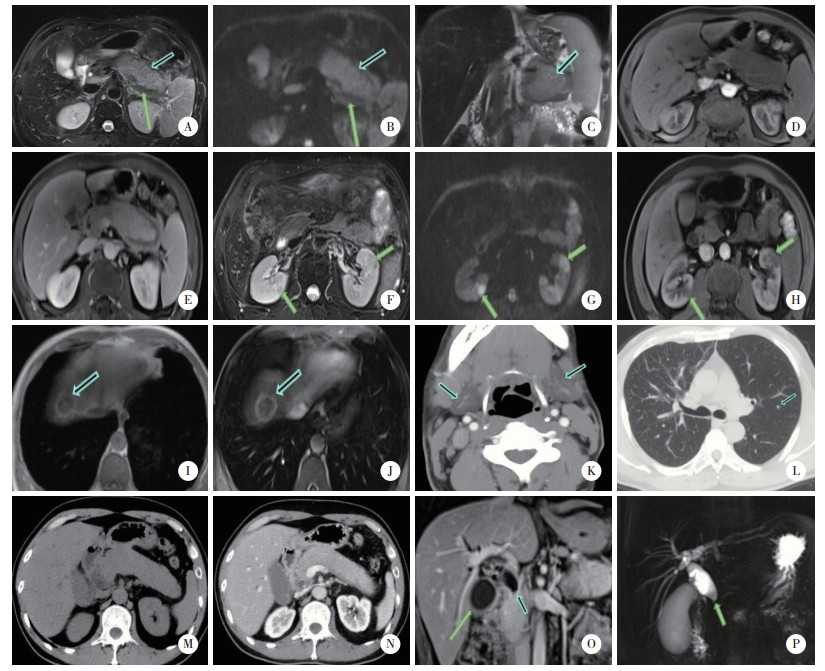
2.1 胰腺受累的影像学特征研究显示,胰腺受累表现:(1)胰腺弥漫性肿大(4例),失去正常“羽毛状”结构,外缘平直呈“腊肠”状;(2)局限性肿大(5例,其中胰头1例,胰体尾部4例),表现为局部呈肿块样改变,类似胰腺癌;(3)远端胰管扩张1例。平扫CT及T1WI病灶呈均匀低密度或低信号,T2WI轻度高信号(图 1A),DWI呈高信号(图 1B),周围脂肪间隙清晰。增强动脉期呈不均质轻度强化(图 1D),至延迟期呈渐进式均匀高度强化(图 1E),6例可见“胶囊状”低密度或低信号环(图 1A、1B)。
|
| A-L,病例1,男,55岁.A-E,胰腺体、尾部局灶性肿大,失去正常“羽毛状”小叶轮廓,呈“腊肠状”. A,横轴位T2WI受累胰腺呈均质轻度高信号;B,DWI病灶呈高信号;A、B可见包膜样结构(短箭头)及“胶囊样”边缘(长箭头);C,胰管穿行于肿胀胰腺内(胰管穿通征);D,增强动脉期呈低灌注;E,增强延迟期呈均匀强化. F-H,肾脏受累,双肾皮质区可见类圆形及花斑状病灶.F,横轴位T2WI双肾病灶呈低信号;G,DWI病灶呈低信号;H,增强动脉期病灶呈低灌注. I、J肝脏受累,肝右叶结节状病灶.I,T1WI病灶呈中心低信号,边缘高信号;J,增强延迟期病灶边缘明显环形强化. K,CT平扫示双侧下颌下腺肿胀;L,CT平扫示双肺间质性改变,左肺上叶小结节(箭头),右肺中叶小叶间隔及小叶间质增厚,支气管血管束增粗. M-P,病例2,男,45岁.M、N,胰腺弥漫性肿胀,增强扫描呈轻度均匀强化;O,增强扫描冠状位示胆囊壁增厚、明显强化(长箭头),胆总管胰腺段呈“猪尾样”狭窄(短箭头),管壁增厚,明显强化;P,MRCP胆道低位梗阻,胆总管下段狭窄. 图 1 典型病例胰腺受累器官组织的影像学特征 |
2.2 胆管、胆囊受累的影像学特征
胆管受累均表现累及胆总管胰腺段,在冠状位CT、MR及MRCP上显示受累胆管壁环形增厚,弥漫性或节段性狭窄,伴上游胆管扩张(图 1P),增强扫描受累胆管壁明显强化(图 1O)。胆囊受累表现为胆囊增大,胆囊壁增厚伴延时强化(图 1O)。
2.3 肾脏受累的影像学特征肾脏受累均为双侧多发病灶,表现为轮廓正常,肾实质结节状、楔形或花斑状病灶,平扫CT呈低密度,T1WI呈低信号,T2WI呈稍低信号(图 1F),DWI呈高信号(图 1G),增强扫描相对正常肾组织呈低灌注(图 1H)。
2.4 肝脏受累的影像学特征肝脏受累表现为肝内单发占位性病变,呈形态规则的类圆形,边界清楚,T1WI边缘见高信号环,中心低信号(图 1I),T2WI呈等信号,DWI呈高信号,增强动脉期病灶明显不均质强化,并持续强化,病灶边缘呈明显环形强化(图 1J)。
2.5 头颈部受累的影像学特征头颈部腺体受累包括颌下腺受累(2例)和泪腺、腮腺及颌下腺受累(1例),表现为腺体弥漫性肿大,平扫CT密度均匀减低(图 1K)。
2.6 肺部受累的影像学特征肺部受累表现为双肺内胸膜下细线样及网状影,支气管血管周围间质增厚,肺内多发圆形磨玻璃结节影(图 1L)。
2.7 淋巴结受累的影像学特征淋巴结受累4例,纵隔淋巴结受累1例,胰周淋巴结受累1例,腹膜后淋巴结受累1例,纵隔、胰周及腹膜后淋巴结同时受累1例,表现为淋巴结轻、中度肿大,密度均匀,未见坏死。
3 讨论IgG4-RD是以血清IgG4升高,大量淋巴细胞和IgG4+浆细胞广泛浸润多组织器官为主要特点的慢性自身免疫性疾病。胰腺是IgG4-RD最常受累器官,最早对IgG4-RD的研究也是来源于对自身免疫性胰腺炎(autoimmune pancreatitis,AIP)的认识[9]。AIP是慢性胰腺炎中的一种特殊类型[10],占慢性胰腺炎2%~11%,临床表现轻微而无特异性,可有轻微腹痛、腹胀,四肢乏力,恶性,厌食等症状,部分患者合并梗阻性黄疸,合并2型糖尿病患者中最高患病率接近70%[11]。
本研究中,9例患者均表现为AIP,胰腺弥漫性肿大4例,局限性肿大5例(胰头1例,胰体尾部4例),远端胰管扩张1例,AIP根据形态学分为3种类型:弥漫型、局灶型、多灶型。弥漫型是最常见类型,表现为胰腺弥漫性肿大、失去正常“羽毛状”小叶轮廓,外缘平直呈“腊肠”状,周围脂肪间隙清晰,增强动脉期呈均匀或不均匀轻度强化,至延迟期呈渐进式均匀明显强化,病变胰腺周围纤维化常可出现增厚的包膜样结构,平扫CT呈等或略低密度,T1WI呈低信号,T2WI呈低信号,DWI呈低信号,动态增强动脉期无强化或轻度强化,出现延时强化[12]。活动性炎症期AIP,在胰腺周围可见“胶囊样”低密度或低信号环,边界清楚,反映病变浸润胰腺表层的脂肪[13]。局灶型AIP常累及胰头,局部形成肿块,胰管不连续显示,上游胰管轻度扩张(< 5 mm),可见胰管走行于病灶内(胰管穿通征),约10%局灶性AIP会误诊为胰腺癌,临床上应注意鉴别。胰腺癌为无包膜缺乏供血实质肿瘤,增强扫描强化程度弱、速度慢,动脉期多表现为不均匀低灌注,与迅速强化正常胰腺实质形成鲜明对比,门脉期强化与动脉期无明显差异[14],病灶处胰管截断,远端胰管扩张程度较AIP重,引起梗阻性黄疸。多灶型AIP相对少见。胰周血管侵犯、包绕及胰腺钙化均少见。
胆道系统也是IgG4-RD常见受累器官,本研究9例患者中,胆管受累6例,胆囊受累4例,表现为与AIP病理基础相似的继发性硬化性胆管炎,最常累及胆总管胰腺段,肝内、外胆管均可受累[15]。主要症状为腹痛及梗阻性黄疸。影像表现为胆管壁均匀环形增厚,增强扫描明显强化。注意与胰腺癌、胆管癌引起的截断性胰胆管狭窄,伴上游胰胆管全程明显扩张鉴别,IgG4-RD胆管炎常见胆管“猪尾样”渐进性狭窄,胰胆管扩张程度较轻。胆囊受累时胆囊增大,囊壁弥漫性增厚伴延时强化。
肾脏受累多为双侧,也可单侧受累,临床症状不明显,可出现肾功能受损。本研究9例患者中肾脏受累3例,影像表现为肾脏轮廓正常或肿胀,肾周可见软组织密度环(类似AIP胰腺周围“胶囊样”包壳),皮质区可见类圆形、楔形结节或弥漫性花斑状病灶,平扫CT呈稍低密度,T1WI呈等信号,由于细胞排列致密伴纤维化,T2WI呈低信号,DWI呈高信号[16-17],动态增强呈渐进式延时强化。肾盂受累时可见肾盂内边界不清软组织密度影,肾盂壁弥漫增厚。
肝脏受累常表现为肝内单发或多发的炎性假瘤,单发较常见,影像表现为平扫CT呈稍低密度,T1WI呈低信号,T2WI呈等或稍高信号,DWI呈高信号,动态增强静脉期呈不均匀强化,相对肝实质呈高强化,延迟期边缘呈明显环形强化[18]。本研究中1例IgG4-RD患者发现肝脏占位,虽肝脏病灶未行病理组织学检查,结合患者临床表现,实验室检查及多器官受累,且肝脏病灶符合炎性假瘤的影像学表现,高度怀疑IgG4-RD肝脏受累,经临床诊治后复查肝脏病灶缩小。
头颈部器官受累常见部位颌下腺、腮腺、泪腺、眶周组织、甲状腺及垂体[19]。主要症状为腺体分泌功能及感觉功能障碍。本研究9例患者中颌下腺受累2例和泪腺、腮腺及颌下腺受累1例,影像表现为受累腺体、垂体弥漫性肿胀,边界清晰,平扫CT呈均匀性密度减低,T2WI呈低信号,动态增强呈均匀渐进式延时强化。
本研究9例患者中表现为肺组织受累1例,纵隔淋巴结肿大2例。肺部受累常见影像表现为肺间质性改变,包括小叶间隔及小叶间质增厚,伴有蜂窝样变、支气管扩张和弥漫性磨玻璃影,支气管血管周围间质增厚;其他影像表现包括实性结节和胸膜结节等[20-21]。可合并肺门及纵隔淋巴结增大。
本研究9例患者中淋巴结受累4例,纵隔淋巴结受累1例,胰周淋巴结受累1例,腹膜后淋巴结受累1例,纵隔、胰周及腹膜后淋巴结同时受累1例。淋巴结受累常发生于纵隔、肺门、腹膜后、胰周、肠系膜及颈部,表现为淋巴结轻、中度肿大,密度较均匀。
本组病例中未见腹膜后间隙受累患者,腹膜后间隙也是常见受累部位,约10%~20%患者可出现继发性腹膜后纤维化[16],一般表现为腹膜后慢性炎症性纤维化,常伴有其他部位病变,影像表现为腹膜后软组织密度或信号肿块,常包绕腹主动脉及下腔静脉,包绕输尿管可引起肾积水[22]。
综上所述,IgG4-RD累及全身多组织器官,不同组织器官临床表现呈多样化。当胰腺出现“腊肠”样改变、“胶囊”样包壳、延时强化等特征性影像学表现时要注意观察胰腺外器官。影像学检查在IgG4-RD诊断、鉴别诊断及对激素治疗后的评估中都发挥着重要的作用,但本研究样本量较小,期望今后增加样本量,对IgG4-RD影像学特征进行深入、全面的研究。
| [1] |
STONE JH, KHOSROSHAHI A, DESHPANDE V, et al. Recommendations for the nomenclature of IgG4-related disease and its individual organ system manifestations[J]. Arthritis Rheum, 2012, 64(10): 3061-3067. DOI:10.1002/art.34593 |
| [2] |
KAMISAWA T. IgG4-positive plasma cells specifically infiltrate various organs in autoimmune pancreatitis[J]. Pancreas, 2004, 29(2): 167-168. |
| [3] |
STONE JH, ZEN Y, DESHPANDE V. IgG4-related disease[J]. N Engl J Med, 2012, 366(6): 539-551. DOI:10.1056/nejmra1104650 |
| [4] |
OTSUKI M, CHUNG JB, OKAZAKI K, et al. Asian diagnostic criteria for autoimmune pancreatitis:consensus of the Japan-Korea symposium on autoimmune pancreatitis[J]. J Gastroenterol, 2008, 43(6): 403-408. DOI:10.1007/s00535-008-2205-6 |
| [5] |
UMEHARA H, OKAZAKI K, MASAKI Y, et al. Comprehensive diagnostic criteria for IgG4-related disease (IgG4-RD), 2011[J]. Mod Rheumatol, 2012, 22(1): 21-30. DOI:10.1007/s10165-011-0571-z |
| [6] |
SHIMOSEGAWA T, CHARI ST, FRULLONI L, et al. International consensus diagnostic criteria for autoimmune pancreatitis:guidelines of the international association of pancreatology[J]. Pancreas, 2011, 40(3): 352-358. DOI:10.1097/MPA.0b013e3182142fd2 |
| [7] |
KAWANO M, SAEKI T, NAKASHIMA H, et al. Proposal for diagnostic criteria for IgG4-related kidney disease[J]. Clin Exp Nephrol, 2011, 15(5): 615-626. DOI:10.1007/s10157-011-0521-2 |
| [8] |
MASAKI Y, SUGAI S, UMEHARA H. IgG4-related diseases including Mikulicz's disease and sclerosing pancreatitis:diagnostic insights[J]. J Rheumatol, 2010, 37(7): 1380-1385. DOI:10.3899/jrheum.091153 |
| [9] |
KAMISAWA T, FUNATA N, HAYASHI Y, et al. A new clinicopathological entity of IgG4-related autoimmune disease[J]. J Gastroenterol, 2003, 38(10): 982-984. DOI:10.1007/s00535-003-1175-y |
| [10] |
KIM KP, KIM MH, KIM JC, et al. Diagnostic criteria for autoimmune chronic pancreatitis revisited[J]. World J Gastroenterol, 2006, 12(16): 2487-2496. DOI:10.3748/wjg.v12.i16.2487 |
| [11] |
刘一帆, 蒋瑾, 张静, 等. 新定义IgG4相关疾病影像学表现与临床诊断新观念[J]. 实用医院临床杂志, 2015, 12(2): 160-162. DOI:10.3969/j.issn.1672-6170.2015.02.061 |
| [12] |
杨正汉, 张骏, 何淑蓉, 等. 自身免疫性胰腺炎的影像特征[J]. 中华放射学杂志, 2007, 41(1): 47-50. DOI:10.3760/j.issn:1005-1201.2007.01.014 |
| [13] |
程瑾, 孙燕萍, 刘慧君, 等. 自身免疫性胰腺炎(附5例报告)[J]. 医学影像学杂志, 2009, 19(12): 1569-1573. DOI:10.3969/j.issn.1006-9011.2009.12.019 |
| [14] |
田笑, 鹿强, 殷小平, 等. 胰头部肿块型慢性胰腺炎与胰头癌的CT鉴别诊断[J]. 中国临床医学影像杂志, 2010, 21(8): 549-552. DOI:10.3969/j.issn.1008-1062.2010.08.006 |
| [15] |
OHARA H, OKAZAKI K, TSUBOUCHI H, et al. Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012[J]. J Hepatobiliary Pancreat Sci, 2012, 19(5): 536-542. DOI:10.1007/s00534-012-0521-y |
| [16] |
VLACHOU PA, KHALILI K, JANG HJ, et al. IgG4-related sclerosing disease:autoimmune pancreatitis and extrapancreatic manifestations[J]. Radiographics, 2011, 31(5): 1379-1402. DOI:10.1148/rg.315105735 |
| [17] |
KIM B, KIM JH, BYUN JH, et al. IgG4-related kidney disease:MRI findings with emphasis on the usefulness of diffusion-weighted imaging[J]. Eur J Radiol, 2014, 83(7): 1057-1062. DOI:10.1016/j.ejrad.2014.03.033 |
| [18] |
章士正. IgG4相关疾病的影像表现[J]. 中华放射学杂志, 2014, 48(11): 881-886. DOI:10.3760/cma.j.issn.1005-1201.2014.11.001 |
| [19] |
FERRY JA, DESHPANDE V. IgG4-related disease in the head and neck[J]. Semin Diagn Pathol, 2012, 29(4): 235-244. DOI:10.1053/j.semdp.2012.07.008 |
| [20] |
SHIGEMITSU H, KOSS MN. IgG4-related interstitial lung disease:a new and evolving concept[J]. Curr Opin Pulm Med, 2009, 15(5): 513-516. DOI:10.1097/MCP.0b013e32832ea509 |
| [21] |
INOUE D, ZEN Y, ABO H, et al. Immunoglobulin G4-related lung disease:CT findings with pathologic correlations[J]. Radiology, 2009, 251(1): 260-270. DOI:10.1148/radiol.2511080965 |
| [22] |
FUJIMORI N, ITO T, IGARASHI H, et al. Retroperitoneal fibrosis associated with immunoglobulin G4-related disease[J]. World J Gastroenterol, 2013, 19(1): 35-41. DOI:10.3748/wjg.v19.i1.35 |
 2019, Vol. 48
2019, Vol. 48