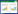文章信息
- 魏松乔, 郭澍, 佟爽, 朱梦茹, 张华, 陈义庆, 崔梦莹
- WEI Songqiao, GUO Shu, TONG Shuang, ZHU Mengru, ZHANG Hua, CHEN Yiqing, CUI Mengying
- 脂肪干细胞-丝素/壳聚糖支架复合物在外泌体诱导下的体外成骨效应
- Osteogenic Effect of Exosomes on Adipose-Derived Stem Cells and Silk Fibroin/Chitosan Scaffold Complexes in vitro
- 中国医科大学学报, 2019, 48(10): 891-895
- Journal of China Medical University, 2019, 48(10): 891-895
-
文章历史
- 收稿日期:2018-10-26
- 网络出版时间:2019-09-27 13:30
骨再生是细胞、血管基质和生长因子共同作用的复杂结果[1]。近年来, 骨组织工程及再生医学的兴起使生物材料及细胞水平的治疗成为骨再生领域中2个主要研究方向[2]。骨组织工程是由合适的种子细胞、可降解的支架材料以及生长因子3个因素构成[3], 用于骨组织工程的种子细胞应具有多向分化潜能且传代性质稳定[4], 人工骨支架的结构和力学性能须优良[5]。除此之外, 影响细胞间信号传递的因子对骨再生也有着至关重要的影响[3]。因此, 在种子细胞与支架良好结合的前提下, 加入既可以促进种子细胞成骨分化又可以通过提高细胞间信号传递从而增强细胞间相互作用的生长因子的治疗手段, 将是一个潜在的新型治疗骨缺损的方法。
研究表明, ADSCs在体外诱导条件下具有向骨细胞、软骨细胞等多向分化的潜能。丝素/壳聚糖复合支架(silk fibroin-chitosan scaffold, SF/CS)具有较低的炎症毒性、良好的生物降解性及骨传导耦合性[6]。外泌体是直径介于30~100 nm、起源于细胞内吞作用的小囊泡, 大部分细胞在生理和病理状态下均可分泌[7], 其内含有多种母细胞来源的生物活性物质[8], 通过这些信息物质可以完成细胞间的信号传递[9]。外泌体中包含的核酸类物质进入胞质后可以被翻译成蛋白质, 而通过在细胞间传递蛋白和RNA, 外泌体可以调节靶细胞及器官的功能和活性[10], 可直接引导间充质干细胞分化进入成骨细胞系。所以, 间充质干细胞来源的外泌体可以被用作引导幼稚干细胞向成骨细胞系分化的生物工具[11]。
本研究通过将外泌体与脂肪干细胞(adiposederived stem cells, ADSCs)-SF/CS复合物共培养, 探究三维条件下人ADSCs在成骨分化的过程中外泌体对其的作用, 并通过探究ADSCs-SF/CS-外泌体复合模式在骨组织再生中的应用潜能, 为后续修复骨缺损的骨组织工程研究提供细胞、生物支架材料和生长因子3个方面的资料。
1 材料与方法 1.1 研究对象与材料脂肪由接受腹部抽脂术的5名25~30岁的健康女性志愿者提供, 志愿者对本研究相关内容知情并签署知情同意书。本研究相关内容和方法均经中国医科大学附属第一医院伦理部门审核并批准, 实验设计方案和伦理问题等均符合要求。
主要试剂:胰蛋白酶、成骨诱导液、普通液态培养基(购自美国Hyclone公司), 青链霉素、抗真菌剂、胎牛血清(购自美国Gibco公司), 蚕丝、氯化钙、醋酸、CCK-8试剂、Triton X-100 (购自美国Sigma公司), BCA蛋白浓度试剂盒、碱性磷酸酶(alkaline phosphatase, ALP)检测试剂盒(购自中国碧云天生物技术公司)。
1.2 方法 1.2.1 ADSCs的培养及体外分化抽脂共获得腹部皮下液状脂肪300 mL, 清洗除去大块纤维组织后, 经胶原酶消化及反复离心弃脂肪组织及上清, 底部沉淀重悬后均匀接种至培养瓶, 置于37 ℃、5% CO2恒定孵箱内, 每3 d换液, 待细胞达80%融合后用胰蛋白酶消化制成细胞悬液, 以1:3的比例进行传代。取长势良好的第3代ADSCs以1×105/孔的浓度接种于6孔板后普通培养基培养, 待细胞达接触抑制3~5 d弃培养基, 分别加入成脂、成骨及成软骨诱导液, 每3 d换液, 直至21 d, 4%多聚甲醛固定漂洗后, 分别用油红O、茜素红及甲苯胺蓝染色镜检。
1.2.2 外泌体的提取及鉴定取长势良好的第3代ADSCs, 普通培养液培养至100%融合后加入成骨诱导液(无外泌体血清、地塞米松磷酸钠、抗坏血酸、磷酸二氢钾)培养, 收集诱导21 d的细胞上清共180 mL, 以4 000 g离心30 min, 弃沉淀留上清; 20 000 g离心60 min, 弃底留上清; 100 000 g离心1 h弃上清, 加入PBS重悬后, 再次以100 000 g离心1 h, 弃上清后可见沉淀, 即为较纯浓度外泌体。透射电镜观察外泌体形态:超速离心提取沉淀以100 μL PBS重悬后, 取20 μL加入4%多聚甲醛固定, 磷酸钨染色后透射电镜下观察拍照。外泌体蛋白定量检测:按照BCA蛋白浓度试剂盒要求操作, 求得外泌体实际浓度并应用Western blotting检测成骨诱导的细胞及所提取外泌体中CD9和CD63标记蛋白, 采用ECL显影。
1.2.3 ADSCs-SF/CS复合物的制备蚕丝脱胶处理后, 经透析、过滤、浓缩制得纯SF蛋白溶液。将CS溶液以质量比5:5加入SF蛋白溶液中, 充分搅拌制得混合溶液, 再次透析后加入24孔板, 真空冷冻干燥机冻干24 h后漂洗, 并再次冻干48 h即可制成。将乙醇浸泡及紫外灯照射灭菌处理的SF/CS浸于细胞培养液24 h后, 将长势良好的第3代ADSCs以1×105/mL的密度均匀接种于支架上(1 mL/个)。支架内部结构观察:SF/CS经处理后在扫描电镜下观察支架材料内部结构和表面形态并拍照。细胞贴附情况观察:细胞接种后分别在培养的不同时间点取出样品, 经处理后扫描电镜下观察细胞形态及细胞与支架的贴附情况。
1.2.4 实验分组将ADSCs-SF/CS复合物分为实验组a (ADSCs-SF/CS+普通培养液+外泌体组)、实验组b (ADSCs-SF/CS+成骨诱导液+外泌体组)、阳性对照组(ADSCs-SF/CS+成骨诱导液组)和阴性对照组(ADSCs-SF/CS+普通诱导液组), 分别进行培养, 每3 d换液, 连续培养14 d。
1.2.5 验证外泌体对ADSCs-SF/CS复合物的成骨效应加入外泌体共培养后, 分别于培养的第1、3、7天取出实验组a及阴性对照组样本, 将细胞洗脱下来制成细胞悬液, 加入CCK-8试剂, 测定ADSCs的增殖情况。培养14 d后, 将各组样本支架上的细胞消化下来并裂解, 应用Western blotting验证成骨相关蛋白Runx2的表达, 并按ALP试剂盒说明将样本与工作液混合, 酶标仪测定405 nm处的吸光度, 从而得出各组样本ALP活性变化。
1.3 统计学分析Western blotting条带结果应用Image J图像分析软件灰度扫描后, 以β-actin为内参进行半定量分析。各组数据均用x±s表示, 采用GraphPad Prism 5.0及SPSS 24.0软件进行统计学分析, ALP活性检测结果采用独立样本t检验进行比较, P<0.05为差异有统计学意义。
2 结果 2.1 ADSCs的生长特性及体外诱导结果倒置显微镜下可见刚传代的脂肪细胞呈圆形或椭圆形悬浮于培养液中, 24 h可全部贴壁, 初期细胞体积较小, 呈纺锤形或梭形; 72 h细胞体积逐渐增大, 呈梭形; 120 h梭形细胞大量增殖, 局部呈平行或漩涡状紧密排列(图 1)。分别用油红O、茜素红及甲苯胺蓝染色, 镜下所见证实ADSCs具有向成熟的脂肪细胞、骨细胞及软骨细胞多向分化的潜能(图 2)。

|
| 图 1 倒置显微镜下可见原代培养5 d后ADSCs增长活跃×100 Fig.1 Image under an inverted microscope:adipocyte growth was active after primary culturing for 5 days ×100 |
|
| A, ADSCs were induced to differentiate into adipocytes (oil red O staining); B, ADSCs were induced to differentiate into osteoblasts (alizarin red staining); C, ADSCs were induced to differentiate into chondrocytes (toluidine blue staining). 图 2 ADSCs向脂肪细胞、成骨细胞、软骨细胞诱导分化21 d ×100 Fig.2 ADSCs were induced to differentiate into adipocytes, osteoblasts, and chondrocytes after being fostered for 21 d ×100 |
2.2 外泌体的形态及鉴定
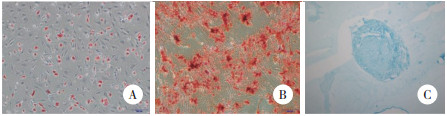
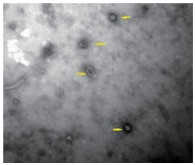
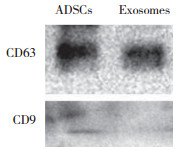
透射电镜下可见外泌体直径介于40~100 nm之间, 为具有明显双层膜结构的圆形杯盘状囊泡(图 3)。应用BCA蛋白浓度试剂盒测得平均每180 mL上清可提取外泌体蛋白浓度约为1.340 μg/μL。Western blotting法以β-actin内参为标准, 可见成骨诱导21 d的ADSCs及提取的外泌体中均有CD9和CD63标记蛋白表达, 进一步证实提取的外泌体来源于成骨分化的ADSCs (图 4)。
|
| 图 3 外泌体透射电镜图×80 000 Fig.3 Exosomes observed under a transmission electron microscope ×80 000 |
|
| 图 4 ADSCs及外泌体的Western blotting检测结果 Fig.4 Western blotting results of ADSCs and exosomes |
2.3 ADSCs-SF/CS复合物在外泌体诱导下的成骨效应 2.3.1 扫描电镜下观察细胞在支架内附着情况
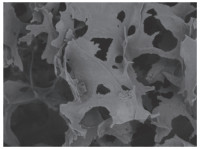
电镜下可见SF/CS材料呈多孔网状结构, 孔隙的走向没有方向性。孔径大小从数十到300 μm不等, 孔与孔之间相连通, 孔隙内壁平滑平整(图 5), 培养1周时支架表面及孔隙中可见ADSCs黏附, 细胞与支架材料紧密黏接, 伪足向各个方向伸展, 细胞周围可见细胞外基质(图 6)。
|
| 图 5 扫描电镜下SF/CS呈多孔网状结构×200 Fig.5 The SF/CS scaffold appears as a porous network structure under scanning electron microscope ×200 |

|
| 图 6 ADSCs可附着于SF/CS表面并生长×1 500 Fig.6 Proliferation of ADSCs attached to the surface of the SF/CS scaffold ×1 500 |
2.3.2 CCK-8法检测细胞增殖
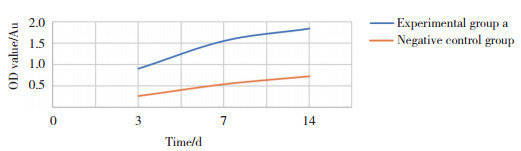
CCK-8法结果显示, 与阴性对照组相比, 实验组a的ADSCs在培养的第1、3、7天增殖能力呈明显的增长趋势(图 7), 表明向培养液中加入外泌体有利于ADSCs的增殖。
|
| 图 7 CCK-8法测量细胞增殖活性 Fig.7 Cell proliferation activity as measured by CCK-8 |
2.3.3 成骨相关蛋白Runx2及ALP活性检测
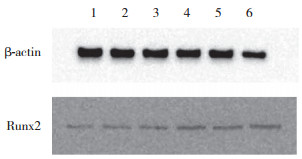
Western blotting法结果发现, 培养14 d时与阳性对照组(0.841 3±0.101 2)相比, 实验组b中成骨相关蛋白Runx2的表达含量(1.587 4±0.090 3)增加(图 8)。此外, 与阴性对照组的ALP活性(0.453 7±0.081 3)相比, 实验组a的ALP活性(2.546 2±0.197 6)显著增高(P<0.01);与阳性对照组的ALP活性相比(1.075 7±0.080 6), 实验组b的ALP活性(3.495 5±0.390 5)也明显增高(P<0.01)。表明外泌体不仅可以诱导ADSCs成骨, 其对ADSCs的成骨还具有促进作用。
|
| 1-3, positive control group; 4-6, experimental group b. 图 8 成骨相关蛋白Runx2的Western blotting检测结果 Fig.8 Western blotting results of Runx2 |
3 讨论
本研究结果显示, ADSCs不仅具有多向分化的潜能, 而且增殖能力强、生物学特性稳定, 所以凭借其来源丰富、获取安全便捷、对供区损伤小等优势, ADSCs可以作为种子细胞为骨组织修复提供充足的时间及原材料。本课题组前期研究[12-13]结果表明, 将SF与CS以质量比5:5的比例共混可制备出功能更加完善的复合支架, 不仅结构更稳定, 多种良好的生物学性能也得以保持。本研究通过扫描电镜观察发现, 人ADSCs与SF/CS复合后, 材料的多孔结构使细胞易于长入, 其平整的表面和适当的孔径可以使细胞在材料表面和孔隙中增殖、分泌细胞外基质, 在相对稳定的培养条件下, 细胞可以在支架上正常的伸展、黏附和生长, 这说明SF/CS对人ADSCs有良好的亲和性和生物相容性。
此外, 本课题组前期研究将提取的外泌体按体积比稀释, 形成不同的浓度梯度, 并在二维条件下与人ADSCs共培养, 以观察其对人ADSCs增殖、矿化的影响。结果证实, 浓度为15 μg/μL的外泌体促进ADSCs增殖、矿化的效果最强, 且随着培养时间的延长, 细胞的增殖越明显。因此, 本研究先将ADSCs种植于SF/CS, 以前期研究结果为准, 在实验组中加入等量(50 μL)浓度为15 μg/μL的外泌体, 在三维环境中观察外泌体对ADSCs成骨分化作用的影响。通过CCK-8法检测细胞的增殖, 并验证成骨相关蛋白Runx2及ALP的活性变化。本研究结果显示, 外泌体可以在体外环境下诱导负载于SF/CS上的人ADSCs向成骨细胞分化, 并且对人ADSCs向成骨细胞分化具有促进作用。
虽然ADSCs的成骨能力在骨组织工程中具有重要的应用潜能, 但仍有一些问题尚未解决, 如ADSCs成骨分化现象的内在分子机制仍需进一步的研究。而且目前关于诱导ADSCs成骨的研究大多是体外及动物实验, 缺少体内研究, 要想将ADSCs作为种子细胞应用于临床骨组织再生, 仍需大量的实验和临床前研究。此外, 本研究制备的复合支架虽基本符合目前骨组织工程的生物材料要求, 种植细胞的结果也表明SF/CS对ADSCs无明显毒性和不良反应, 但其细胞和组织相容性以及在体内的降解情况等仍有待进一步研究。最后, 外泌体虽然在骨组织修复领域有着良好的应用前景, 但同时也存在诸多阻碍其发展的因素, 最主要的挑战就是如何实现大量生产。目前常用的提取方法只能提供少量纯度低的外泌体, 比如5×106个骨髓瘤细胞中只能提取5~6 μg外泌体[14], 且目前常用的2种分离方法——反复超速离心法和反复超滤法的弊端均是时间消耗大。此外, 尽管许多研究表明外泌体可以刺激骨生成和血管再生, 但确切机制仍然模糊不清。因此, 以后的研究必须首先探索出分离和提取外泌体的可靠方法。其次, 需要更好的了解外泌体在调节ADSCs成骨和血管生成方面的作用。最后, 本研究通过向培养基中加入外泌体的方法来添加促进ADSCs成骨的诱导因素, 而后期如何制备具有缓释外泌体效应的支架以用于动物实验, 以及最终制备出可以用于人体的外泌体-ADSCs-SF/CS复合模式, 还有待进一步研究。
| [1] |
FILLINGHAM Y, JACOBS J. Bone grafts and their substitutes[J]. Bone Joint J, 2016, 98-B(1 Suppl A): 6-9. DOI:10.1302/0301-620X.98B.36350 |
| [2] |
LIN KF, HE S, SONG Y, et al. Low-temperature additive manufacturing of biomimic three-dimensional hydroxyapatite/collagen scaffolds for bone regeneration[J]. ACS Appl Mater Interfaces, 2016, 8(11): 6905-6916. DOI:10.1021/acsami.6b00815 |
| [3] |
SHRIVATS AR, MCDERMOTT MC, HOLLINGER JO. Bone tissue engineering:state of the union[J]. Drug Discov Today, 2014, 19(6): 781-786. DOI:10.1016/j.drudis.2014.04.010 |
| [4] |
LIU Z, YUAN X, FERNANDES G, et al. The combination of nano-calcium sulfate/platelet rich plasma gel scaffold with BMP2 gene-modified mesenchymal stem cells promotes bone regeneration in rat critical-sized calvarial defects[J]. Stem Cell Res Ther, 2017, 8(1): 122. DOI:10.1186/s13287-017-0574-6 |
| [5] |
AGARWAL R, GARCÍA AJ. Biomaterial strategies for engineering implants for enhanced osseointegration and bone repair[J]. Adv Drug Deliv Rev, 2015, 94: 53-62. DOI:10.1016/j.addr.2015.03.013 |
| [6] |
ZENG S, LIU L, SHI Y, et al. Characterization of silk fibroin/chitosan 3D porous scaffold and in vitro cytology[J]. PLoS One, 2015, 10(6): e0128658. DOI:10.1371/journal.pone.0128658 |
| [7] |
CHANG YH, WU KC, HARN HJ, et al. Exosomes and stem cells in degenerative disease diagnosis and therapy[J]. Cell Transplant, 2018, 27(3): 349-363. DOI:10.1177/0963689717723636 |
| [8] |
KOWAL J, TKACH M, THÉRY C. Biogenesis and secretion of exosomes[J]. Curr Opin Cell Biol, 2014, 29: 116-125. DOI:10.1016/j.ceb.2014.05.004 |
| [9] |
HESSVIK NP, LLORENTE A. Current knowledge on exosome biogenesis and release[J]. Cell Mol Life Sci, 2018, 75(2): 193-208. DOI:10.1007/s00018-017-2595-9 |
| [10] |
WEBBER JP, SPARY LK, SANDERS AJ, et al. Differentiation of tumour-promoting stromal myofibroblasts by cancer exosomes[J]. Oncogene, 2015, 34(3): 290-302. DOI:10.1038/onc.2013.560 |
| [11] |
NARAYANAN R, HUANG CC, RAVINDRAN S. Hijacking the cellular mail:exosome mediated differentiation of mesenchymal stem cells[J]. Stem Cells Int, 2016, 2016: 3808674. DOI:10.1155/2016/3808674 |
| [12] |
LI DW, LEI X, HE FL, et al. Silk fibroin/chitosan scaffold with tunable properties and low inflammatory response assists the differentiation of bone marrow mesenchymal stem cells[J]. Int J Biol Macromol, 2017, 105(Pt 1): 584-597. DOI:10.1016/j.ijbiomac.2017.07.080 |
| [13] |
TONG S, XU DP, LIU ZM, et al. Construction and in vitro characterization of three-dimensional silk fibroinchitosan scaffolds[J]. Dent Mater J, 2015, 34(4): 475-484. DOI:10.4012/dmj.2014-251 |
| [14] |
BOUDENOT A, ACHIOU Z, PORTIER H. Does running strengthen bone?[J]. Appl Physiol Nutr Metab, 2015, 40(12): 1309-1312. DOI:10.1139/apnm-2015-0265 |
 2019, Vol. 48
2019, Vol. 48