文章信息
- 兰翀, 聂小毳, 史玉林, 徐洪涛
- LAN Chong, NIE Xiaocui, SHI Yulin, XU Hongtao
- TC1和β-连环蛋白在宫颈癌和癌前病变组织中表达的关系和意义
- Expression of TC1 and β-catenin in Cervical Carcinoma and Precancerous Lesions and Their Significance
- 中国医科大学学报, 2019, 48(1): 7-11
- Journal of China Medical University, 2019, 48(1): 7-11
-
文章历史
- 收稿日期:2018-04-19
- 网络出版时间:2019-01-02 08:56
2. 中国医科大学基础医学院病理学教研室, 沈阳 110122
2. Department of Pathology, College of Basic Medical Science, China Medical University, Shenyang 110122, China
宫颈癌是最常见的妇科恶性肿瘤,严重威胁女性的生殖健康。近年的研究表明,宫颈癌发病率呈年轻化趋势。全世界范围内,每年约有50万宫颈癌新发病例。子宫颈上皮内病变是一组与宫颈癌密切相关的癌前病变的总称,反映了宫颈癌发生、发展的连续过程。甲状腺癌相关因子1(thyroid cancer-1,TC1)是近年发现的由C8orf4基因编码的一种核蛋白,首先在甲状腺乳头状癌中发现其表达[1]。作为Wnt信号通路上游调节基因,TC1可以与β-连环蛋白(β-catenin)竞争性结合Chibby,间接增强Wnt信号通路介导的转录作用,从而增强肿瘤细胞侵袭转移能力[2]。另外,TC1还能被有丝分裂素调节,促进细胞从G1向S期转化,加速细胞周期,促进细胞增殖[3]。研究[4-8]表明,TC1在乳腺癌、胃癌、口腔鳞癌、肺癌、卵巢癌等恶性肿瘤中均表达增高,并与肿瘤的恶性表型和进展相关。β-catenin作为一种细胞黏附分子,是Wnt信号通路的核心,能介导细胞黏附和参与Wnt途径的信号传导功能,与结直肠癌[9]、胃癌[10]、肺癌[11]、宫颈癌[12]、恶性黑色素瘤[13]等多种恶性肿瘤的发生、发展和侵袭转移有密切关系。目前,TC1在宫颈癌及癌前病变中的表达情况在国内外均未见报道。本研究采用免疫组化方法检测正常宫颈组织、子宫颈上皮内病变和宫颈鳞癌组织中TC1和β-catenin的表达情况,探讨二者在宫颈鳞癌发生、发展及转移中的作用,并分析它们之间的相关性。
1 材料与方法 1.1 材料 1.1.1病例与标本:收集沈阳市妇婴医院2012年1月至2017年12月病理科存档的宫颈石蜡组织标本共190例。正常宫颈组织30例,患者平均年龄(36.50±9.83)岁(19~63岁)。宫颈上皮内病变组织80例,患者平均年龄(38.15±10.22)岁(23~70岁);其中高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)与低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)各40例。宫颈鳞癌组织80例,患者平均年龄为(39.29±11.12)岁(20~62岁);其中高分化52例,中分化20例,低分化8例;按FIGO 2009年临床分期标准,ⅠA期16例,ⅠB期52例,ⅡA期12例。所有患者术前均未接受放化疗等治疗。所有标本均常规行10%甲醛稀释液(100 mL/L)固定和石蜡制片,切片经2名以上病理医师确诊。
1.1.2试剂:兔抗人TC1多克隆抗体(ab133885)购自美国Abcam公司,鼠抗人β-catenin单克隆抗体(610154)购自美国BD生物技术公司,S-P超敏免疫组化试剂盒(KIT-9710)和DAB酶底物显色试剂盒(DAB-0031)均购自福州迈新生物技术公司。
1.2 方法将石蜡包埋组织标本制成4 μm切片,经二甲苯脱蜡、梯度乙醇脱苯、水化后,进行免疫组化染色,按试剂说明书操作,TC1和β-catenin一抗浓度均为1:200,以PBS取代一抗作为阴性对照。抗原修复液为pH6.0柠檬酸缓冲液。经DAB染色后,苏木素对比染色,中性树胶封片。
结果判定:在400倍镜下选鳞状上皮细胞或癌细胞阳性染色集中区域,每例标本选取5个高倍视野,每个视野计数100个鳞状上皮细胞或癌细胞,计算阳性细胞占计数细胞总数的百分比。TC1的阳性表达定位于细胞质。β-catenin在正常鳞状上皮中为细胞膜表达,当出现细胞质或细胞核表达时为异常表达。TC1和β-catenin均以细胞质内出现棕黄色染色颗粒为阳性表达。计数阳性细胞数 < 25%为低表达;25%~ < 75%为中等表达;≥75%为高表达。
1.3 统计学分析应用SPSS 17.0软件进行统计学分析。采用χ2检验和似然比法分析β-catenin、TC1的表达与子宫颈癌及癌前病变临床病理因素的关系,采用Spearman等级相关分析TC1与β-catenin表达的关系。P < 0.05为差异有统计学意义。
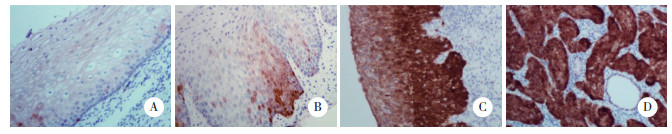
2 结果 2.1 TC1在宫颈鳞癌、上皮内病变和正常宫颈组织中的表达TC1表达定位于细胞质。TC1高表达率和中等表达率在宫颈鳞癌中分别为38.8%(31/80)和31.2%(25/80);在宫颈HSIL组织中分别为32.5%(13/40)和35.0%(14/40);在宫颈LSIL组织中分别为15.0%(6/40)和30.0%(12/40);在正常宫颈组织中分别为6.7%(2/30)和26.7%(8/30)。见图 1。
|
| A, low expression of TC1 in normal cervical epithelium; B, moderate expression of TC1 in low-grade squamous intraepithelial lesion; C, high TC1 expression in high-grade squamous intraepithelial lesion; D, high TC1 expression in cervical squamous cell carcinoma tissue. 图 1 TC1在宫颈病变和正常宫颈鳞状上皮中的表达 免疫组化S-P法×400 Fig.1 Expression of TC1 in cervical lesions and normal cervical squamous epithelium S-P immunohistochemistry×400 |
TC1在宫颈鳞癌中的表达率显著高于LSIL(P = 0.002)和正常宫颈组织(P < 0.001),而与HSIL组织相比无统计学差异(P = 0.576);TC1在HSIL组织中的表达显著高于LSIL(P < 0.001)和正常宫颈组织(P < 0.001);正常宫颈组织与LSIL组织中TC1的表达无统计学差异(P = 0.458)。见表 1。TC1的表达与宫颈鳞癌的低分化程度(P = 0.005)和高分期(P = 0.004)相关,而与患者年龄无关(P = 0.760)。见表 2。
| Item | n | TC1 expression [n(%)] | Abnormal β-catenin expression [n(%)] | |||||||
| Low | Moderate | High | P | Low | Moderate | High | P | |||
| Age(year) | 0.483 | 0.736 | ||||||||
| ≤39 | 112 | 42(37.5) | 36(32.1) | 34(30.4) | 33(29.5) | 39(34.8) | 40(35.7) | |||
| > 39 | 78 | 31(39.7) | 19(24.4) | 28(35.9) | 20(25.6) | 26(33.4) | 32(41.0) | |||
| Tissue | 0.002 | < 0.001 | ||||||||
| Normal | 30 | 20(66.6) | 8(26.7) | 2(6.7) | 17(56.7) | 11(36.7) | 2(6.6) | |||
| LSIL | 40 | 22(55.0) | 12(30.0) | 6(15.0) | 17(42.5) | 16(40.0) | 7(17.5) | |||
| HSIL | 40 | 13(32.5) | 14(35.0) | 13(32.5) | 7(17.5) | 12(30.0) | 21(52.5) | |||
| CSCC | 80 | 24(30.0) | 25(31.2) | 31(38.8) | 12(15.0) | 26(32.5) | 42(52.5) | |||
| LSIL,low-grade squamous intraepithelial lesion;HSIL,high-grade squamous intraepithelial lesion;CSCC,cervical squamous cell carcinoma. | ||||||||||
| Item | n | TC1 expression | Abnormal β-catenin expression | |||||||
| Low [n(%)] |
Moderate [n(%)] |
High [n(%)] |
P | Low [n(%)] |
Moderate [n(%)] |
High [n(%)] |
P | |||
| Age(year) | 0.760 | 0.778 | ||||||||
| ≤39 | 43 | 14(32.6) | 12(27.9) | 17(39.5) | 7(16.3) | 15(34.9) | 21(48.8) | |||
| > 39 | 37 | 10(27.0) | 13(35.1) | 14(37.8) | 5(13.5) | 11(29.7) | 21(56.8) | |||
| Differentiation | 0.005 | 0.025 | ||||||||
| Well | 52 | 22(42.3) | 16(30.8) | 14(26.9) | 11(21.1) | 20(38.5) | 21(40.4) | |||
| Moderate | 20 | 1(5.0) | 7(35.0) | 12(60.0) | 1(5.0) | 4(20.0) | 15(75.0) | |||
| Poor | 8 | 1(12.5) | 2(25.0) | 5(62.5) | 0(0.0) | 2(25.0) | 6(75.0) | |||
| FIGO stage | 0.004 | 0.001 | ||||||||
| ⅠA | 16 | 10(62.5) | 5(31.3) | 1(6.2) | 6(37.5) | 8(50.0) | 2(12.5) | |||
| ⅠB | 52 | 13(25.0) | 16(30.8) | 23(44.2) | 6(11.5) | 15(28.8) | 31(59.7) | |||
| ⅡA | 12 | 1(8.3) | 4(33.3) | 7(58.4) | 0(0.0) | 3(25.0) | 9(75.0) | |||
2.2 β-catenin在宫颈鳞癌、上皮内病变和正常宫颈组织中的表达
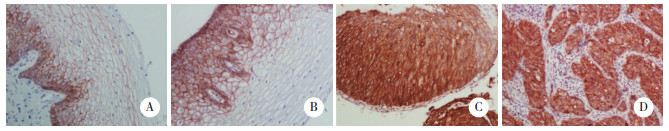
在正常宫颈组织和LSIL组织中,均可见β-catenin的细胞膜表达,少数病例可同时伴有细胞质表达。正常宫颈组织和LSIL组织中β-catenin的阳性表达率无统计学差异(P = 0.295)。β-catenin的细胞质异常高表达率和中等表达率在LSIL组织中分别为17.5%(7/40)和40.0%(16/40);在HSIL组织中分别为52.5%(21/40)和30.0%(12/40);在宫颈鳞癌中分别为52.50%(42/80)和32.5%(26/80)。见图 2。
|
| A, membranous expression of β-catenin in normal cervical epithelium; B, membranous expression of β-catenin in low-grade squamous intraepithelial lesion, and abnormal cytoplasmic expression of β-catenin was also observed in low-grade squamous intraepithelial lesion; C, high expression of β-catenin in high-grade squamous intraepithelial lesion; D, high expression of β-catenin in cervical squamous cell carcinoma tissue. 图 2 β-catenin在宫颈病变和正常宫颈鳞状上皮中的表达 免疫组化S-P法×400 Fig.2 Expression of β-catenin in cervical lesions and normal cervical squamous epithelium S-P immunohistochemistry×400 |
β-catenin在宫颈鳞癌中的异常表达率显著高于LSIL组织(P < 0.001)和正常宫颈组织(P < 0.001),而与HSIL组织相比无统计学差异(P = 0.907)。β-catenin在HSIL组织中的异常表达率显著高于LSIL组织(P = 0.003)和正常宫颈组织(P < 0.001)。见表 1。β-catenin的表达与宫颈鳞癌的低分化程度(P = 0.025)和高分期(P = 0.001)相关,而与患者的年龄无关(P = 0.778)。见表 2。
2.3 TC1在宫颈病变中的表达与β-catenin的异常表达相关Spearman相关分析发现,TC1在宫颈鳞癌中的表达与β-catenin的异常表达呈显著正相关(r = 0.294,P = 0.008)。同样,TC1在宫颈鳞状上皮内病变中的表达也与β-catenin的异常表达呈显著正相关(r = 0.549,P < 0.001)。见表 3。
| Abnormal β-catenin expression | n | TC1 expression | Correlation coefficient | P | ||
| Low | Moderate | High | ||||
| Cervical squamous intraepithelial lesions | 0.549 | <0.001 | ||||
| Low | 24 | 17 | 3 | 4 | ||
| Moderate | 28 | 9 | 14 | 5 | ||
| High | 28 | 3 | 5 | 20 | ||
| Cervical squamous cell carcinoma | 0.294 | 0.008 | ||||
| Low | 12 | 9 | 0 | 3 | ||
| Moderate | 26 | 8 | 9 | 9 | ||
| High | 42 | 7 | 16 | 19 | ||
3 讨论
子宫颈癌是女性生殖道三大恶性肿瘤之一。目前认为,高危型人类乳头状瘤病毒(human papillomavirus,HPV)持续性感染是宫颈病变发生的元凶,99%以上的宫颈癌与高危型HPV持续感染有关。应该说,宫颈癌的发生是一个缓慢的过程,从高危型HPV感染正常宫颈组织到宫颈上皮内病变,再到宫颈癌一般需要数年的时间。虽然病因明确,但子宫颈癌发生发展的分子机制目前尚不清楚,Wnt信号传导通路的激活可能在宫颈癌的恶性转化过程中发挥了重要作用[14]。在宫颈癌形成过程中,Wnt通道中上游信号激活与β-catenin异常聚集是肿瘤形成过程中的关键两点。β-catenin一方面与钙黏蛋白结合形成复合体,维持细胞黏附功能。另一方面作为Wnt信号关键蛋白,其在胞质内的浓度直接影响Wnt信号通路的开放或关闭。本研究发现,在正常宫颈组织及LSIL组织中,β-catenin普遍呈连续细胞膜表达,β-catenin的异常表达不明显。LSIL组织中,其异常表达稍高于正常宫颈组织,但二者之间差异不明显。相反,在HSIL和宫颈鳞癌组织中,β-catenin异常表达于细胞质中,并显著高于LSIL和正常宫颈组织。同时,β-catenin的异常表达还与宫颈鳞癌的低分化和高分期密切相关。通过以上结果,可以认为β-catenin的异常表达在宫颈癌的发生与发展中,有不可忽视的促进作用。
TC1作为Wnt信号通路上游调节基因,与β-catenin竞争结合Chibby,减轻Chibby对下游靶基因如cyclin D1、MMP-7、c-myc等的抑制作用,从而间接增强Wnt信号通路介导的转录作用,增强肿瘤细胞侵袭转移能力[2]。LAN等[8]发现,TC1在卵巢癌中的高表达与卵巢癌的分型、分化和TNM分期相关,并与β-catenin的异常表达相关。而且TC1的高表达可能通过Wnt信号传导通路促进卵巢癌的恶性进展。本研究发现,TC1在HSIL和宫颈鳞癌组织中的表达率明显高于LSIL和正常宫颈组织,而且TC1的表达与宫颈鳞癌的低分化程度和高分期相关,提示TC1可能与宫颈癌的发生、发展密切相关。同时,本研究在宫颈鳞癌和宫颈上皮内病变中均发现,β-catenin的异常表达与TC1的阳性表达显著正相关,说明二者有协同促进宫颈病变进展的作用。TC1的高表达可能通过上调β-catenin的异常表达提高Wnt信号传导通路活性,进而促进Wnt通路靶基因的表达和宫颈病变的发生与发展。
综上所述,TC1和β-catenin在宫颈鳞癌和HSIL组织中的表达显著高于LSIL和正常宫颈组织;TC1在宫颈鳞癌中的表达与β-catenin的异常表达相关,并与宫颈鳞癌的低分化程度和高分期相关。TC1与β-catenin的异常表达与子宫颈癌的发生、发展过程密切相关,深入研究TC1和Wnt信号通路之间的表达调控可能为宫颈癌的诊断和靶向治疗提供新的线索和思路。
| [1] |
CHUA EL, YOUNG L, WU WM, et al. Cloning of TC1(C8orf4), a novel gene found to be overexpressed in thyroid cancer[J]. Genomics, 2000, 69(3): 342-347. DOI:10.1006/geno.2000.6348 |
| [2] |
JUNG Y, BANG S, CHOI K, et al. TC1(C8orf4) enhances the Wnt/beta-catenin pathway by relieving antagonistic activity of Chibby[J]. Cancer Res, 2006, 66(2): 723-728. DOI:10.1158/0008-5472.CAN-05-3124 |
| [3] |
WANG YD, BIAN GH, LV XY, et al. TC1(C8orf4) is involved in ERK1/2 pathway-regulated G (1)-to S-phase transition[J]. BMB Rep, 2008, 41(10): 733-738. DOI:10.5483/BMBRep.2008.41.10.733 |
| [4] |
YANG ZQ, MOFFA AB, HADDAD R, et al. Transforming properties of TC1 in human breast cancer:interaction with FGFR2 and beta-catenin signaling pathways[J]. Int J Cancer, 2007, 121(6): 1265-1273. DOI:10.1002/ijc.22831 |
| [5] |
KIM B, KOO H, YANG S, et al. TC1(C8orf4) correlates with Wnt/beta-catenin target genes and aggressive biological behavior in gastric cancer[J]. Clin Cancer Res, 2006, 12(11 Pt 1): 3541-3548. DOI:10.1158/1078-0432.CCR-05-2440 |
| [6] |
ZHANG P, CAO HY, BAI LL, et al. The high expression of TC1(C8orf4) was correlated with the expression of β-catenin and cyclin D1 and the progression of squamous cell carcinomas of the tongue[J]. Tumour Biol, 2015, 36(9): 7061-7067. DOI:10.1007/s13277-015-3423-1 |
| [7] |
LEI J, LI W, YANG Y, et al. TC-1 overexpression promotes cell proliferation in human non-small cell lung cancer that can be inhibited by PD173074[J]. PLoS One, 2014, 9(6): e100075. DOI:10.1371/journal.pone.0100075 |
| [8] |
LAN C, NIE XC, YANG LH, et al. Expression of TC1(C8orf4), Atonal homolog 1 and β-catenin is associated with the malignant progression of ovarian carcinomas[J]. Int J Clin Exp Pathol, 2016, 9(3): 3845-3851. |
| [9] |
ASHLEY N. Regulation of intestinal cancer stem cells[J]. Cancer Lett, 2013, 3389(1): 120-126. DOI:10.1016/j.canlet.2012.04.016 |
| [10] |
CAI C, ZHU X. The Wnt/β-catenin pathway regulates self-renewal of cancer stem-like cells in human gastric cancer[J]. Mol Med Rep, 2012, 5(5): 1191-1196. DOI:10.3892/mmr.2012.802 |
| [11] |
LUNDIN A, DRISCOLL B. Lung cancer stem cells:progress and prospects[J]. Cancer Lett, 2013, 338(1): 89-93. DOI:10.1016/j.canlet.2012.08.014 |
| [12] |
LIN YW, TSAO CM, YU PN, et al. SOX1 suppresses cell growth and invasion in cervical cancer[J]. Gynecol Oncol, 2013, 131(1): 174-181. DOI:10.1016/j.ygyno.2013.07.111 |
| [13] |
UZDENSKY AB, DEMYANENKO SV, BIBOV MY. Signal transduction in human cutaneous melanoma and target drugs[J]. Curr Cancer Drug Targets, 2013, 13(8): 843-866. DOI:10.2174/1568009611313080004 |
| [14] |
乔迪, 宋静慧. Wnt/β-catenin信号通路激活与宫颈病变研究新进展[J]. 国际生殖健康/计划生育杂志, 2016, 35(6): 510-514. |
 2019, Vol. 48
2019, Vol. 48