文章信息
- 刘松, 齐放, 赵宇, 陈克研, 张升瑞
- LIU Song, QI Fang, ZHAO Yu, CHEN Keyan, ZHANG Shengrui
- 青蒿琥酯对人结肠癌细胞侵袭转移及TGF-β1/Smad4信号通路表达的影响
- Effects of Artesunate on Invasion and Metastasis of Human Colon Cancer Cells and the TGF-β1/Smad4 Signaling Pathway
- 中国医科大学学报, 2019, 48(1): 34-38
- Journal of China Medical University, 2019, 48(1): 34-38
-
文章历史
- 收稿日期:2018-09-14
- 网络出版时间:2019-01-02 09:21
2. 中国医科大学实验动物部, 沈阳 110122
2. Department of Laboratory Animal Science, China Medical University, Shenyang 110122, China
结肠癌是严重威胁人类健康的恶性肿瘤之一,发病率在全球恶性肿瘤中排名第二位,随着我国人民生活习惯和饮食习惯的改变,结肠癌的发病率逐年上升[1]。转化生长因子β1(transforming growth factor β1,TGF-β1)是一种多功能的细胞因子,在晚期结肠癌中可以通过TGF-β1诱导肿瘤细胞发生上皮间质细胞转化,促进肿瘤的恶性侵袭和转移[2]。青蒿琥酯(artesunate,ART)是青蒿素的水溶性衍生物,具有抗疟疾和抗肿瘤活性[3]。有研究[4]表明,ART不仅可以抑制肿瘤生长,还能抑制肿瘤细胞的增殖,减少肿瘤的转移,但调节结肠癌细胞侵袭转移的具体机制尚不清楚。本研究旨在探讨ART对结肠癌细胞SW480增殖的影响以及通过TGF-β1/Smad通路调控结肠癌细胞侵袭转移能力的机制,为结肠癌的预防和治疗提供理论依据。
1 材料与方法 1.1 材料人结肠癌细胞SW480细胞株、人正常结肠细胞系CCD-18Co(上海细胞库),BALA/C无胸腺裸鼠(SPF级,4~6周,18~24 g,雄性,购自北京维通利华维通利华动物科技有限公司,并在特定的无病原体条件下饲养),ART(沈阳实德药业有限公司),DMEM培养基(美国Gibco公司),TGF-β1抑制剂Disitertide(美国MCE公司,HY-P0118),TGF-β1抗体(美国Abcam公司,ab92486),Smad4抗体(美国Abcam公司,ab110175)。
1.2 方法 1.2.1细胞培养:SW480和CCD-18Co细胞株均采用DMEM培养基(含10%胎牛血清,100 U/mL青、链霉素),在37 ℃、5% CO2、饱和湿度的条件下传代培养,细胞状态较好时用于实验研究。
1.2.2实验分组与处理:取对数生长期的SW480和CCD-18Co细胞,用细胞培养基配成单细胞悬液并计数,无菌条件下将细胞接种于96孔培养板(100 μL/孔),接种细胞数为(3×l03~5×l03)/孔,接种细胞培养24 h。分别分为正常结肠细胞CCD-18Co(CON组)、结肠癌细胞SW480(SW组)、结肠癌细胞SW480加入20 μg/mL ART(SWA组)、结肠癌细胞SW480加入20 μg/mL ART和10 ng/mLTGF-β1抑制剂Disitertide(SAD组)。
1.2.3CCK8法检测细胞增殖能力:将各组细胞处理48 h后,每个孔加入10 μL CCK8,37 ℃、5% CO2继续恒温培养2~4 h。酶标测仪检测(选择450 nm波长测定各孔的吸光度)。
1.2.4荷瘤小鼠模型建立、分组及给药:取对数生长期的结肠癌细胞SW480,利用胰酶消化后离心收集,在计数后重悬于无血清DMEM培养基中,生理盐水调整细胞浓度,每只BALB/C裸鼠接种0.2 mL(含5×106个细胞)。给药过程严格遵从无菌操作步骤,避免漏液与感染。将肿瘤体积≈100 mm3的小鼠(肿瘤接种后2周)随机分为SW组、SWA组,每组3只。SWA组每日灌胃ART 0.2 mL(100 mg/kg),每天定时观察裸鼠精神状态、活动、饮食等一般情况。
1.2.5肿瘤体积及质量测定:从给药当天开始每隔3 d用游标卡尺测量移植瘤的长径(a)及与之垂直的短径(b),计算肿瘤体积(V=a×b2/2),绘制移植瘤的生长曲线。治疗结束后次日,颈椎脱臼处死裸鼠,完整剥离肿瘤组织,称取瘤质量,并计算抑瘤率。抑瘤率=(对照组平均瘤质量-给药组平均瘤质量)/模型组平均瘤质量。
1.2.6Transwell检测细胞侵袭转移能力:铺Matrigel胶制作人工基底膜,收集细胞,将细胞悬液密度调整为2.5×105/mL,上室中加入各组细胞总体积为0.5 mL,下室中加入0.75 mL含10%胎牛血清的DMEM培养基。在37 ℃的培养箱中继续培养48 h后HE染色,200倍光镜下随机选择3个视野,计数穿过人工基底膜的细胞数,计算其平均值。
1.2.7流式细胞学检测细胞凋亡:将各组细胞5×104/mL接种于6孔板中,培养48 h后取出,用0.1%胰酶消化离心,加入PBS,离心去上清液,4 ℃条件下70%乙醇固定l h,PBS洗2次,加RNA酶置于37 ℃水浴30 min后,加入等体积的PI染液混合去除杂质,放入流式细胞仪检测,分析各组细胞凋亡比例。
1.2.8Western blotting检测TGF-β1、Smad4蛋白表达:加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min,离心后取上清,BCA法测定蛋白浓度,进行SDS-PAGE电泳、转膜;加脱脂乳封闭2 h,去封闭液,分别加入稀释好的TGF-β1抗体,Smad4抗体,4 ℃环境过夜,TBST洗涤3次,加入二抗,室温放置2 h,使用ECL发光试剂盒显色,凝胶成像系统拍照,分析灰度值。
1.2.9qRT-PCR检测TGF-β1、Smad4 mRNA:将各组细胞取出,加入TRIZOL,静置混匀后,提取RNA,设计qRT-PCR反应引物,TGF-β1(F,5’-CCCCATACCAGAACCTCGAAC-3’;R,5’-TTCTTGGGTTGGGTCGTTGTA-3’),Smad4(F,5’-GAGAACTTTGCCGTTGAAGC-3’;R,5’-CTCAATGTCAAGGGCCATCT-3’),配伍反应体系,cDNA模板2 μL,SYBR Premix Ex Taq(2×)10 μL,PCR Forward Primer(10 μmol/L)0.4 μL,PCR Reverse Primer(10 μmol/L)0.4 μL,ROX Reference DyeⅡ(50×)0.4 μL,dH2O 6.8 μL。将其加入荧光定量PCR仪中,设置反应条件:预变性95 ℃ 1 min;变性95 ℃ 15 s;退火60 ℃ 40 s;延伸72 ℃ 15 s;40个循环,并在反应结束时进行熔解曲线分析。
1.3 统计学分析采用SPSS 19.0软件进行统计分析。计量资料采用x±s表示。2组间比较采用t检验,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 ART对结肠癌SW480细胞增殖及侵袭转移的影响为证实ART对结肠癌SW480细胞增殖具有抑制作用,利用CCK8细胞增殖实验进行检测,结果显示,CON组、SW组、SWA组和SAD组SW480细胞增殖测得OD值分别为0.054±0.002、0.233±0.037、0.085±0.006、0.215±0.029。与CON组比较,SW组细胞增殖明显增多(P < 0.05);与SW组比较,SWA组细胞增殖能力受到明显抑制(P < 0.05)。而SAD组与SW组比较SW480细胞增殖无统计学差异(P > 0.05)。提示ART对肿瘤细胞增殖的抑制作用与TGF-β1/Smad4信号通路相关。
2.2 ART对结肠癌SW480细胞侵袭转移的影响应用Transwell侵袭实验检测各组结肠癌细胞SW480的侵袭转移能力。结果显示,CON组、SW组、SWA组和SAD组SW480细胞侵袭转移数量分别为12±7.2、135±9.5、22±6.1、121±8.8。与CON组比较,SW组细胞侵袭转移数量明显增加(P < 0.05);与SW组比较,SWA组细胞侵袭转移数量明显减少(P < 0.05),而SAD组与SW组比较细胞的侵袭转移能力无统计学差异(P > 0.05)。见图 1。
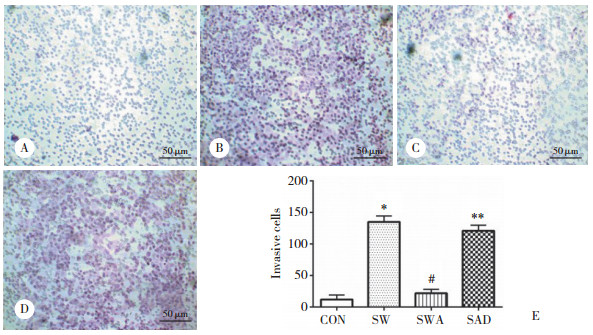
|
| A, CON group; B, SW group; C, SWA group; D, SAD group; E, the numbers of invasive cells.* P < 0.05 compared with CON group; # P < 0.05 compared with SW group; ** P < 0.05 compared with SWA group. 图 1 Transwell侵袭实验结果 Fig.1 Results of the Transwell invasion test |
2.3 ART对移植瘤生长的影响
为探究ART对结肠癌细胞SW480增殖能力的抑制作用,本研究构建了裸鼠移植瘤模型。移植瘤模型建立初期,裸鼠饮食、行为和精神状态均表现正常。给予ART治疗后裸鼠的饮食、行为和精神状态并无明显异常,各组裸鼠移植瘤体积均不同程度增长,其中SW组移植瘤生长迅速,SWA组移植瘤生长相对缓慢。第36天SWA组与SW组比较,肿瘤体积显著减小,差异具有统计学意义(P < 0.05)。表明ART在体内能够显著抑制胃癌耐药细胞裸鼠移植瘤的生长,见图 2、表 1。
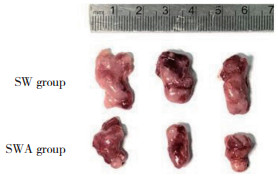
|
| 图 2 ART对裸鼠成瘤的影响(第36天) Fig.2 Effect of artesunate on tumor volume in nude mice at 36 days |
| Group | Tumor volume in nude mice | |||||||
| 15 d | 18 d | 21 d | 24 d | 27 d | 30 d | 33 d | 36 d | |
| SW | 1.192±0.521 | 1.783±0.482 | 2.331±0.514 | 2.867±0.522 | 3.392±0.468 | 3.964±0.531 | 4.483±0.492 | 5.081±0.472 |
| SWA | 0.612±0.362 | 0.953±0.451 | 1.341±0.3531) | 1.636±0.3381) | 2.022±0.3611) | 2.373±0.3521) | 2.721±0.3411) | 3.104±0.3311) |
| 1)P < 0.05 vs SW group. | ||||||||
2.4 ART对结肠癌SW480细胞凋亡的影响
流式细胞仪检测细胞凋亡率,CON组、SW组、SWA组和SAD组SW480细胞凋亡率分别为(4.212±0.514)%、(5.388±0.623)%、(23.472±2.069)%、(5.291±0.610)%。与SW组比较,经ART干预后的SWA组细胞存活率降低,凋亡率显著增加(P < 0.05);SAD组细胞凋亡率较SWA组显著降低(P < 0.05),但与SW组比较无统计学差异(P > 0.05)。
2.5 Western blotting检测TGF-β1、Smad4蛋白表达利用Western blotting检测细胞中TGF-β1、Smad4蛋白的表达情况,与CON组比较,SW组的TGF-β1蛋白表达显著增加,而Smad4蛋白表达则显著降低(P < 0.05);而与SW组比较,SWA组的TGF-β1蛋白表达受到抑制,而Smad4蛋白表达增加(P < 0.05),SAD组TGF-β1蛋白表达显著降低(P < 0.05),Smad4蛋白表达无统计学差异(P > 0.05)。见表 2、图 3。
| Group | TGF-β1 protein | Smad4 protein |
| CON | 0.187±0.053 | 0.803±0.042 |
| SW | 0.798±0.0711) | 0.360±0.0811) |
| SWA | 0.201±0.0622) | 0.719±0.0742) |
| SAD | 0.739±0.0971),3) | 0.195±0.0561),3) |
| 1)P < 0.05 vs CON group;2)P < 0.05 vs SW group;3)P < 0.05 vs SWA group. | ||
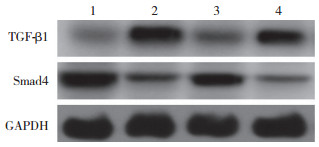
|
| 1, CON group; 2, SW group; 3, SWA group; 4, SAD group. 图 3 各组细胞中TGF-β1、Smad4蛋白的表达 Fig.3 Expression of TGF-β1 and Smad4 proteins in each group of cells |
2.6 qRT-PCR检测TGF-β1、Smad4 mRNA表达
利用qRT-PCR检测TGF-β1、Smad4 mRNA表达情况,结果显示,与CON组比较,SW组TGF-β1 mRNA含量明显增多,而Smad4 mRNA含量明显减少(P < 0.05);而与SW组比较,SWA组TGF-β1 mRNA含量明显减少,而Smad4 mRNA含量增多(P < 0.05);SAD组TGF-β1 mRNA含量显著减少(P < 0.05),Smad4 mRNA含量无统计学差异(P > 0.05)。
| Group | TGF-β1 mRNA | Smad4 mRNA |
| CON | 1.00±0.00 | 1.00±0.00 |
| SW | 3.19±0.121) | 0.59±0.121) |
| SWA | 1.02±0.152) | 0.88±0.112) |
| SAD | 2.77±0.141),3) | 0.32±0.131),3) |
| 1)P < 0.05 vs CON group;2)P < 0.05 vs SW group;3)P < 0.05 vs SWA group. | ||
3 讨论
研究[5]显示,多数结肠癌患者就诊时已至中晚期,早期患者可以接受根治性手术并联合其他药物进行辅助治疗,但仍然有约50%患者术后死于转移以及复发。本研究利用CCK8、构建裸鼠移植瘤模型、Transwell、流式细胞、Western blotting和qRT-PCR等技术观察ART对结肠癌肿瘤生长,细胞增殖、侵袭转移、凋亡及TGF-β1/Smad4通路蛋白和mRNA表达的影响。结果显示ART能够抑制结肠癌肿瘤生长,减轻结肠癌细胞的增殖和侵袭转移能力,诱导细胞凋亡,其机制与TGF-β1/Smad4信号通路有关。
ART是青蒿素衍生物之一,除了具有抗疟疾作用外,在抗肿瘤、心血管疾病及调节免疫系统疾病中也发挥重要作用[6]。有研究[7]证实,ART对结肠癌、肝癌、肺癌和子宫颈癌具有显著抑制作用。为进一步探究ART对结肠癌肿瘤生长的影响,本研究构建了裸鼠移植瘤模型。裸鼠移植瘤实验结果提示ART能抑制结肠癌细胞SW480裸鼠移植瘤生长,具有缩小肿瘤体积作用,效果显著。
研究[8-9]显示,ART通过作用于子宫颈癌细胞使其产生活性氧簇,从而抑制肿瘤细胞增殖,促进细胞凋亡,降低肿瘤血管生成,进而达到抑制肿瘤的目的。ART有可能被开发为新型抗肿瘤药物。TGF-β1/ Smad4信号通路影响肿瘤的发生、发展及转移[10]。有研究证实[2, 11] TGF-β1可以调节细胞生长、分化、迁移以及调亡,TGF-β1通过抑制淋巴管内皮细胞迁移和条索形成,增强大鼠胰腺癌移植瘤的转移。抑癌基因Smad4在TGF-β1/ Smad信号通路中处于重要地位,主要表现在胰腺癌及胃肠道肿瘤[12]。有研究[13]发现近30%结肠癌存在Smad4突变或缺失,并且这种突变与结肠癌的恶性突变及转移有关。本研究发现在结肠癌细胞中TGF-β1表达升高、Smad4表达降低,经ART干预后,TGF-β1表达显著降低、Smad4表达显著升高,在加入TGF-β1的抑制剂后,TGF-β1表达显著降低,同时,Smad4表达也显著降低。这些结果提示ART能抑制结肠癌细胞SW480裸鼠移植瘤生长,并通过抑制肿瘤细胞增殖和侵袭转移促进其对结肠组织的保护作用,其机制是通过调控TGF-β1来调节Smad4表达,进而达到抑制结肠癌细胞侵袭转移的目的。
综上所述,ART能够抑制结肠癌细胞增殖、侵袭和转移,其机制可能与TGF-β1/Smad4信号通路有关。结肠癌细胞的侵袭转移是引起结肠癌患者术后发生转移及复发的主要原因之一,而抑制结肠癌细胞的侵袭转移一直都是临床上急需攻克的难题,本研究为抑制结肠癌的侵袭转移提供了实验理论依据。
| [1] |
MARCO MR, ZHOU L, PATIL S, et al. Consolidation mFOLFOX6 chemotherapy after chemoradiotherapy improves survival in patients with locally advanced rectal cancer:final results of a multicenter phaseⅡtrial[J]. Dis Colon Rectum, 2018, 61(10): 1146-1155. DOI:10.1097/DCR.0000000000001207 |
| [2] |
YANG D, LI L, QIAN S, et al. Evodiamine ameliorates liver fibrosis in rats via TGF-β1/Smad signaling pathway[J]. J Nat Med, 2018, 72(1): 145-154. DOI:10.1007/s11418-017-1122-5 |
| [3] |
CHEN P, GU WL, GONG MZ, et al. Artesunate decreases β-catenin expression, cell proliferation and apoptosis resistance in the MG-63 human osteosarcoma cell line[J]. Cell Physiol Biochem, 2017, 43(5): 1939-1949. DOI:10.1159/000484118 |
| [4] |
LI Y, SU R, XU S, et al. Artesunate prevents rats from the clozapine-induced hepatic steatosis and elevation in plasma triglycerides[J]. Neuropsychiatr Dis Treat, 2017, 13(1): 2477-2487. DOI:10.2147/NDT.S145069 |
| [5] |
朱磊, 赵阳, 韩仕峰, 等. 术前血清CEA和CA19-9水平检测对结肠癌术后早期复发转移的预测价值[J]. 中国普通外科杂志, 2015, 24(8): 1170-1174. DOI:10.3978/j.issn.1005-6947.2015.08.023 |
| [6] |
BAI Z, GUO XH, TANG C, et al. Effects of artesunate on the expressions of insulin-like growth factor-1, osteopontin and C-telopeptides of typeⅡcollagen in a rat model of osteoarthritis[J]. Pharmacology, 2018, 101(1/2): 1-8. DOI:10.1159/000479160 |
| [7] |
PANG Y, MAI Z, WANG B, et al. Artesunate-modified nano-graphene oxide for chemo-photothermal cancer therapy[J]. Oncotarget, 2017, 8(55): 93800-93812. DOI:10.18632/oncotarget.21191 |
| [8] |
WANG L, LIU L, WANG J, et al. Inhibitory effect of artesunate on growth and apoptosis of gastric cancer cells[J]. Arch Med Res, 2017, 48(7): 623-630. DOI:10.1016/j.arcmed.2018.03.004 |
| [9] |
ROH JL, KIM EH, JANG H, et al. Nrf2 inhibition reverses the resistance of cisplatin-resistant head and neck cancer cells to artesunate-induced ferroptosis[J]. Redox Biol, 2017, 11(1): 254-262. DOI:10.1016/j.redox.2016.12.010 |
| [10] |
DU L, LEI Y, CHEN J, et al. Potential ameliorative effects of Qing Ye Dan against cadmium induced prostatic deficits via regulating Nrf-2/HO-1 and TGF-β1/Smad pathways[J]. Cell Physiol Biochem, 2017, 43(4): 1359-1368. DOI:10.1159/000481847 |
| [11] |
RAZA A, GHOSHAL A, CHOCKALINGAM S, et al. Connexin-43 enhances tumor suppressing activity of artesunate via gap junction-dependent as well as independent pathways in human breast cancer cells[J]. Sci Rep, 2017, 7(1): 7580. DOI:10.1038/s41598-017-08058-y |
| [12] |
MEHRVARZ SA, ADVANI S, OVERMAN MJ, et al. Association of SMAD4 mutation with patient demographics, tumor characteristics, and clinical outcomes in colorectal cancer[J]. PLoS One, 2017, 12(3): e0173345. DOI:10.1371/journal.pone.0173345 |
| [13] |
VOORNEVELD PW, REIMERS MS, BASTIAANNET E, et al. Statin use after diagnosis of colon cancer and patient survival[J]. Gastroenterology, 2017, 153(2): 470-479. DOI:10.1053/j.gastro.2017.05.011 |
 2019, Vol. 48
2019, Vol. 48