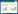文章信息
- 冯颜, 潘秋亚, 项阳, 李静
- FENG Yan, PAN Qiuya, XIANG Yang, LI Jing
- 自身免疫性甲状腺炎血清蛋白质二硫化物异构酶A3抗体的表达
- Expression of Anti-Protein Disulfide Isomerase A3 Antibodies in Patients with Autoimmune Thyroiditis
- 中国医科大学学报, 2019, 48(1): 12-16
- Journal of China Medical University, 2019, 48(1): 12-16
-
文章历史
- 收稿日期:2018-06-28
- 网络出版时间:2019-01-02 09:00
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是内分泌系统最常见的甲状腺炎性疾病,主要以甲状腺淋巴细胞浸润和甲状腺自身抗体阳性为特征,是多种免疫、遗传和环境因素综合作用的结果[1]。近年来的研究[2-4]表明,该病病理损伤并不只局限于甲状腺,肾脏、大脑、肝脏等多组织器官均可受累。AIT病理损伤机制复杂,目前尚无确切定论。
蛋白质二硫化物异构酶A3(protein disulfide isomerase A3,PDIA3)又名ERP57、ER60、GRP58和1,25D3-MARRS,广泛存在于真核生物中,与钙网蛋白(calreticulin,CRT)、钙连接蛋白共同构成内质网分子伴侣复合物,介导蛋白质的折叠与修饰[5]。PDIA3与多种自身免疫性疾病密切相关[6],但目前尚无PDIA3与AIT的相关文献报道。本研究拟探讨血清PDIA3抗体(anti-PDIA3 antibody,PDIA3Ab)总IgG及其各亚型滴度与AIT之间的相互关系,为AIT及其相关疾病提供新的诊断、治疗靶点。
1 材料与方法 1.1 研究对象2013年5月至2015年3月于中国医科大学附属第一医院内分泌门诊及病房随机选取同意参与调查的AIT患者36例作为AIT组,平均年龄(46.31±15.74)岁,男3例,女33例,其中甲状腺功能(以下简称甲功)正常组20例,甲状腺功能减退(以下简称甲减)组16例。另选取年龄与之相匹配的29例非AIT且甲功正常的患者作为对照组。平均年龄(40.48±14.92)岁,男7例,女22例。AIT诊断标准:外周血血清甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)或甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)水平升高,甲状腺彩超示弥漫性低回声,可伴有网格状改变或分布不均匀。2组均否认其他自身免疫性疾病史、恶性肿瘤史、心脑血管疾病史及近期感染史。
1.2 研究方法 1.2.1测定PDIA3Ab总IgG及各亚型滴度:用pH9.6碳酸盐缓冲液将PDIA3重组蛋白(Abcam公司,英国)稀释成10 ng/μL(1︰100)包被酶标板,PDIA3Ab总IgG、IgG1对应的血清稀释倍数是1︰100,IgG2、IgG3、IgG4对应的血清稀释倍数为1︰50,分别以1︰10 000辣根过氧化物酶标记的羊抗人总IgG(Bioss公司,中国)和鼠抗人IgG1、IgG2、IgG3、IgG4(Abcam公司,英国)作为二抗。最后将3,3’,5,5’-四甲基联苯胺作为显色液,用2 mol/L盐酸终止实验,在450 nm下读取吸光度。
1.2.2检测甲功及TPOAb、TgAb:采用E601罗氏电化学发光全自动免疫分析仪测定血清促甲状腺激素(thyrotrophin,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、TPOAb和TgAb水平。TSH、FT3与FT4的正常参考范围分别是0.27~4.2 mIU/L、3.1~6.8 pmol/L和12~22 pmol/L,TPOAb正常参考范围是0~34 IU/L,TgAb正常参考范围是0~115 IU/mL。
1.3 统计学分析采用SPSS22.0软件进行统计分析。计数资料以百分数表示,采用χ2检验和Fisher确切概率法比较组间差异,非正态分布计量资料的组间比较采用Mann Whitney U检验。Spearman检验进行相关性分析。P < 0.05为差异有统计学意义。
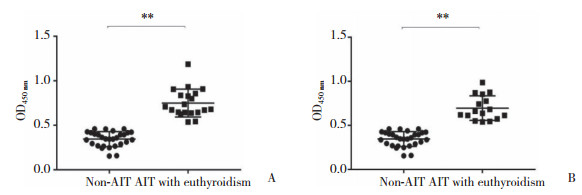
2 结果 2.1 AIT甲功正常组、AIT甲减组与非AIT组患者血清PDIA3Ab滴度比较与非AIT组相比,AIT甲功正常组血清PDIA3Ab总IgG、IgG1和IgG3滴度均显著升高(P < 0.01),IgG2、IgG4滴度无明显变化(P > 0.05);AIT甲减组血清PDIA3Ab总IgG、IgG1和IgG3滴度明显升高,且有统计学差异(P < 0.05),IgG2、IgG4滴度亦无明显变化(P > 0.05),见图 1、2。将对照组PDIA3Ab总IgG、IgG1、IgG3滴度值第97.5百分位数作为各自对应的阳性临界值(分别是0.46、0.27、0.19),AIT甲功正常组和AIT甲减组PDIA3Ab总IgG阳性率分别为95.0%、100%;PDIA3IgG1阳性率分别为70.0%、93.75%,PDIA3AbIgG3阳性率分别为75.0%、62.5%,2组间均无统计学差异(Fisher确切概率法P > 0.05)。
|
| A, AIT patients with euthyroidism; B, AIT patients with hypothyroidism. **P < 0.01 vs non-AIT group. 图 1 AIT患者血清PDIA3Ab总IgG滴度分析 Fig.1 Levels of PDIA3Ab total serum IgG in patients with AIT |
|
| A, IgG1;B, IgG2;C, IgG3;D, IgG4. *P < 0.05, **P < 0.01 vs non-AIT group. 图 2 AIT患者血清PDIA3Ab各亚型滴度分析 Fig.2 Levels of IgG subclasses of PDIA3Ab in sera from patients with AIT |
2.2 AIT甲功正常组、AIT甲减组血清PDIA3Ab滴度比较
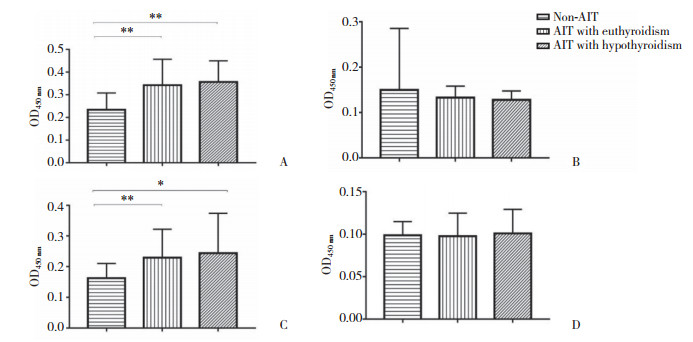
AIT甲功正常组与AIT甲减组血清PDIA3Ab总IgG及各亚型滴度比较,均无统计学差异(P > 0.05),见图 3。
|
| 图 3 AIT甲功正常组、AIT甲减组血清PDIA3Ab的表达比较 Fig.3 The expression of PDIA3Ab total serum IgG and IgG subclasses in AIT with euthyroidism and hypothyroidism group |
2.3 AIT患者血清PDIA3Ab与甲功、TPOAb、TgAb的相关性
AIT甲减组血清PDIA3Ab IgG1亚型滴度与TgAb呈负相关(r = -0.679,P < 0.01),与TPOAb、TSH、FT3、FT4均无关(P > 0.05),排除TPOAb、TgAb影响后,PDIA3AbIgG1亚型滴度与TSH呈正相关(r = 0.550,P < 0.05),与FT3、FT4无明显相关(P > 0.05)。AIT甲功正常组、AIT甲减组血清PDIA3Ab总IgG、IgG3与TPOAb、TgAb、TSH、FT3、FT4无显著相关(P > 0.05)。见表 1。
| Group | anti-PDIA3Ab | TPOAb | TgAb | TSH | FT3 | FT4 | Control variables of TPOAb & TgAb | ||
| TSH | FT3 | FT4 | |||||||
| AIT with euthyroidism(n = 20) | |||||||||
| total IgG | -0.136 | 0.260 | 0.296 | -0.322 | -0.290 | 0.269 | -0.311 | -0.280 | |
| IgG1 | 0.118 | -0.041 | 0.191 | -0.362 | -0.254 | 0.019 | -0.395 | -0.253 | |
| IgG3 | -0.152 | -0.116 | 0.217 | -0.170 | -0.134 | 0.155 | -0.145 | -0.128 | |
| AIT with hypothyroidism(n = 16) | |||||||||
| total IgG | -0.046 | -0.074 | 0.018 | -0.241 | -0.209 | -0.106 | -0.267 | -0.324 | |
| IgG1 | 0.291 | -0.6792) | -0.059 | -0.271 | -0.288 | 0.5501) | -0.316 | -0.371 | |
| IgG3 | -0.137 | -0.026 | -0.291 | 0.262 | -0.018 | -0.245 | 0.090 | -0.175 | |
| 1)P < 0.05,2)P < 0.01,as statistically significant for r. | |||||||||
3 讨论
PDIA3是PDI家族成员之一,是一种多功能蛋白分子伴侣。它能够催化二硫键的形成、还原与异构,有助于蛋白质的合成与折叠。内质网应激时,大量异常结构蛋白蓄积,可继发未折叠蛋白反应维持内质网稳态,此时PDIA3水平明显升高[7]。PDIA3水平上调出现于多种疾病中,在胎膜早破、肠易激综合征、肝细胞性肝癌[8-10]中均有报道。既往研究表明PDIA3Ab在多种自身免疫性疾病中呈高表达。肝肾微粒体抗体1是2型自身免疫性肝炎的诊断学标志物,而LKM-1阳性血清亦能识别PDIA3[11]。FAÉ等[12]研究发现PDIA3是慢性风湿性心脏病患者外周血T细胞和心脏浸润T细胞的靶抗原。ZHENG等[13]则认为PDIA3可能是牛膝总皂苷治疗滑膜型类风湿性关节炎的生物学标志。
本研究首次探讨了PDIA3Ab与AIT之间的关系,发现AIT患者血清PDIA3Ab总IgG、IgG1、IgG3滴度均显著高于非AIT患者,PDIA3Ab总IgG、IgG3滴度均与甲功无关,IgG1亚型滴度与TSH呈正相关,但相关系数仅为0.55,且与FT3、FT4无关。说明PDIA3并不是造成甲功异常的致病抗原,可能与AIT相关病理损伤有关。
PDIA3主要存在于内质网中,免疫刺激可驱使其向细胞膜表面移动,介导PDIA3自身免疫性抗体产生,PDIA3Ab可抑制T细胞活化,与干扰素γ(interferon-γ,IFN-γ)、白细胞介素4(interleukin-4,IL-4)、白细胞介素17(interleukin-17,IL-17)共同调控CD4+T细胞[14]。CAORSI等[15]研究发现,血清PDIA3Ab高表达的结肠癌患者生存率显著高于血清PDIA3Ab阴性患者,且肿瘤浸润T细胞中辅助性T细胞1(helper T cell-1,Th-1)、辅助性T细胞17(helper T cell-17,Th-17)细胞比例明显增加。有研究[16]发现发病的狼疮动物模型小鼠血清PDIA3Ab滴度显著高于未发病组。本研究结果发现,AIT患者血清PDIA3IgG1亚型滴度与TgAb呈负相关,提示PDIA3Ab确实能够抑制CD4+T细胞介导的体液免疫反应,阻止甲状腺滤泡细胞破坏。另外,PDIA3是一种高度保守的分子伴侣蛋白,甲状腺炎症反应时滤泡细胞结构破坏,PDIA3释放,能够诱导自身免疫反应和PDIA3Ab产生。CHIGNARD等[17]研究发现,肝细胞性肝癌患者外周血PDIA3裂解片段与正常人、慢性肝炎患者相比表达明显增加。因此,PDIA3胞外分泌量可能与局部组织病理损伤、凋亡程度密切相关。肿瘤细胞凋亡早期,内质网上的CRT、PDIA3可从细胞内转位至细胞膜表面,细胞膜分子构成改变,免疫原性增强,CRT、PDIA3可作为自身抗原诱导机体免疫应答,产生自身免疫反应[18]。既往研究表明Bax、Bak、caspase-8等凋亡因子可增强PDIA3转位效应[19],介导免疫原性死亡,而Bcl-2、Bax在AIT患者甲状腺滤泡细胞上高表达[20],可能通过促进甲状腺滤泡细胞内PDIA3向细胞膜趋化增强免疫应答。但凋亡因子促进PDIA3转位效应仅在肿瘤细胞中发现,是否对自身免疫性炎症细胞也存在此效应尚需进一步研究。
人体内IgG亚型含量IgG1 > IgG2 > IgG3 > IgG4,IgG1、IgG3激活补体和致抗体依赖细胞介导的细胞毒效应作用最强,IgG2主要参与多糖抗原的应答,IgG4生物活性最低[21-22]。本研究中,AIT组血清PDIA3Ab总IgG、IgG1、IgG3表达增加,AIT甲功正常组、AIT甲减组血清PDIA3Ab及各亚型表达无显著差异。一方面,PDIA3Ab滴度升高可能拮抗T细胞活化[16],另一方面,PDIA3参与主要组织相容性复合物Ⅰ类分子的组装及抗原提呈过程,有助于激活CD8+T细胞发挥细胞毒效应[23]。PDIA3Ab及其亚型可通过补体、体液免疫途径损伤PDIA3表达的靶细胞,但该抗体不是破坏甲状腺的主要抗体,故推测PDIA3Ab可能主要作用于AIT的腺外损害。PDIA3与多种神经系统疾病密切相关。脑组织内β淀粉样蛋白沉积是阿尔兹海默症发病的主要机制之一,正常情况下β淀粉样蛋白与PDIA3、CRT构成复合体在内质网被加工,阿尔兹海默症患者PDIA3水平减低,β淀粉样蛋白不能被正确处理而聚集。薯蓣皂甙元是PDIA3的外源性激活剂,可改善阿尔兹海默症病理损伤[24-25]。脑组织低水平PDIA3还可能与癫痫自发性发作密切相关[26]。笔者推测PDIA3Ab可能在AIT相关大脑损害中发挥重要作用,但并不一定是PDIA3Ab单一作用所致,还需要进一步研究加以佐证。
综上所述,PDIA3可能是AIT发病过程中的一种非经典抗原,其抗体高表达与甲状腺腺外损害有关,检测PDIA3Ab及其亚型水平可能成为AIT患者系统综合诊治的新靶点。但本研究样本量较少,缺少PDIA3与AIT相关脑病的人体或动物模型研究,还需要更大样本量、更深入的研究进行确证。
| [1] |
李玉姝, 单忠艳. 自身免疫性甲状腺疾病的诊断和治疗[J]. 国际内分泌代谢杂志, 2012, 32(3): 155-158. DOI:10.3760/cma.j.issn.1673-4157.2012.03.003 |
| [2] |
KOÇAK G, HUDDAM B, AZAK A, et al. Coexistent findings of renal glomerular disease with Hashimoto's thyroiditis[J]. Clin Endocrinol (Oxf), 2012, 76(5): 759-762. DOI:10.1111/j.1365-2265.2011.04302.x |
| [3] |
KIRSHNER HS. Hashimoto's encephalopathy:a brief review[J]. Curr Neurol Neurosci Rep, 2014, 14(9): 476. DOI:10.1007/s11910-014-0476-2 |
| [4] |
YU H, QIU H, PAN J, et al. Hashimoto's thyroiditis concomitant with sequential autoimmune hepatitis, chorea and polyserositis:a new entity of autoimmune polyendocrine syndrome?[J]. Intern Med, 2013, 52(2): 255-258. DOI:10.2169/internalmedicine.52.6799 |
| [5] |
吕利霞, 汤睿智, 邢万金. PDIA3的结构与功能及其在精卵融合过程中的作用[J]. 生物技术通报, 2010(3): 31-34, 49. DOI:10.13560/j.cnki.biotech.bull.1985.2010.03.005 |
| [6] |
胡玥, 陶丽媛, 吕宾. 蛋白质二硫键异构酶A3——疾病治疗的新靶点[J]. 中国病理生理杂志, 2015, 31(6): 1145-1149. DOI:10.3969/j.issn.1000-4718.2015.06.032 |
| [7] |
YU B, WEN L, XIAO B, et al. Single prolonged stress induces ATF6 alpha-dependent endoplasmic reticulum stress and the apoptotic process in medial frontal cortex neurons[J]. BMC Neurosci, 2014, 15(1): 115. DOI:10.1186/s12868-014-0115-5 |
| [8] |
CHANG A, ZHANG Z, ZHANG L, et al. Proteomic analysis of preterm premature rupture of membranes in placental tissue[J]. Arch Gynecol Obstet, 2013, 288(4): 775-784. DOI:10.1007/s00404-013-2837-5 |
| [9] |
ZHUANG Z, ZHANG L, WANG X, et al. PDIA3 gene induces visceral hypersensitivity in rats with irritable bowel syndrome through the dendritic cell-mediated activation of T cells[J]. Peer J, 2016, 4: e2644. DOI:10.7717/peerj.2644 |
| [10] |
CHEN YY, LIU FC, WU TS, et al. Antrodia cinnamomea inhibits migration in human hepatocellular carcinoma cells:the role of ERp57 and PGK-1[J]. Am J Chin Med, 2015, 43(8): 1671-1696. DOI:10.1142/s0192415x15500950 |
| [11] |
KOMURASAKI R, IMAOKA S, TADA N, et al. LKM-1 sera from autoimmune hepatitis patients that recognize ERp57, carboxylesterase 1 and CYP2D6[J]. Drug Metab Pharmacokinet, 2010, 25(1): 84-92. DOI:10.2133/dmpk.25.84 |
| [12] |
FAÉKC, DIEFENBACH DA SILVA D, BILATE AM, et al. PDIA3, HSPA5 and vimentin, proteins identified by 2-DE in the valvular tissue, are the target antigens of peripheral and heart infiltrating T cells from chronic rheumatic heart disease patients[J]. J Autoimmun, 2008, 31(2): 136-141. DOI:10.1016/j.jaut.2008.04.023 |
| [13] |
ZHENG W, LU X, FU Z, et al. Identification of candidate synovial membrane biomarkers after Achyranthes aspera treatment for rheumatoid arthritis[J]. Biochim Biophys Acta, 2016, 864(3): 308-316. DOI:10.1016/j.bbapap.2015.12.010 |
| [14] |
XU W, YUAN Z, GAO X. Immunoproteomic analysis of the antibody response obtained in mouse following vaccination with a T-cell vaccine[J]. Proteomics, 2011, 11(22): 4368-475. DOI:10.1002/pmic.201100276 |
| [15] |
CAORSI C, NICCOLAI E, CAPELLO M, et al. Protein disulfide isomerase A3-specific Th1 effector cells infiltrate colon cancer tissue of patients with circulating anti-protein disulfide isomerase A3 autoantibodies[J]. Transl Res, 2016, 171: 17-28.e1-2. DOI:10.1016/j.trsl.2015.12.013 |
| [16] |
仲昭岩, 袁志宏, 许文, 等.抗Calreticulin、ERp57、Vimentin自身抗体的免疫调节作用[C]//中国免疫学会第五届全国代表大会暨学术会议. 2006.
|
| [17] |
CHIGNARD N, SHANG S, WANG H, et al. Cleavage of endoplasmic reticulum proteins in hepatocellular carcinoma:detection of generated fragments in patient sera[J]. Gastroenterology, 2006, 130(7): 2010-2022. DOI:10.1053/j.gastro.2006.02.058 |
| [18] |
PANARETAKIS T, JOZA N, MODJTAHEDI N, et al. The co-translocation of ERp57 and calreticulin determines the immunogenicity of cell death[J]. Cell Death Differ, 2008, 15(9): 1499-1509. DOI:10.1038/cdd.2008.67 |
| [19] |
PANARETAKIS T, KEPP O, BROCKMEIER U, et al. Mechanisms of pre-apoptotic calreticulin exposure in immunogenic cell death[J]. EMBO J, 2009, 28(5): 578-590. DOI:10.1038/emboj.2009.1 |
| [20] |
姬秋和, 张雅萍, 张万会, 等. 桥本甲状腺炎中细胞凋亡调节蛋白Bcl-2和Bax的免疫组织化学研究[J]. 中华内分泌代谢杂志, 2001, 17(2): 93-95. DOI:10.3760/j.issn.1000-6699.2001.02.010 |
| [21] |
万芙荣, 程丽英, 索翠萍. IgG亚型检测与疾病的相关研究[J]. 医学检验与临床, 2011, 22(6): 55-56. DOI:10.3969/j.issn.1673-5013.2011.06.022 |
| [22] |
燕宇, 崔昭, 赵明辉. 抗GBM抗体IgG亚型分布及临床意义[J]. 北京大学学报(医学版), 2004, 36(5): 501-504. DOI:10.3321/j.issn.1671-167X.2004.05.012 |
| [23] |
DONG G, WEARSCH PA, PEAPER DR, et al. Insights into MHC class Ⅰ peptide loading from the structure of the tapasin-ERp57 thiol oxidoreductase heterodimer[J]. Immunity, 2009, 30(1): 21-32. DOI:10.1016/j.immuni.2008.10.018 |
| [24] |
COE H, MICHALAK M. ERp57, a multifunctional endoplasmic reticulum resident oxidoreductase[J]. Int J Biochem Cell Biol, 2010, 42(6): 796-799. DOI:10.1016/j.biocel.2010.01.009 |
| [25] |
TOHDA C, URANO T, UMEZAKI M, et al. Diosgenin is an exogenous activator of 1, 25D3-MARRS/Pdia3/ERp57 and improves Alzheimer's disease pathologies in 5XFAD mice[J]. Sci Rep, 2012, 2(1): 535. DOI:10.1038/srep00535 |
| [26] |
SAHIN D, KARADENIZLI S, KASAP M, et al. Decreased ERp57 expression in WAG/Rij Rats thalamus and cortex; possible correlation with absence epilepsy[J]. Protein Pept Lett, 2018, 25(4): 398-404. DOI:10.2174/0929866525666180207101650 |
 2019, Vol. 48
2019, Vol. 48