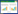文章信息
- 裘敬平, 党军, 蔡峰, 李光
- QIU Jingping, DANG Jun, CAI Feng, LI Guang
- 基于病史、体征、血常规的食管癌预后评分系统的初步构建
- Preliminary Establishment of a Scoring System Based on Medical History, Vital Signs, and Routine Blood Test for Prediction of the Prognosis of Esophageal Cancer
- 中国医科大学学报, 2018, 47(1): 36-41
- Journal of China Medical University, 2018, 47(1): 36-41
-
文章历史
- 收稿日期:2017-09-20
- 网络出版时间:2017-12-20 14:26
食管癌是起病隐匿的恶性肿瘤,多数患者在诊断时已丧失手术时机。对于不可切除的局部晚期食管癌,标准治疗方法是同步放化疗。目前广泛用于临床的美国癌症联合委员会食管癌TNM分期依赖于手术后病理结果,对于不能手术切除的局部晚期食管癌患者,无法准确预测治疗预后以及指导制定个体化治疗方案。2010年我国提出了非手术治疗食管癌的TNM分期标准,但该系统中T分期(病变长度、病变最大层面直径、邻近器官受侵)和N分期标准(淋巴结的长径、短径、位置) [1-2]在临床应用中存在一定困难。如T分期的判断中,由于食管管腔闭合难以判断食管癌受侵范围,食管腔内超声虽然对判断受侵范围更为准确,但对于管腔严重梗阻的患者难以实现[3]。PET/CT虽然对N分期具有较高的敏感度,并且相关的参数变化可以预测预后[4-5],却因为其价格高、设备少,难以普及。本研究拟通过建立简单、易获得的食管癌预后评分系统,作为食管癌TNM分期的补充,协助临床医生制定更准确的食管癌个体化治疗方案。
1 材料与方法 1.1 患者一般情况选择2013年1月至2015年3月间我院收治的初次接受根治性同步放化疗的食管癌患者75例,全部患者经病理学证实为食管鳞状细胞癌(以下简称鳞癌),因病变局部晚期无法手术,且未进行诱导化疗。其中男72例,女3例,中位年龄62岁(48~70岁)。
1.2 方法 1.2.1 治疗方法仰卧位行增强CT定位扫描(层厚5 mm),扫描信息传输至Pinnacle 9.0治疗计划系统。由2名临床医师根据食管钡造影、纤维食管镜检查、增强CT定位扫描图像勾画大体肿瘤体积(gross target volume,GTV)、转移淋巴结大体肿瘤体积(gross target volume of lymph node,GTVnd)以及脊髓和肺等危及器官(organ at risk,OAR);临床靶体积(clinical target volume,CTV)定义为GTV横向外扩0.5 cm、上下外扩2.5 cm及GTVnd横向外扩0.5 cm、上下外扩0.5 cm;计划靶体积(planing target volume,PTV)定义为CTV各方向外扩0.5 cm。采用直线加速器6 MV X线调强放射治疗,PTV处方剂量为60 Gy/30次/6~7周,2 Gy/次,5次/周,95%剂量线包括全部PTV。所有患者均接受1~2个周期同步化疗,化疗方案为顺铂+氟尿嘧啶静滴或卡培他滨口服。
1.2.2 观察指标治疗前询问患者病史并记录以下内容:体质量下降 > 5%、进食困难、返黏液、饮水呛咳、音哑、胸痛、咳嗽、吸烟、饮酒、不良饮食习惯(硬食、热食、进食速度快)、家族肿瘤史。在治疗前及治疗结束时化验血常规、肝功能、肾功能。观察接受同步放化疗食管癌患者总生存时间,总生存时间定义为放疗开始时间至死亡时间。
1.3 统计学分析数据采用SPSS 17.0软件进行统计学分析,计量资料采用配对t检验进行比较;计数资料采用行×列表的χ2检验或Fisher精确检验,生存分析采用Kaplan-Meier法,采用Log-rank法进行单因素预后分析,采用Cox回归模型进行多因素预后分析。检验水平α=0.05。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)评估预测模型的预测效能,采用Hosmer-Lemeshow拟合优度检验拟合度。
2 结果 2.1 患者总生存情况本研究随访截至2016年4月,随访时间30~861 d (中位随访时间356 d),全部患者随访满1年。失访2例,随访率97.3%。全组患者1年生存率61.9%,2年生存率42.4%,生存曲线见图 1。
|
| 图 1 全组患者的总生存曲线 Fig.1 Overall survival of all the patients |
2.2 治疗后血常规及血生化指标变化
比较治疗前及治疗结束时血常规及肝、肾功能化验指标是否存在差异,结果发现白细胞、中性粒细胞、淋巴细胞、血红蛋白、血小板计数、总蛋白、白蛋白、肌酐水平显著下降,见表 1。
| Indicator | n | Before radiochemotherapy | After radiochemotherapy | Difference | t | P |
| WBC | 66 | 6.66±1.82 | 4.68±2.75 | 1.98±2.99 | 5.37 | < 0.01 |
| N | 66 | 4.90±4.65 | 3.52±2.58 | 1.37±5.13 | 2.18 | 0.03 |
| Ly | 66 | 1.63±0.61 | 0.68±0.77 | 0.95±0.83 | 9.34 | < 0.01 |
| Hb | 66 | 135.50±23.16 | 127.04±24.29 | 8.46±26.96 | 2.55 | 0.01 |
| PLT | 66 | 217.45±63.33 | 157.03±56.98 | 60.42±58.20 | 8.44 | 0.00 |
| ALT | 60 | 15.33±7.86 | 16.45±15.08 | -1.11±16.02 | -0.54 | 0.59 |
| ALP | 60 | 76.20±18.00 | 76.65±20.11 | -0.45±14.16 | -0.25 | 0.81 |
| AST | 60 | 19.85±14.97 | 18.71±9.35 | 1.14±16.92 | 0.52 | 0.60 |
| GGT | 60 | 37.13±34.08 | 39.33±30.14 | -2.20±25.71 | -0.66 | 0.51 |
| PRO | 60 | 68.31±4.79 | 65.18±9.03 | 3.13±9.04 | 2.69 | 0.01 |
| ALB | 60 | 40.32±3.59 | 38.05±3.58 | 2.27±4.17 | 4.22 | 0.00 |
| Cr | 57 | 70.09±12.14 | 67.57±12.45 | 2.52±8.10 | 2.35 | 0.02 |
| Urea | 57 | 5.08±1.44 | 5.16±1.63 | -0.08±1.44 | -0.43 | 0.67 |
| CysC | 57 | 1.04±0.29 | 1.03±0.34 | 0.01±0.19 | 0.35 | 0.73 |
| WBC,white blood cell;N,neutrophil;Ly,lymphocyte;Hb,hemoglobin;PLT,platelet;ALT,alanine aminotransferase;ALP,alkaline phosphatase;AST,aspartate aminotransferase;GGT,glutamyltranspeptidase;PRO,protein;ALB,albumin;Cr,creatinine;CysC,cystatin C. | ||||||
2.3 预后相关因素分析
筛选可能与预后相关的因素,进行单因素预后分析。纳入分析的因素:体质量下降 > 5%、进食困难、返黏液、饮水呛咳、音哑、胸痛、咳嗽、吸烟、饮酒、不良饮食习惯、家族肿瘤史以及表 1中筛选出的显著下降的化验指标。按照表 1中化验指标下降程度是否超过均数将数据分为2组;其中淋巴细胞计数下降百分比(%) =治疗前后淋巴细胞计数差值/放疗前淋巴细胞计数,中位数是66%。单因素分析显示体质量下降 > 5%、不良饮食习惯、白细胞显著下降与局部晚期食管鳞癌同步放化疗的预后具有相关性(分别为P = 0.047、0.074、0.074),见表 2。
| Indicator | n | Median survival (d) | χ2 | P |
| Body weight loss > 5% | 3.952 | 0.047 | ||
| No | 37 | 822 | ||
| Yes | 36 | 353 | ||
| Difficulty in eating | 3.817 | 0.282 | ||
| Common food | 38 | 391 | ||
| Soft food | 14 | - | ||
| Semi-flow food | 17 | 729 | ||
| Flow food | 4 | - | ||
| Mucus reflux | 1.101 | 0.294 | ||
| No | 58 | 454 | ||
| Yes | 14 | 729 | ||
| Coughing when drinking | 0.100 | 0.752 | ||
| No | 69 | 614 | ||
| Yes | 4 | 351 | ||
| Hoarseness | 1.041 | 0.308 | ||
| No | 68 | 614 | ||
| Yes | 5 | 349 | ||
| Chest pain | 0.304 | 0.582 | ||
| No | 62 | 529 | ||
| Yes | 11 | - | ||
| Cough | 1.156 | 0.282 | ||
| No | 65 | 729 | ||
| Yes | 8 | 508 | ||
| Smoking | 0.353 | 0.552 | ||
| No | 21 | - | ||
| Yes | 52 | 508 | ||
| Alcohol consumption | 2.331 | 0.127 | ||
| No | 24 | - | ||
| Yes | 49 | 454 | ||
| Poor dietary habit | 3.185 | 0.074 | ||
| No | 46 | 822 | ||
| Yes | 27 | 400 | ||
| Family history of tumor | 1.837 | 0.175 | ||
| No | 60 | 508 | ||
| Yes | 13 | 614 | ||
| Significant reduction in WBC | 3.198 | 0.074 | ||
| No | 34 | - | ||
| Yes | 39 | 406 | ||
| Significant reduction in N | 0.712 | 0.399 | ||
| No | 40 | 729 | ||
| Yes | 33 | 406 | ||
| Significant reduction in Ly | 0.361 | 0.584 | ||
| No | 37 | 454 | ||
| Yes | 36 | 729 | ||
| Percentage of reduced Ly > 66% | 1.487 | 0.223 | ||
| No | 40 | - | ||
| Yes | 33 | 529 | ||
| Significant reduction in Hb | 1.717 | 0.190 | ||
| No | 43 | 822 | ||
| Yes | 30 | 391 | ||
| Significant reduction in PLT | 0.784 | 0.376 | ||
| No | 41 | - | ||
| Yes | 32 | 529 | ||
| Significant reduction in PRO | 0.536 | 0.464 | ||
| No | 48 | 822 | ||
| Yes | 25 | 391 | ||
| Significant reduction in ALB | 0.634 | 0.426 | ||
| No | 50 | 529 | ||
| Yes | 23 | 614 | ||
| Significant reduction in Cr | 0.026 | 0.873 | ||
| No | 40 | 508 | ||
| Yes | 33 | 614 | ||
| Abbreviations as in Tab. 1. | ||||
为了便于临床应用,将WB下降 > 1.98×109/L简化为WB下降 > 2.0×109/L (下文简称WB显著下降),并与体质量下降 > 5%、不良饮食习惯一起共3个因素纳入COX多因素分析。体质量下降 > 5%、不良饮食习惯和WB显著下降的风险比分别为1.857、1.561和1.639,见表 3。
| Indicator | B | SE | Wald | P | HR | 95% CI | |
| Lower | Upper | ||||||
| Body weight loss > 5% | 0.619 | 0.356 | 3.028 | 0.082 | 1.857 | 0.925 | 3.728 |
| Poor dietary habit | 0.445 | 0.358 | 1.545 | 0.214 | 1.561 | 0.773 | 3.152 |
| Significant reduction in WBC (> 2.0×109/L) | 0.494 | 0.366 | 1.818 | 0.178 | 1.639 | 0.799 | 3.361 |
2.4 建立预后预测评分系统
依据回归方程中各变量的偏回归系数,建立预测食管癌同步放化疗死亡风险的评分系统,体质量下降 > 5%、不良饮食习惯、WB显著下降的偏回归系数分别为0.619、0.445、0.494。以0.445~0.494为1.0分,因此体质量下降 > 5%、不良饮食习惯、WB显著下降分别赋值为1.5分、1.0分、1.0分,即评分=1.5×体质量下降 > 5% + 1.0×不良饮食习惯+ 1.0×WB显著下降。
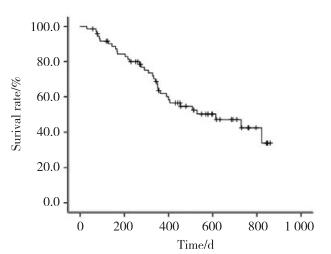
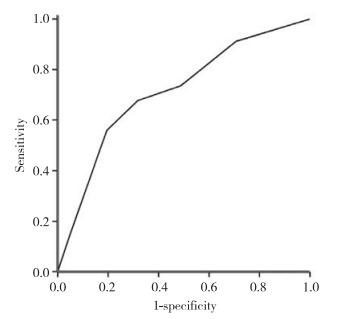
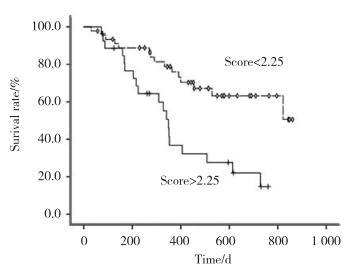
采用ROC评估预测模型的预测效能,曲线下面积=0.712 (95%CI:0.593~0.830),P = 0.002,ROC曲线见图 2。不同临界值的预测效能见表 4,临界值为2.25时,敏感度为0.559,特异度为0.805。以临界值=2.25将全部患者进行分组,预后评分低组(< 2.25)预后显著优于预后评分高组(> 2.25) (P = 0.001),见图 3。Hosmer-Lemeshow拟合优度检验χ2=2.777,P = 0.596,拟合度较高。
|
| 图 2 预后评分系统的预测食管癌患者死亡风险的ROC曲线 Fig.2 ROCcurve of the predictive model |
| Cutoff value | Sensitivity | Specificity | Youden index |
| -1.000 | 1.000 | 0.000 | 1.000 |
| 0.500 | 0.912 | 0.293 | 1.204 |
| 1.250 | 0.735 | 0.512 | 1.247 |
| 1.750 | 0.676 | 0.683 | 1.359 |
| 2.250 | 0.559 | 0.805 | 1.364 |
| 3.000 | 0.147 | 0.951 | 1.098 |
| 4.500 | 0.000 | 1.000 | 1.000 |
|
| 图 3 临界值为2.25时不同预后评分的生存曲线 Fig.3 Kaplan-Meier survival analysis for the patients with a cutoff value of 2.25 |
3 讨论
同步放化疗是不可手术切除的局部晚期食管癌标准治疗手段,非手术治疗食管癌的TNM分期不但存在争议,而且复杂。简单、易获得的食管癌预后指标及评分系统,是协助临床医生更准确、简便制定食管癌个体化同步放化疗方案的关键。
食管癌患者出现体质量下降,多是由于食管癌影响进食及肿瘤消耗造成的营养不良所引起,而营养状态是不可手术食管癌患者的独立预后因素[6]。本研究发现,治疗前体质量下降 > 5%与同步放化疗的预后相关,OR值为1.857 (0.925~3.728),与非洲黑人食管鳞癌患者的统计结果一致[7]。有学者认为食管癌患者的营养状态可以通过体质量指数(body mass index,BMI)进行评价,进一步分析BMI与手术切除的食管鳞癌患者预后的关系,发现患者BMI低时,其总生存期和无病生存期降低[8]。还有学者发现血清白蛋白水平反映了食管癌患者的营养状况,治疗前血清白蛋白水平低的患者T分期相对较晚,且具有较高的术后死亡率和并发症,是重要的预后因素[9]。
吸烟、饮酒等不良饮食习惯不仅参与了食管鳞癌的发生[10-11],本研究还发现,吸烟、饮酒是非手术治疗食管鳞癌患者的不良预后因素。KUANG等[12]在食管癌不良预后因素meta分析中纳入了8项研究共4 286例患者,发现与不吸烟的患者相比,既往吸烟、现在吸烟的患者预后差,风险比分别为1.41、1.35,而且吸烟强度大于15或20包年的重度吸烟者预后更差。而HUANG等[13]在对2 151例食管癌患者的预后分析中发现,未饮酒者的中位生存期和无病生存期较饮酒者显著延长(42个月和27个月,1.22;33个月和22个月,1.16)。吸烟、饮酒造成食管鳞癌不良预后的机制包括:(1)吸烟与p53、p21的过表达相关,从而影响食管鳞癌预后[14];(2)吸烟通过PI3K/Akt/mTOR信号通路降低肿瘤化疗敏感性[15];(3)吸烟、饮酒可影响氟尿嘧啶相关代谢酶的活性,降低化疗药物的疗效[16];(4)吸烟可造成肿瘤乏氧,降低肿瘤对放疗、化疗的敏感性[17]。
WB下降是恶性肿瘤放化疗常见的不良反应。FENG等[18]分析了307例接受手术的食管鳞癌患者,发现术前淋巴细胞减少是食管鳞癌的独立预后因素,危险比为1.579。KOU等[19]分析了215例不可手术而接受一线化疗的转移性食管鳞癌患者,同样发现治疗前淋巴细胞减少是独立预后因素。本研究发现同步放化疗后食管鳞癌患者WB显著下降与预后相关,但淋巴细胞计数及下降程度均与食管鳞癌同步放化疗预后无关。其原因在于虽然治疗前淋巴细胞减少会导致机体对肿瘤细胞免疫杀伤效应降低,但放、化疗诱导的肿瘤细胞死亡可激活抗肿瘤免疫应答[20]。因此,仅依赖外周血中淋巴细胞计数无法全面评价机体—肿瘤免疫状态,而T细胞亚群、肿瘤组织中浸润的淋巴细胞检测、肿瘤免疫信号通路的靶点检测等方法有可能提供预测食管癌同步放化疗预后的指标。
本研究通过体质量下降 > 5%、不良饮食习惯和WB显著下降3项评分预测食管癌同步放化疗预后,这3个因素反映了食管癌患者的肿瘤负荷、病因、放化疗的不良反应,拓宽了现有预测食管癌治疗预后的思路,并且简单、易用,是一种实用性强的预后评价方法。本研究的目的是对TNM分期作出补充,因此在预后分析中,肿瘤大小、淋巴结情况、转移情况都未纳入本研究范围内,虽然本中心的其他研究发现上述指标与预后相关。
对于局部晚期同步放化疗的食管鳞癌患者,治疗前体质量下降 > 5%、不良饮食习惯及WB显著下降是预后不良因素。根据上述指标建立的非手术治疗食管癌预后评分系统,简单、实用,是对TNM分期的补充,仍需进一步积累病例来验证和完善。
| [1] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.1004-4221.2010.03.001 |
| [2] |
SHUCHAI Z, WEINAN Y, JUAN L, et al. A comparative study of new clinical staging systems for esophageal carcinoma treated with non-surgical therapy[J]. Chin J Radiat Oncol, 2016, 25(2): 109-113. DOI:10.3760/cma.j.issn.1004-4221.2016.02.005 |
| [3] |
MIRINEZHAD SK, JANGJOO AG, SEYEDNEJAD F, et al. Impact of tumor length on survival for patients with resected esophageal cancer[J]. Asian Pac J Cancer Prev, 2014, 15(2): 691-694. DOI:10.7314/APJCP.2014.15.2.691 |
| [4] |
TAMANDL D, GORE RM, FUEGER B, et al. Change in volume parameters induced by neoadjuvant chemotherapy provide accurate prediction of overall survival after resection in patients with oesophageal cancer[J]. Eur Radiol, 2016, 26(2): 311-321. DOI:10.1007/s00330-015-3860-7 |
| [5] |
CHHABRA A, ONG LT, KUK D, et al. Prognostic significance of PET assessment of metabolic response to therapy in oesophageal squamous cell carcinoma[J]. Br J Cancer, 2015, 113(12): 1658-1665. DOI:10.1038/bjc.2015.416 |
| [6] |
GRAY RT, O'DONNELL ME, SCOTT RD, et al. Impact of nutritional factors on survival in patients with inoperable oesophageal cancer undergoing self-expanding metal stent insertion[J]. Eur J Gastroenterol Hepatol, 2011, 23(6): 455-460. DOI:10.1097/MEG.0b013e3283469761 |
| [7] |
DANDARA C, ROBERTSON B, DZOBO K, et al. Patient and tumour characteristics as prognostic markers for oesophageal cancer:a retrospective analysis of a cohort of patients at Groote Schuur Hospital[J]. Eur J Cardiothorac Surg, 2016, 49(2): 629-634. DOI:10.1093/ejcts/ezv135 |
| [8] |
KAMACHI K, OZAWA S, HAYASHI T, et al. Impact of body mass index on postoperative complications and long-term survival in patients with esophageal squamous cell cancer[J]. Dis Esophagus, 2016, 29(3): 229-235. DOI:10.1111/dote.12327 |
| [9] |
WU N, CHEN G, HU H, et al. Low pretherapeutic serum albumin as a risk factor for poor outcome in esophageal squamous cell carcinomas[J]. Nutr Cancer, 2015, 67(3): 481-485. DOI:10.1080/01635581.2015.1004726 |
| [10] |
BOLLSCHWEILER E, SCHRODER W, HOLSCHER AH, et al. Preoperative risk analysis in patients with adenocarcinoma or squamous cell carcinoma of the oesophagus[J]. Br J Surg, 2000, 87(8): 1106-1110. DOI:10.1046/j.1365-2168.2000.01474.x |
| [11] |
OCAMA P, KAGIMU MM, ODIDA M, et al. Factors associated with carcinoma of the oesophagus at Mulago Hospital, Uganda[J]. Afr Health Sci, 2008, 8(2): 80-84. |
| [12] |
KUANG J J, JIANG Z M, CHEN Y X, et al. Smoking exposure and survival of patients with esophagus cancer:a systematic review and meta-analysis[J]. Gastroenterol Res Pract, 2016, 2016: 7682387. DOI:10.1155/2016/7682387 |
| [13] |
HUANG Q, LUO K, YANG H, et al. Impact of alcohol consumption on survival in patients with esophageal carcinoma:a large cohort with long-term follow-up[J]. Cancer Sci, 2014, 105(12): 1638-1646. DOI:10.1111/cas.12552 |
| [14] |
TAGHAVI N, BIRAMIJAMAL F, SOTOUDEH M, et al. Association of p53/p21 expression with cigarette smoking and prognosis in esophageal squamous cell carcinoma patients[J]. World J Gastroenterol, 2010, 16(39): 4958-4967. DOI:10.3748/wjg.v16.i39.4958 |
| [15] |
WANG S, TAKAYAMA K, TANAKA K, et al. Nicotine induces resistance to epidermal growth factor receptor tyrosine kinase inhibitor by alpha1 nicotinic acetylcholine receptor-mediated activation in PC9 cells[J]. J Thorac Oncol, 2013, 8(6): 719-725. DOI:10.1097/JTO.0b013e31828b51d4 |
| [16] |
YAMASHITA T, KATO K, LONG NK, et al. Effects of smoking and alcohol consumption on 5-fluorouracil-related metabolic enzymes in oral squamous cell carcinoma[J]. Mol Clin Oncol, 2014, 2(3): 429-434. DOI:10.3892/mco.2014.267 |
| [17] |
OUYANG PY, SU Z, MAO YP, et al. Prognostic impact of cigarette smoking on the survival of patients with established nasopharyngeal carcinoma[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(12): 2285-2294. DOI:10.1158/1055-9965.epi-13-0546 |
| [18] |
FENG JF, LIU JS, HUANG Y. Lymphopenia predicts poor prognosis in patients with esophageal squamous cell carcinoma[J]. Medicine (Baltimore), 2014, 93(27): e257. DOI:10.1097/md.0000000000000257 |
| [19] |
KOU F, LU Z, LI J, et al. Pretreatment lymphopenia is an easily detectable predictive and prognostic marker in patients with metastatic esophagus squamous cell carcinoma receiving first-line chemotherapy[J]. Cancer Med, 2016, 5(5): 778-786. DOI:10.1002/cam4.638 |
| [20] |
GODET Y, DOSSET M, BORG C, et al. Is preexisting antitumor CD4 T cell response indispensable for the chemotherapy induced immune regression of cancer?[J]. Oncoimmunology, 2012, 1(9): 1617-1619. DOI:10.4161/onci.21513 |
 2018, Vol. 47
2018, Vol. 47