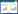文章信息
- 李新鸣, 孙冶, 肖纯凌
- LI Xinming, SUN Ye, XIAO Chunling
- 表达人源SOD的毕赤酵母重组子的构建
- Construction of Recombinant Pichia pastoris Expressing Human SOD
- 中国医科大学学报, 2017, 46(12): 1117-1123
- Journal of China Medical University, 2017, 46(12): 1117-1123
-
文章历史
- 收稿日期:2017-07-06
- 网络出版时间:2017-11-30 18:10
2. 辽宁省环境污染与微生态重点实验室, 沈阳 110034
2. Liaoning Province Key Lab of Environment Pollution and Microecology, Shenyang 110034, China
超氧化物歧化酶(superoxide dismutase,SOD)是一种能够催化有害的超氧化物通过歧化反应转化为氧气和过氧化氢的酶。1938年MANN和KEILIN[1]首次从牛红细胞中分离出一种蓝色的含铜蛋白质,直到1969年Mccord及Fridovich [2]发现该蛋白有发生歧化反应的功能。SOD是生物体内重要的抗氧化酶,广泛分布在动物、植物、微生物等体内。SOD具有特殊的生理活性,是生物体内清除自由基的首要物质,它能够平衡机体的氧自由基,从而避免体内超氧阴离子自由基浓度过高时引起的不良反应[2-3]。现代生活压力、环境污染、各种辐射和超量运动都会造成氧自由基大量形成。现已证实,由氧自由基引发的疾病多达60多种[3-5]。SOD可对抗与阻断氧自由基对细胞造成的损害,及时修复受损细胞,是一种很有用途的药用酶。
SOD根据含金属辅基的不同分为3种:Cu,Zn-SOD,Mn-SOD和Fe-SOD。哺乳类动物体内仅含有Cu,Zn-SOD与Mn-SOD。由于Cu,Zn-SOD的稳定性高于Mn-SOD,并且在哺乳动物中含量远高于Mn-SOD,因此Cu,Zn-SOD在临床应用上更受重视[6-7]。SOD的获得方法有3种:动物血、植物和基因工程菌中提取。从动物血液中可以大规模提取SOD,但是原材料有限,产品质量不稳定,产品活力纯度较低,而且动物源血液制品风险大,容易造成环境污染及安全性问题。从植物提取资源充足,不污染环境,但缺点是提取率较低、耗费大。同时来源于动植物的SOD均存在免疫原性等安全隐患。欧洲已从1999年禁止动物源性SOD用于人类[8]。从基因工程菌中获得重组人源SOD则可以克服上述缺点。美国、日本及一些西欧国家已开发重组人源SOD药物,有的研究已经进行了Ⅱ期和Ⅲ期临床试验[9-10]。我国除开展直接从人血中提取SOD外,近年来也开展重组人源SOD的研究,包括在大肠杆菌、酿酒酵母、昆虫细胞、马铃薯中表达重组SOD [11-13]。现有国内市场上使用的SOD基本是动物血中提取的,而且天然来源的SOD稳定性差。采用基因重组法生产人源SOD不仅可以降低其他来源SOD导致的免疫原性等安全问题,还可以解决人源SOD的来源有限问题。本研究利用基因工程技术,在毕赤酵母(Pichia pastoris,P. pastoris)系统构建表达重组人源SOD,获得纯化、有活性的人源SOD;同时通过优化在P. pastoris培养上清液中大量获得可溶性人源SOD。
1 材料与方法 1.1 主要试剂与仪器超微量紫外可见光分光光度计、轨道式摇床(美国Termo公司);全自动数码凝胶图像分析系统(Tanon 2500R);细菌摇床(苏州威尔公司);Whatman 3 MM滤纸(Whatman公司);硝酸纤维素膜(北京鼎国生物技术发展中心);Wstern blotting试剂盒ECL系统(美国solarbio公司);Rabbit Anti-SOD单克隆抗体(南京凯基生物公司);BMGY培养基(酵母粉1.0 g,蛋白胨2.0 g,YNB培养基1.34 g,0.1 mol/L pH6.0磷酸缓冲液,甘油1.0 mL,加蒸馏水到100 mL YP培养基);YNB培养基、YP琼脂培养基(青岛海博生物公司);琼脂糖和低熔点琼脂糖(南京生兴生物公司);甲醇(沈阳国药集团化学试剂公司);10×CIP缓冲液、酚/氯仿、3 mol/L乙酸钠、100%乙醇、80%乙醇、Geneticin®抗生素、人铜锌SOD(Cu,Zn-SOD)酶联免疫分析(ELISA)试剂盒。P. pastoris X33 /pPICZαA系统。Geneticin®抗生素(美国Gibco公司);人铜锌SOD(Cu,Zn-SOD)酶联免疫分析(ELISA)试剂盒(南京凯基生物公司)。
1.2 P. pastoris系统表达重组人源SOD构建 1.2.1 pPICZa-Cu,Zn-SOD重组质粒构建对照GeneBank查找获得人源Cu,Zn-SOD基因序列,选择酵母菌喜好的密码子,优化人源SOD基因DNA序列,PCR扩增合成可翻译人源Cu,Zn-SOD的基因片段。按照pPICZa载体试剂盒说明,将合成SOD基因片段连接到载体上,并完成pPICZa-Cu,Zn-SOD重组质粒构建及阳性克隆筛选;于-20 ℃保持重组质粒备用。
1.2.2 P. pastoris X33/ pPICZa-Cu,Zn-SOD重组子构建及筛选按照pPICZa载体试剂盒说明,完成pPICZa-Cu,Zn-SOD重组质粒转化,挑选转化菌株提取基因组DNA,PCR特异性扩增SOD基因片段,筛选出整合有SOD基因的P. pastoris X33转化子。提取转化菌株培养上清,Western blotting检测分泌表达可溶性SOD产物的转化菌克隆株,选择分泌表达SOD较高的克隆株保存备用。
1.2.3 P. pastoris重组子稳定性测定将上述筛选获得P. pastoris X33/ pPICZa-Cu,Zn-SOD阳性克隆株培养48 h后,收集培养上清液经Western blotting分析目的蛋白表达,将上述筛选获得的阳性克隆株连续传代30代,每传代10次分别提取基因组DNA,PCR扩增鉴定转化酵母菌株基因组是否稳定整合SOD基因。
1.3 重组人源SOD的纯化及活性检测离子交换柱层析Phenyl-HP Column纯化目的蛋白重组人源SOD。样品,100 mL P.pastoris X33/ pPICZa-SOD阳性克隆培养上清液;平衡缓冲液,20 mmol/L磷酸盐缓冲液(phosphate buffer,PB),3 mol/L(NH4)2SO4,pH 7.4;洗脱液,20 mmol/L PB,2.5 mol/L、2 mol/L、1.5 mol/L、1 mol/L、0.5 mol/L梯度(NH4)2SO4,pH 7.4。纯化产物总SOD经ELISA试剂盒检测。
1.4 P. pastoris系统表达重组人源SOD优化 1.4.1 P. pastoris种子液制备挑取单菌落于装有100 mL BMGY培养基的500 mL三角瓶中,30 ℃、220 r/min离心培养24 h,备用。
1.4.2 不同浓度甲醇下P. pastoris重组子表达SOD活力测定在各重组P. pastoris克隆株分泌表达SOD过程中,分别在其培养液中添加甲醇至终浓度分别为0.5%、1%、2%,于30 ℃、225 r/min离心培养48 h,测定SOD活力。
1.4.3 不同时间各浓度铜离子处理P. pastoris重组子表达SOD活力测定在各重组P. pastoris克隆株分泌表达SOD过程中,分别在其培养液中添加硫酸铜至终浓度分别为0%、0.2%、0.5%、1%,于30 ℃、225r/min离心培养24、48、72 h,测定SOD活力。各培养基于30 ℃ 170 r/min过夜培养至对数期。
1.4.4 P. pastoris重组子表达SOD的Western blotting测定将P. pastoris发酵液上清20 μL与5×样品缓冲液(20 μL+5 μL)在Eppendorf管中混合。放入100 ℃加热5~10 min,提取总蛋白。经SDS-PAGE电泳,转膜,用50 g/L脱脂奶粉封闭1 h后,一抗为鼠抗人SOD抗体,二抗为辣根过氧化物标记的山羊抗鼠抗体(1: 5 000),ECL显色液处理,成像目的条带。
1.5 SOD活力测定 1.5.1 SOD标准曲线测定在酶标包被板上设标准品浓度分别为72、48、24、12、6 U/mL,重复3次,于450 nm波长依序测量各孔的吸光度(optical density,OD)值。
1.5.2 样品SOD活力测定分别设空白孔和待测样品孔。在酶标包被板上待测样品孔中加样品稀释(稀释5倍),37 ℃温育30 min,涤液静置30 s后弃去,如此重复5次,每孔加入酶标试剂50 μL(空白孔除外),温育30 min,加入显色剂A50 μL,加入终止液终止。450 nm波长依序测量各孔OD值。
1.6 统计学分析SOD活力标测定的线性标准曲线建立采用最小二乘法,线性方程检验方法采用线性回归方程的方差分析。不同浓度甲醇诱导下对6株不同重组子P. pastoris表达SOD活力差异采用单因素方差分析,不同时间、不同浓度铜离子处理重组P. pastoris表达SOD活力差异的检验采用重复测量资料的方差分析。检验水准α=0.05。
2 结果 2.1 P. pastoris系统表达重组人源SOD构建选择酵母菌喜好的密码子,优化人源SOD基因DNA序列;完成人SOD基因-pPICZa载体构建及阳性克隆筛选;目前保存有pPICZa-Cu,Zn-SOD重组质粒。完成pPICZa-Cu,Zn-SOD重组质粒转化并整合到P. pastoris X33基因组;筛选获得重组子阳性克隆6株,PCR扩增鉴定转化酵母菌株基因组整合有SOD基因(图 1),保存其中5个整合有SOD基因的重组P. pastoris克隆株。随机挑取3个克隆株,经Western blotting测定表达人源SOD(图 2)。
|
| 1-6, recombinant P. pastoris clones 1-6;M, molecular weight marker; P, positive control; N, P. pastoris X33 strain, negative control. 图 1 PCR扩增鉴定P.Pastoris X33/ pPICZa-Cu,Zn-SOD阳性克隆 Fig.1 Identification of P. pastoris X33/pPICZa-Cu, Zn-SOD-positive clones by PCR amplification |

|
| A, 1-6, recombinant P. pastoris clones 1-6;M, molecular weight marker; N, P. pastoris X33 strain, negative control. B, Con, pure SOD products of control; 1-3, recombinant P. pastoris clone 2, 4 and 5. A, gel with Coomassie blue staining; B, Western blotting. 图 2 P. pastoris X33/ pPICZa-SOD阳性克隆上清中SOD表达 Fig.2 Expression of SOD in culture supernatants of P. pastoris X33/pPICZa-SOD-positive clones |
2.2 P. pastoris重组子稳定性测定
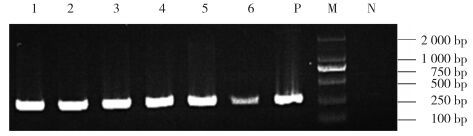
测定2、4、5# 3个克隆,培养传代后是否能维持基因组整合人SOD基因的稳定。在YPD平板上连续传代30代,分别取单菌落,提取酵母菌基因组DNA,PCR均可扩增出人SOD基因片段,测定其DNA序列,证实该3个克隆株能稳定携带SOD基因。见图 3。
|
| M, molecular weight marker; 1-3, recombinant P. pastoris clone 2, 4 and 5;P, positive control. 图 3 P. pastoris重组子稳定性测定 Fig.3 Stable insertion of the SOD gene in P. pastoris recombinants |
2.3 重组人源SOD的纯化及其活性测定
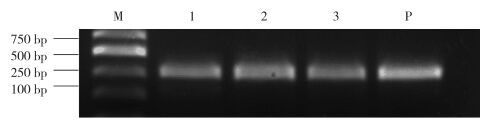
结果显示,有效纯化来自于P. pastoris培养上清液中表达的人源SOD蛋白。纯化的SOD蛋白保持活性,为295 U/mg,洗脱峰的电泳结果见图 4、图 5。
|
| 1, culture supernatant; 2, flow through; 3, 2.5 mol/L(NH4)2SO4 elution-1;4, 2.5 mol/L(NH4)2SO4 elution-2;5, 2 mol/L(NH4)2SO4 elution-1;6, 2 mol/L(NH4)2SO4 elution-2;7, 1.5 mol/L(NH4)2SO4 elution; 8, 1 mol/L(NH4)2SO4 elution; 9, 0.5 mol/L(NH4)2SO4;M, molecular weight marker. 图 4 Phenyl-HP柱层析纯化培养上清液中SOD分析 Fig.4 Analysis of SOD in culture supernatants by Phenyl-HP column chromatography |
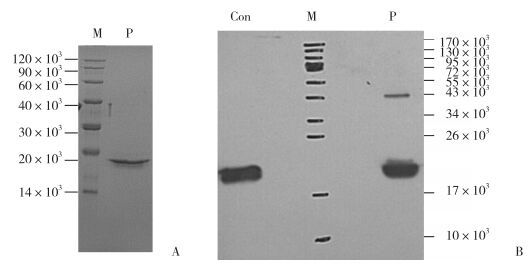
|
| M, molecular weight marker; P, the purified SOD sample; Con, pure SOD product of control. A, gel with Coomassie blue staining; B, Western blotting. 图 5 纯化的SOD产物15% SDS-PAGE分析 Fig.5 Analysis of purified SOD products using 15% SDS-PAGE |
2.4 P. pastoris系统表达重组人源SOD的优化
选取2#、4#、5# 3个克隆株,相同甲醇浓度(1%)诱导和相同培养温度(30 ℃),于不同培养时间取培养上清测定SOD表达。3个克隆株呈现不同的SOD表达动态变化。2#和4#克隆株在培养48 h后,上清中SOD表达增多。见图 6。

|
| M, molecular weight marker; 1, 2, 9, clones 4 in 0 h, 48 h, 72 h; 3, 4, 8, clone 2 in 0 h, 48 h, 72 h; 5-7, clone 5 in 0 h, 48 h, 72 h. 1-9, total protein amount of 78 μg in each supernatant sample. 图 6 不同培养时间不同克隆株SOD表达动态变化 Fig.6 Dynamic changes in secretion of SOD expressed in P. pastoris recombinants at different times during culture |
2.5 SOD标准品曲线确定
将不同酶活力的SOD标准品及各浓度下测得的OD值,做线性标准曲线,获得SOD酶活力与吸光度值线性关系,见图 7。
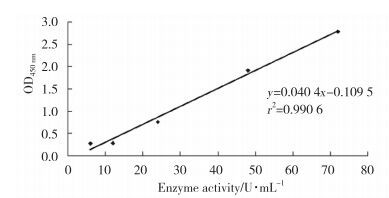
|
| 图 7 SOD标准品曲线 Fig.7 SOD standard curve |
2.6 不同浓度甲醇诱导P. pastoris表达SOD活力测定
改变甲醇的诱导浓度,对5株P. pastoris重组克隆株表达SOD酶活力的影响明显不同。4#克隆株对甲醇诱导浓度变化敏感,当甲醇增加至1%浓度时,培养上清中表达SOD活力明显提高,可达12 U/mL,显著高于其他诱导浓度,差异具有统计学意义(P < 0.05),见图 8。

|
| 2#, 3#, 4#, 5#, 6#, recombinant P. Pastoris clone. *P < 0.05(1.0% concentration of methanol group vs 0.5% concentration group of methanol, 1.0% concentration of methanol group vs 2% concentration of methanol group). 图 8 不同浓度甲醇下诱导P. pastoris重组子表达SOD活力 Fig.8 Activity of SOD expressed in P. pastoris recombinants using different concentrations of methanol for induction |
2.7 不同时间各浓度铜离子处理P. pastoris表达SOD活力测定
在1%甲醇诱导条件下,进一步优化4#克隆株表达高活力SOD的培养条件。在发酵培养基中存在低浓度Cu2+(0%和0.2%)和高浓度的Cu2+(1%)时,均不影响表达SOD的酶活力;而在中浓度Cu2+(0.5%)条件下可以显著提高表达的SOD酶活力(P < 0.05)。
此外,在低、中浓度Cu2+作用下,随着发酵时间的持续,4#克隆株表达SOD活力呈现出先上升后下降的趋势,在发酵时间48 h时表达SOD活力达到最大值,为18.1 U/mL。但是,在高浓度Cu2+作用下,随着发酵时间的持续,4#克隆株表达的SOD活力呈现出先下降后上升的趋势,在发酵24 h时,SOD活力最大,为18.3 U/mL。见图 9。
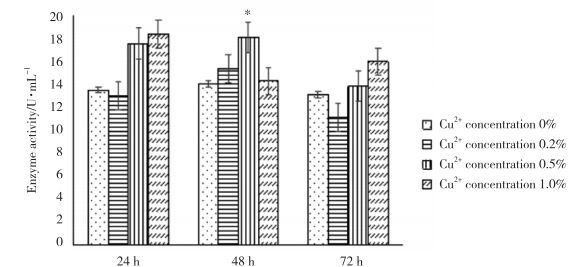
|
| *P < 0.05 vs 0% concentration of Gu2+group. 图 9 不同时间内各浓度铜离子处理P. pastoris重组子表达SOD活力 Fig.9 Activity of SOD expressed in P. pastoris recombinants treated with copper ions at different incubation times |
3 讨论
目前国内多报道利用大肠杆菌,酿酒酵母克隆来表达人Cu,Zn-SOD[12-13]。大肠杆菌由于是原核生物不能正确折叠成天然的蛋白质结构,而且表达产物多为非分泌表达的SOD,需要复性等方法才可以得到有活性的目的蛋白。而且背景杂蛋白较多,纯化比较麻烦,以及存在内毒素难以去除等弊端[14]。酿酒酵母是真核生物,可以正确折叠和加工蛋白质,可分泌SOD到培养基中,还可以克服大肠杆菌系统可能导致的内毒素污染问题。但是酿酒酵母分泌效率低;大规模发酵生产时,产生的乙醇会影响菌体本身生长,难以进行高密度发酵生产[12-13, 15]。
P. pastoris表达系统自建立以来,很多在其他系统难以表达的蛋白都在此得到了表达[16-17]。表达外源蛋白方面的优势是:表达系统安全无毒、不致病;高表达,表达水平在毫克级,比其他系统高出10~100倍;稳定性高,整合的外源蛋白基因不易丢失;高分泌性;外源蛋白可进行多种修饰加工,更接近自然结构;该表达系统可以进行高密度发酵,产品容易纯化[17]。本研究利用基因工程技术,在P. pastoris表达系统构建表达重组人源SOD,并获得了5个稳定整合SOD基因并表达分泌型SOD的克隆株。
通过对培养时间、培养基中铜离子浓度和甲醇诱导条件的优化,探讨了P.pastoris表达人源Cu,Zn-SOD的有效方法。本研究中发现2#和4#克隆株培养48 h以后,发酵液上清中SOD含量开始增多,大量表达可溶性SOD。因为既要保证目的蛋白SOD在P. pastoris重组子的培养上清中有较高表达量,又需要表达的SOD维持较高的酶活力,才能发挥其抗氧化生物活性作用。因此,选取培养时间为48 h,通过不同浓度甲醇诱导SOD表达,不同的克隆株经诱导表达的SOD活力明显不同。4#克隆株对甲醇诱导敏感,经1%甲醇诱导可表达高活力的可溶性SOD,表达的活力较其他条件所表达的活力显著增加。选取4#克隆株进一步优化,因为铜离子是Cu,Zn-SOD具有抗氧化酶活力重要的因素,所以在培养液中添加不同浓度铜离子来检测SOD活力。铜离子浓度为0%~1.0%,随着时间增加SOD活力呈现出先上升后下降的趋势,然而在高浓度铜离子条件下,随着时间的增加SOD活力呈现出先下降后上升的趋势。通过对培养条件优化,明确了在培养48 h,培养基中铜离子浓度为0.5%、甲醇诱导浓度1%时上清发酵液SOD分泌量多,同时活力最好。
综上所述,本研究利用基因工程获得有活性人源SOD,实现在P. pastoris系统高表达重组人源SOD,并通过优化培养条件提高SOD活力,为其规模化生产提供研究基础。同时,通过色谱层析方法,初步获得了重组人源Cu,Zn-SOD的简便、有效的分离纯化方法,可以用于制备高纯度、有活性的重组人源Cu,Zn-SOD。
| [1] |
MANN T, KEILIND. Haemocuprein and hepatocuprein, copper-protein compounds of blood and liver in mammals[J]. Proc R Soc B, 1938, 126: 303-315. DOI:10.1098/rspb.1938.0058 |
| [2] |
MCCORD JM, FRIDOVICH I. Superoxide dismutases:you've come a long way, baby[J]. Antioxid Redox Signal, 2014, 20(10): 1548-1549. DOI:10.1089/ars.2013.5547 |
| [3] |
TAO R, VASSILOPOULOS A, PARISIADOU L, et al. Regulation of MnSOD enzymatic activity by Sirt3 connects the mitochondrial acetylome signaling networks to aging and carcinogenesis[J]. Antioxid Redox Signal, 2014, 20(10): 1646-1654. DOI:10.1089/ars.2013.5482 |
| [4] |
INDO HP, YEN HC, NAKANISHI I, et al. A mitochondrial superoxide theory for oxidative stress diseases and aging[J]. J Clin Biochem Nutr, 2015, 56(1): 1-7. DOI:10.3164/jcbn.14-42 |
| [5] |
POPRAC P, JOMOVA K, SIMUNKOVA M, et al. Targeting free radicals in oxidative stress-related human diseases[J]. Trends Pharmacol Sci, 2017, 38(7): 592-607. DOI:10.1016/j.tips.2017.04.005 |
| [6] |
FILIZ E, KOC I, OZVIGIT Ⅱ. Comparative analysis and modeling of superoxide dismutases (SODs) in Brachypodium distachyon L[J]. Appl Biochem Biotechnol, 2014, 173(5): 1183-1196. DOI:10.1007/s12010-014-0922-2 |
| [7] |
WANG F, WU Q, ZHANG Z, et al. Cloning, expression, and characterization of iron superoxide dismutase in Sonneratia alba, a highly salt tolerant mangrove tree[J]. Protein J, 2013, 32(4): 259-265. DOI:10.1007/s10930-013-9482-5 |
| [8] |
SHRESTHA P, YUN JH, KIM WT, et al. Cloning, purification, and characterization of recombinant human extracellular superoxide dismutase in SF9 insect cells[J]. Mol Cells, 2016, 39(3): 242-249. DOI:10.14348/molcells.2016.2271 |
| [9] |
GRUMETTO L, PRETE AD, ORTOSECCO G, et al. A gel formulation containing a new recombinant form of manganese superoxide dismutase:a clinical experience based on compassionate use-safety of a case report[J]. Case Rep Ophthalmol Med, 2016, 2016: 7240209. DOI:10.1155/2016/7240209 |
| [10] |
KAUR N, SHARMA AK, SHAKEEL A, et al. Therapeutic implications of superoxide dismutase and its importance in kinase drug discovery[J]. Curr Top Med Chem, 2017, 17(22): 2495-2508. DOI:10.2174/1568026617666170307112837 |
| [11] |
LALRINKIMA H, RAINA OK, CHANDRA D, et al. Isolation and characterization of Cu/Zn-superoxide dismutase in Fasciola gigantica[J]. Exp Parasitol, 2015, 151(2): 151-152. DOI:10.1016/j.exppara.2015.01.014 |
| [12] |
EIAMPHUNGPORN W, YAINOY S, PRACHAYASITTIKUL V. Enhancement of solubility and specific activity of a Cu/Zn superoxide dismutase by co-expression with a copper chaperone in escherichia coli[J]. Iran J Biotechnol, 2016, 14(4): 243-249. DOI:10.15171/ijb.1465 |
| [13] |
XU Y, DAI XL, LIU BD, et al. Cloning, expression, and characterization of Fe-SOD from Isetes sinensis[J]. Genet Mol Res, 2016, 15(4): 1-10. DOI:10.4238/gmr15047131 |
| [14] |
MAMIPOUR M, YOUSEFI M, HASANZADEH M. An overview on molecular chaperones enhancing solubility of expressed recombinant proteins with correct folding[J]. Int J Biol Macromol, 2017, 102(4): 367-375. DOI:10.1016/j.ijbiomac.2017.04.025 |
| [15] |
KAOUTHAR F, AMENY FK, YOSRA K, et al. Responses of transgenic Arabidopsis plants and recombinant yeast cells expressing a novel durum wheat manganese superoxide dismutase TdMnSOD to various abiotic stresses[J]. J Plant Physiol, 2016, 198(1): 56-68. DOI:10.1016/j.jplph.2016.03.019 |
| [16] |
ZHANG LQ, GUO FX, XIAN HQ, et al. Expression of a novel thermostable Cu, Zn-superoxide dismutase from Chaetomium thermophilum in Pichia pastoris and its antioxidant properties[J]. Biotechnol Lett, 2011, 33(6): 1127-1132. DOI:10.1007/s10529-011-0543-6 |
| [17] |
LOOSER V, BRUHLMANN B, BUMBAK F, et al. Cultivation strategies to enhance productivity of Pichia pastoris:a review[J]. Biotechnol Adv, 2015, 33(6 Pt 2): 1177-1193. DOI:10.1016/j.biotechadv.2015.05.008 |
 2017, Vol. 46
2017, Vol. 46