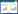文章信息
- 徐平平, 倪莎, 周欣
- XU Pingping, NI Sha, ZHOU Xin
- 双特异性磷酸酶6在卵巢浆液性上皮肿瘤中的表达及临床意义
- Expression of Dual-specificity Phosphatase 6 in Ovarian Serous Epithelial Carcinomas and Its Clinical Significance
- 中国医科大学学报, 2017, 46(12): 1067-1070
- Journal of China Medical University, 2017, 46(12): 1067-1070
-
文章历史
- 收稿日期:2017-06-07
- 网络出版时间:2017-11-30 17:58
卵巢癌是女性常见的恶性肿瘤之一,起病隐匿,早期不容易发现,确诊时多已发生广泛的盆腹腔转移,手术难以彻底清除病灶,预后极差,致死率极高。发现新的早期诊断指标和有效阻断卵巢癌的盆腹腔种植转移对改善卵巢癌患者的预后非常重要。
在哺乳动物细胞内,蛋白激酶和磷酸酶之间保持着一种微妙的平衡,这种平衡调控着多种多样的细胞功能。双特异性磷酸酶6(dual-specificity phosphatase 6,DUSP6)是促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸酶家族的一员,是细胞外调节激酶1/2(extracellular signal-regulated kinases 1/2,ERK1/2)重要的负反馈因子。它通过使ERK1/2的酪氨酸/苏氨酸残基去磷酸化,抑制ERK1/2的活性,进而影响ERK1/2调控的细胞的增殖、分化、转移和凋亡等病理生理过程[1]。有研究表明DUSP6在不同肿瘤组织中的表达情况不尽相同,既可以以抑癌基因的形式、亦可以以原癌基因的形式参与肿瘤的发生发展,如在胰腺癌、前列腺癌、食管鳞癌等恶性肿瘤中表达下调[2-4],在甲状腺乳头状癌、肝癌及小鼠黑色素瘤等恶性肿瘤中表达上调[5-8]。本研究探讨了DUSP6在卵巢浆液性上皮癌中的表达情况及临床意义。
1 材料与方法 1.1 标本来源收集2008年4月至2014年8月中国医科大学附属盛京医院病理科164例卵巢浆液性上皮肿瘤石蜡组织标本。卵巢浆液性癌102例,患者年龄33~74岁,中位年龄52岁。临床分期(2000年FIGO分期):Ⅰ期18例,Ⅱ期13例,Ⅲ期67例,Ⅳ期4例;组织学分级:G1期(高分化)18例,G2期(中分化)31例,G2~3期(中~低分化)29例,G3期(低分化)24例;行血清CA125检测100例,其中CA125≤900 U/mL 56例,CA125 > 900 U/mL 44例;明确记载腹水情况98例,其中腹水≤500 mL 55例,腹水 > 500 mL 43例;行标准淋巴结清扫术68例,其中淋巴结转移17例,无淋巴结转移51例。卵巢浆液性囊腺瘤32例,患者年龄16~77岁,中位年龄57岁。卵巢交界性浆液性囊腺瘤30例,患者年龄21~70岁,中位年龄39.5岁。所有患者均为初次治疗。
1.2 主要试剂兔抗人DUSP6多克隆抗体购自博奥森公司。SP试剂盒及DAB显色试剂盒购自中衫金桥公司。
1.3 免疫组化收集经石蜡包埋的组织,经过切片、脱蜡、蒸馏水浸泡;抗原微波修复,PBS浸泡;3%过氧化氢灭活内源性过氧化氢酶(37 ℃ 40 min),PBS浸泡;山羊血清封闭(37 ℃ 40 min),滴加一抗(浓度1:1 000);湿盒内4 ℃孵育过夜(16 h);复温(室温30 min,37 ℃孵育30 min),PBS浸泡;滴加抗兔IgG第二抗体(37 ℃孵育30 min),PBS浸泡;滴加辣根过氧化物酶(37 ℃孵育30 min),PBS浸泡;DAB显色;自来水冲洗,苏木精复染;脱水,透明,封片。
1.4 结果判定所有切片均选取5个高倍视野,由2位病理科医生采用盲法阅片,根据细胞的染色强度和着色比例进行评分。不着色,0分;淡黄色,1分;棕黄色,2分;棕褐色,3分。着色细胞的百分数:≤5%,0分;> 5%~25%,1分;> 25%~50%,2分;> 50%~75%,3分;> 75%,4分。2项相乘得到最后的评分,< 7分为低表达,≥7分为高表达。
1.5 统计学分析采用SPSS 17.0软件对数据进行分析。DUSP6的表达情况及其与临床病理特征之间的关系应用χ2检验或Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 DUSP6在不同卵巢肿瘤组织中的表达DUSP6的表达主要位于肿瘤上皮组织的胞质内。DUSP6在卵巢良性及交界性肿瘤中的表达无统计学差异(P = 0.830);在卵巢癌中的表达显著低于卵巢良性及交界性肿瘤(P < 0.001)。见图 1、表 1。

|
| A,ovarian cyxtoadenoma;B,ovarian borderline serous cystoadenoma;C,ovarian serous cystoadenocarcinoma(well differentiated);D,ovarian serous cystoadenocarcinoma(moderate differentiated);E,ovarian serous cystoadenocarcinoma(moderate-poor differentiated);F,ovarian serous cystoadenocarcinoma(poor differentiated). 图 1 DUSP6在不同卵巢肿瘤组织中的表达×400 Fig.1 Expression of DUSP6 in ovarian serous tumors ×400 |
| Tissue type | n | Expression of DUSP6 | |
| Low | High | ||
| Benign cystadenoma | 32 | 6(18.8) | 26(81.3) |
| Borderline serous cystadenoma | 30 | 5(16.7) | 25(83.3) |
| Serous cystadenocarcinoma | 102 | 79(77.5) | 23(22.5)1),2) |
| 1)P < 0.001 vs benign cystadenoma;2)P < 0.001 vs borderline serous cystadenoma. | |||
2.2 DUSP6表达与卵巢浆液性癌临床病理特征的关系
DUSP6表达与卵巢癌患者术前血清CA125及腹水量相关(P < 0.05)。DUSP6在血清CA125≤900 U/mL组表达低于CA125 > 900 U/mL组;在腹水≤500 mL组中的表达低于腹水 > 500 mL组。DUSP6表达与患者年龄、FIGO分期、组织分化程度及淋巴结有无转移无关(均P > 0.05),见表 2。
| Clinicopathological characteristic | n | Expression of DUSP6 | P | |
| Low | High | |||
| Age(year) | ||||
| ≤52 | 52 | 41(78.8) | 11(21.2) | 0.731 |
| > 52 | 50 | 38(76.0) | 12(24.0) | |
| FIGO stages | ||||
| Ⅰ+Ⅱ | 31 | 27(87.1) | 4(12.9) | 0.123 |
| Ⅲ+Ⅳ | 71 | 52(73.2) | 19(26.8) | |
| Differentiation | 0.559* | |||
| High | 18 | 13(72.2) | 5(27.8) | |
| Moderate to low | 84 | 66(78.6) | 18(21.4) | |
| Preoperative ascites volume(mL) | 0.034 | |||
| ≤500 | 55 | 47(85.5) | 8(14.5) | |
| > 500 | 43 | 29(67.4) | 14(32.6) | |
| Preoperative serum CA125(U/mL) | 0.019 | |||
| ≤900 | 56 | 48(85.7) | 8(14.3) | |
| > 900 | 44 | 29(65.9) | 15(34.1) | |
| Lymph node metastasis | 1.00* | |||
| Yes | 17 | 14(82.4) | 3(17.6) | |
| No | 51 | 42(82.4) | 9(17.6) | |
| * Use Fisher’s exact probability method,and the rest analysis use chi-square test. | ||||
3 讨论
DUSP6是MAPK激酶家族的重要成员。其基因存在于染色体12q22-23,由3个外显子和2个内含子组成,cDNA的长度约2.5×103 bp[9]。DUSP6是一个具有双重特异性磷酸酶性质的MAPK磷酸酶,通过使酪氨酸/苏氨酸残基去磷酸化抑制ERK1/2的生物学功能。上述过程是一个负反馈过程,当这一过程的平衡被打破,就可能引起恶性肿瘤的发生[1, 10]。
本研究结果证实,DUSP6在卵巢浆液性癌中的表达水平低于良性及交界性肿瘤,提示DUSP6表达下调与卵巢浆液性癌的发生有关。FURUKAWA等[2]研究发现在胰腺癌中,DUSP6可以抑制细胞生长并诱导细胞凋亡。有研究[3]证实DUSP6表达上调可以抑制DU-145人前列腺癌细胞的侵袭及生长,DUSP6表达缺失促进LNCap人前列腺癌细胞的侵袭及扩散,并且发现在小鼠体内DUSP6可以促进DU-145细胞的扩散及肝脏转移。有学者[4]发现DUSP6参与了细胞凋亡的过程。CHAN等[11]通过质粒及RNA干扰技术和细胞活力测定实验证实DUSP6表达上调抑制卵巢癌细胞的增殖速率及锚定依赖性生长能力。因此,当DUSP6表达下调时,可能促进了卵巢上皮细胞的侵袭、转移、增殖能力,或者抑制细胞的凋亡,进而促进了卵巢浆液性上皮癌的发生。ERK1/2的异常激活可以促进细胞的增殖、转移、异常分化或者抑制细胞凋亡;DUSP6是ERK1/2重要的负反馈因子,当DUSP6表达下调时,会异常激活ERK1/2信号传导通路,引起肿瘤发生甚至恶性转化[1]。因此,DUSP6可能通过ERK1/2传导通路参与卵巢浆液性上皮癌的发生。
本研究结果显示,DUSP6在腹水 > 500 mL组的表达较腹水≤500 mL组上调;血清CA125 > 900 U/mL组表达较CA125≤900 U/mL组上调。腹水是卵巢癌腹腔转移常见的症状,淋巴管的堵塞是腹水形成的早期改变,甚至在腹水形成之前即可出现淋巴管堵塞,当腹水生成与清除的平衡被打破时便形成了腹水。CA125是一种癌胚抗原,腹膜、子宫内膜、卵巢生发上皮等均可生成并释放CA125,其中,腹膜是CA125的重要来源。当卵巢癌发生腹膜、膈、网膜等广泛种植及淋巴结转移时,阻塞淋巴管形成腹水,并且刺激腹膜产生大量CA125。本研究证实DUSP6与卵巢浆液性癌的腹水及血清CA125具有一定相关性,表明DUSP6可能与卵巢浆液性上皮癌的盆腹腔转移有一定的关系,DUSP6表达上调可能促进了卵巢浆液性癌的盆腹腔转移。
综上所述,DUSP6与卵巢浆液性癌的发生相关,可能成为卵巢浆液性癌早期诊断的新的分子标志物。DUSP6与卵巢浆液性癌的术前腹水量及血清CA125有一定的相关性,有望成为阻断卵巢癌盆腹腔转移的潜在治疗靶点。
| [1] |
ARKELL RS, DICKINSON RJ, SQUIREES M, et al. DUSP6/MKP-3 inactivates ERK1/2 but fails to bind and inactivate ERK5[J]. Cell Signal, 2008, 20(5): 836-843. DOI:10.1016/j.cellsig.2007.12.014 |
| [2] |
FURUKAWA T, SUNAMURA M, MOTOI F, et al. Potential tumor suppressive pathway involving DUSP6/MKP-3 in pancreatic cancer[J]. Am J Pathol, 2003, 162(6): 1807-1815. DOI:10.1016/S0002-9440(10)64315-5 |
| [3] |
ZHAI X, HAN Q, SHAN Z, et al. Dual specificity phosphatase 6 suppresses the growth and metastasis of prostate cancer cells[J]. Mol Med Rep, 2014, 10(6): 3052-3058. DOI:10.3892/mmr.2014.2575 |
| [4] |
MA JJ, YU XY, GUO L, et al. DUSP6, a tumor suppressor, is involved in differentiation and apoptosis in esophageal squamous cell carcinoma[J]. Oncol Lett, 2013, 6(6): 1624-1630. DOI:10.3892/ol.2013.1605 |
| [5] |
DEGL'INNOCENTI D, ROMEO P, TARANTINO E, et al. DUSP6/MKP3 is overexpressed in papillary and poorly differentiated thyroid carcinoma and contributes to neoplastic properties of thyroid cancer cells[J]. Endocr Relat Cancer, 2013, 20(1): 23-27. DOI:10.1530/ERC-12-0078 |
| [6] |
LEE JU, HUANG S, LEE MH, et al. Dual specificity phosphatase 6 as a predictor of invasiveness in papillary thyroid cancer[J]. Eur J Endocrinol, 2012, 167(1): 93-101. DOI:10.1530/EJE-12-0010 |
| [7] |
YANG B, TAN Y, SUN H, et al. Higher intratumor than peritumor expression of DUSP6/MKP-3 is associated with recurrence after curative resection of hepatocellular carcinoma[J]. Chin Med J (Engl), 2014, 127(7): 1211-1217. DOI:10.3760/cma.j.issn.0366-6999.20122329 |
| [8] |
LI W, SONG L, RITCHIE AM, et al. Increased levels of DUSP6 phosphatase stimulate tumourigenesis in a molecularly distinct melanoma subtype[J]. Pigment Cell Melanoma Res, 2012, 25(2): 188-199. DOI:10.1111/j.1755-148X.2011.00949.x |
| [9] |
FURUKAWA T, YATSUOKE T, YOUSSEF EM, et al. Genomic analysis of DUSP6, a dual specificity MAP kinase phosphatase, in pancreatic cancer[J]. Cytogenet Cell Genet, 1998, 82(3/4): 156-159. DOI:10.1159/000015091 |
| [10] |
EKEROT M, STAVRIDIS MP, DELAVAINE L, et al. Negative-feedback regulation of FGF signalling by DUSP6/MKP-3 is driven by ERK1/2 and mediated by Ets factor binding to a conserved site within the DUSP6/MKP-3 gene promoter[J]. Biochem J, 2008, 412(2): 287-298. DOI:10.1042/BJ20071512 |
| [11] |
CHAN DW, LIU VW, TSAU GS, et al. Loss of MKP3 mediated by oxidative stress enhances tumorigenicity and chemoresistance of ovarian cancer cells[J]. Carcinogenesis, 2008, 29(9): 1742-1750. DOI:10.1093/carcin/bgn167 |
 2017, Vol. 46
2017, Vol. 46