2. 复旦大学附属眼耳鼻喉科医院医务科, 上海 200031;
3. 上海市卫生健康委员会, 上海 200125;
4. 上海市妇幼保健中心科教科, 上海 200062
宫颈癌是临床上最常见的女性生殖系统恶性肿瘤[1],也是目前唯一病因明确,可早发现、早预防的癌症。2020年11月,世界卫生组织(World Health Organization,WHO)正式发布《加速消除宫颈癌全球战略》。根据WHO国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球癌症负担数据,2020年我国宫颈癌的发病率为10.7/10万人,位居国内女性恶性肿瘤第6[2]。2020年12月,国家卫生健康委员会表示中国将全力支持《加速消除宫颈癌全球战略》;2021年国家卫生健康委员会启动健康城市创新试点工作[3],主要以消除宫颈癌行动为切入口,加大宫颈癌三级预防,尤其是提高人乳头瘤病毒(human papilloma virus,HPV)疫苗接种率,加大宫颈癌筛查。然而,目前HPV疫苗接种率仍非常低[4-5],宫颈癌筛查仍是当下重要的防控策略[6-7]。宫颈癌筛查技术多样,HPV检测由于其高灵敏度与稳定性而被广为推荐[8-10]。但由于其特异性较细胞学检测低,在一定程度上会产生“过诊”问题[11-12]。因此,有学者[13-14]提出可通过HPV基因分型对宫颈癌高危人群进行风险分层,以细化HPV筛查的后续管理,从而改善诊断精度,避免阴道镜过度诊断带来的资源浪费,优化筛查价值。根据《中国妇女发展纲要(2021—2030年)》[15]设定,“2030年,中国适龄妇女宫颈癌人群筛查率要达到70%以上”,我国人口基数庞大,若能提升筛查精度,在保障防控效果的前提下,降低资源浪费,所提升的价值亦不容小觑。
课题组基于Markov队列模型对多基因型HPV检测相较于部分(16/18)基因型检测的成本效果进行了分析,显示在相应指标参数设定下,前者相较于后者可在一定程度上优化宫颈癌筛查的价值(见本期《人乳头瘤病毒多基因型检测对传统部分基因型宫颈癌筛查策略的价值优化:基于Markov模型的分析》一文)。本研究旨在探究随着相关技术的有效性、费用、HPV低度风险基因型感染者在人群中占比的变化,相较传统部分基因型检测技术,多基因型HPV检测技术是否依然能在价值表现上更优,以及各类指标参数的变化对结果的影响程度。
1 对象与方法 1.1 筛查方案以HPV初筛为核心策略,梳理构建HPV多基因型与HPV部分基因型从初筛到癌前病变治疗的临床路径,基于患者的视角,构建筛查-诊断-癌前病变治疗的Markov队列模型,并以空模型(即不做任何筛查-诊断-诊疗干预的自然转归状态)为基准,模拟100万例初始年龄为15岁的健康女性50年内在HPV多基因型和HPV部分(16/18)基因型检测技术下的长期效果和成本效果(模型中筛查起始年龄为21岁,筛查间隔为每5年筛查1次)。
其中,部分基因型HPV检测筛查,即目前通常实施的HPV 16/18型高危分型筛查策略[即检测出HPV 16/18型阳性后直接进行阴道镜检查,检测出其余12种基因阳性(不细分)时,则通过薄层液基细胞学检查(thinprep cytologic test,TCT)分流,再行阴道镜检查]。基于文献文件评阅和专家咨询,多基因型HPV检测筛查将14种高危HPV基因型细分为高、中、低度风险基因型组:HPV高度风险基因型组为16/18型,HPV中度风险基因型组为31、45、33/58、52型,HPV低度风险基因型组为51、35/39/68、56/59/66型,并对不同组别阳性设定了差异化的分流诊断路径。基于此构建宫颈癌基因型分组下的各健康状态自然转归模型,并建立多基因型HPV检测与部分基因型HPV检测下的筛查-诊断模型。治疗模型方面:当确诊为HPV感染状态与宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)1级(CIN1)状态时,模型中未设置治疗干预,默认自然进程;当确诊为宫颈上皮内瘤样病变2级(CIN2)或宫颈上皮内瘤样病变3级(CIN3)状态时,模型中设定采取高频电波(loop electrosurgical excision procedure,LEEP)刀治疗或良性子宫切除术(相关自然转归、策略路径模型构建详见本期《人乳头瘤病毒多基因型检测对传统部分基因型宫颈癌筛查策略的价值优化:基于Markov模型的分析》一文)。
1.2 敏感性分析的指标参数就多基因型与部分基因型HPV筛查策略而言,两者最主要的区别是:针对HPV低度风险(HPV 51、35/39/68、56/59/66)基因型感染者的分流TCT与后续处置。HPV多基因型筛查策略把TCT结果为不典型鳞状上皮细胞病变(atypical squamous cells of undetermined significance,ASCUS)(TCT=ASCUS)归入了阴性,故TCT对低度风险基因型感染者大于ASCUS的检测灵敏度与特异度会影响两种筛查策略的价值。其中低度风险感染者包括处于HPV感染状态与进展到CIN1/2/3状态者,而TCT>ASCUS的灵敏度或特异度等于TCT≥ASCUS的灵敏度或特异度乘以TCT>ASCUS的占比。此外,TCT、阴道镜检查或者组织病理学诊断的费用,以及队列人群中HPV低度风险基因型感染的占比等也可能对两种策略的价值产生影响。因此,研究聚焦HPV低度风险基因型感染者TCT的灵敏度与特异度(即传统报告的TCT有效率乘以TCT>ASCUS占TCT≥ASCUS的比例)。对TCT、阴道镜检查、组织病理学诊断的费用进行单因素敏感性分析,观察上述指标参数变化对目标筛查策略成本、效果,以及成本效果的影响。采用蒙特卡洛(Monte Carlo)随机模拟法随机抽样1 000次,评估各参数变化对筛查方案成本效果的影响。各指标参数及其波动阈值详见本期《人乳头瘤病毒多基因型检测对传统部分基因型宫颈癌筛查策略的价值优化:基于Markov模型的分析》一文。
为分析HPV低度风险基因型感染者(包括处于HPV感染状态与进展到CIN1/2/3状态)在人群中占比对两种策略的影响,对模型队列人群的初始状态进行了调整:设健康状态者为90.0%,14种高危基因型HPV感染者为10.0%,基于中国人群HPV各基因型感染分布,对高、中、低度风险基因型组进行了估算设计(表 1)。随后,在确保HPV高度风险基因型感染比例不变的情况下,低度风险基因型感染比例设在0~8%范围内变动,模拟50年,观察其对两种策略成本、效果、阴道镜检查次数以及CIN状态的筛查率影响。
| 表 1 模型模拟队列人群调整后的初始状态构成 |
|
|
利用Treeage Pro 2022软件建立Markov队列模型,并进行成本效果分析和敏感性分析。使用Excel 2021软件进行数据录入和整理,针对上述特定指标参数进行单因素敏感性分析。运行蒙特卡洛模拟1 000次,进行概率性敏感性分析,观察当模型各类参数在所设定阈值范围内变动的情况下,在所设定的支付意愿范围内两种策略孰优孰劣。
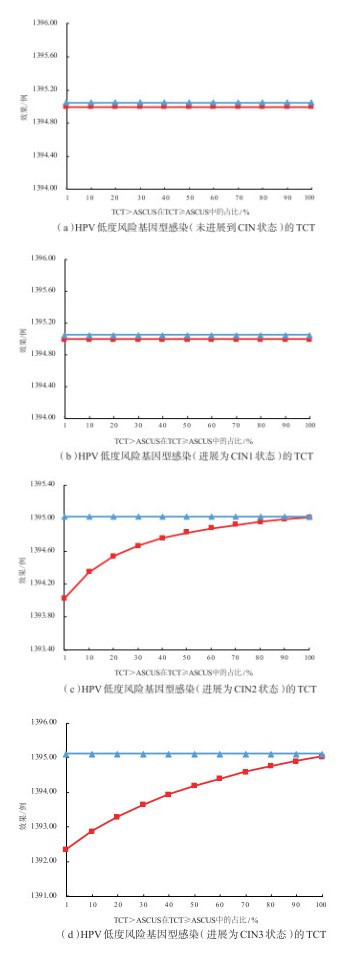
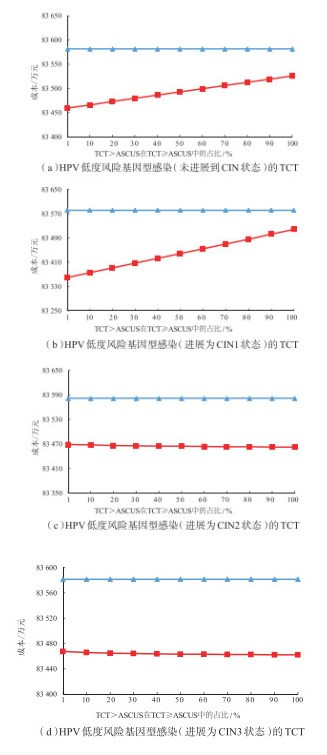
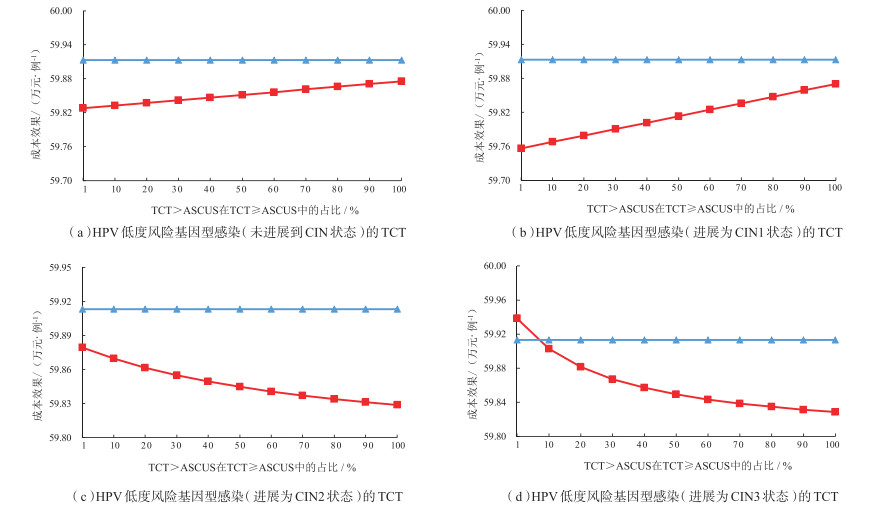
2 结果 2.1 HPV低度风险基因型感染者(未进展为CIN状态者)针对HPV低度风险(HPV 51、35/39/68、56/59/66)基因型感染者,TCT>ASCUS的假阳性率(TCT≥ASCUS假阳性率乘以TCT>ASCUS的占比),TCT≥ASCUS的假阳性率为10%,而其中TCT>ASCUS占比的波动范围设为1%~100%,对占比进行单因素敏感性分析。结果显示,随着该比例的提升(1%~100%),两种筛查策略50年内累计预防宫颈癌例数几乎相同,相差不足1例,见图 1(a)。与此同时,HPV多基因型的成本呈现上升趋势,但始终小于HPV部分(16/18)基因型的成本,见图 2(a)。HPV多基因型的成本效果值逐步上升,但始终小于HPV部分(16/18)基因型,但两者差值在不断缩小,见图 3(a)。
|
注:HPV为人乳头瘤病毒(human papilloma virus);TCT为薄层液基细胞学检查(thinprep cytologic test);ASCUS为不典型鳞状上皮细胞病变(atypical squamous cells of undetermined significance);CIN为宫颈上皮内瘤样病变(cervical intraepithelial neoplasia)。效果是指不同筛查策略下转归50年内与无筛查相比减少的宫颈癌发病例数。红色为HPV多基因型,蓝色为HPV部分(16/18)基因型。 图 1 HPV低度风险基因型感染的TCT假阳性率/灵敏度变化对两种筛查策略效果的影响 |
|
注:HPV为人乳头瘤病毒(human papilloma virus);TCT为薄层液基细胞学检查(thinprep cytologic test);ASCUS为不典型鳞状上皮细胞病变(atypical squamous cells of undetermined significance);CIN为宫颈上皮内瘤样病变(cervical intraepithelial neoplasia)。成本是指100万名初始年龄为15岁的健康女性在不同筛查策略下转归50年内的筛查-诊断-癌前病变治疗的直接医疗费用。红色为HPV多基因型,蓝色为HPV部分(16/18)基因型。 图 2 HPV低度风险基因型感染的TCT假阳性率/灵敏度变化对两种筛查策略成本的影响 |
|
注:HPV为人乳头瘤病毒(human papilloma virus);TCT为薄层液基细胞学检查(thinprep cytologic test);ASCUS为不典型鳞状上皮细胞病变(atypical squamous cells of undetermined significance);CIN为宫颈上皮内瘤样病变(cervical intraepithelial neoplasia)。成本效果是指每预防1例宫颈癌所需要的成本。红色为HPV多基因型,蓝色为HPV部分(16/18)基因型。 图 3 HPV低度风险基因型感染的TCT假阳性率/灵敏度变化对两种筛查策略成本效果的影响 |
结合策略路径分析:对于HPV部分基因型筛查策略,针对HPV低度风险基因型感染者(进展为CIN1/2/3状态),TCT检测的灵敏度(TCT≥ASCUS),CIN1/2/3分别设为0.65、0.75、0.85;而对于多基因型HPV筛查策略,TCT检测的灵敏度(TCT > ASCUS)则是相应癌前病变下(TCT≥ASCUS)灵敏度乘以相应癌前病变下TCT > ASCUS占TCT≥ASCUS的比例,这一数据难以直接从文献中获取,通过专家咨询,针对CIN1/2/3,课题组将相应比例的波动范围均设为1% ~100%。针对不同癌前病变下TCT>ASCUS占TCT≥ASCUS的比例,分别进行敏感性分析,观察其对两种筛查策略成本、效果以及成本效果的影响。
2.2.1 HPV低度风险基因型感染进展为CIN1者模拟50年,结果显示,针对HPV低度风险基因型感染进展为CIN1者,在TCT≥ASCUS灵敏度不变的情况下,随着TCT>ASCUS比例的提升(1% ~100%),HPV多基因型检测筛查策略预防宫颈癌发病例数的效果变化不明显,且两种筛查策略的效果差距甚小,见图 1(b)。与此同时,HPV多基因型的成本呈现上升趋势,但始终低于HPV部分基因型的成本,见图 2(b)。HPV多基因型的成本效果显著提高,但低于HPV部分基因型检测的筛查策略,而差距逐渐缩小,见图 3(b)。这可能与模型中所设定的CIN1确诊后,假定不实施任何干预有关。但在现实的临床实践中,一定比例的CIN1患者很可能会接受一定程度的临床干预(如药物治疗等),即使未接受临床干预措施,亦可能通过改变自身健康生活行为习惯,降低CIN1进展到更高级别癌前病变状态的风险(即相关转归概率下降),从而提升预防效果,降低成本效果比,优化筛查价值。
2.2.2 HPV低度风险基因型感染进展为CIN2或CIN3者模拟50年,结果显示,针对HPV低度风险基因型感染进展为CIN2或CIN3者,不同状态中TCT≥ASCUS灵敏度不变,随着TCT>ASCUS的比例提高(1%~100%),HPV多基因型检测筛查策略的预防宫颈癌例数均逐步增加,与HPV部分基因型检测的效果差距逐渐减小,见图 1(c)(d)。HPV多基因型检测的成本不断降低,见图 2(c)(d),成本效果也呈下降趋势。与CIN2者不同的是,进展为CIN3者TCT>ASCUS的比例在1% ~ 8%之间时,HPV部分基因型检测更具成本效果优势,TCT>ASCUS的比例在8% ~ 100%之间,HPV多基因型检测更具成本效果优势,见图 3(c)(d)。
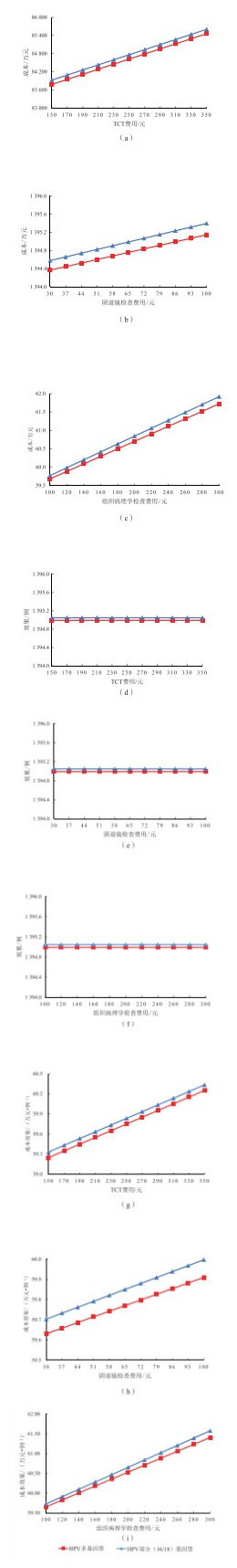
2.3 TCT、阴道镜检查、组织病理学检查费用的敏感性分析对TCT、阴道镜检查、组织病理学检查费用分别进行单因素敏感性分析,结果显示:随着TCT费用在150~350元的范围内变化,阴道镜检查费用在30~100元的范围内提升;或者组织病理学诊断费用在100~300元内提升,HPV多基因型和HPV部分(16/18)基因型两种筛查策略的成本均显著增加,成本差距变动不大。阴道镜检查费用对两种筛查策略的成本差距影响比TCT和组织病理学检查费用大,见图 4(a)(b)(c)。两种筛查策略效果的差距受TCT、阴道镜或组织病理学检查费用影响小,见图 4(d)(e)(f)。随着TCT、阴道镜或组织病理学检查费用的提升,两种筛查策略的成本效果均显著增长,成本效果的差距变化不明显,但HPV多基因型在相应区间内的成本效果始终低于HPV部分(16/18)基因型,见图 4(g)(h)(i)。随着阴道镜、组织病理学检查费用增加,两种筛查策略的成本和成本效果差距有增大趋势。
|
注:HPV为人乳头瘤病毒(human papilloma virus);TCT为薄层液基细胞学检查(thinprep cytologic test)。成本是指100万例年龄为15岁的健康女性在不同策略下转归50年内筛查-诊断-癌前病变治疗的直接医疗费用。效果是指不同策略下转归50年内与无筛查治疗相比减少的宫颈癌发病倒数。成本效果是指每预防1例宫颈癌所需要的成本。 图 4 TCT、阴道镜检查、组织病理学检查费用对两种筛查策略的影响 |
蒙特卡洛随机模拟1 000次:当支付意愿在0~42.075万元范围内变化时,HPV多基因型具有优势成本效果的概率更高;当支付意愿大于42.075万元时,HPV部分基因型更具有成本效果优势。见图 5。
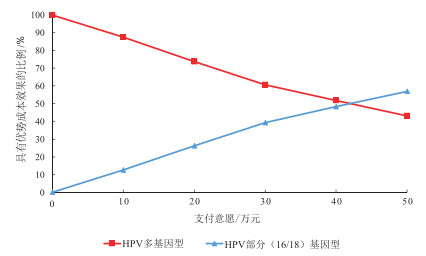
|
注:HPV为人乳头瘤病毒(human papilloma virus)。 图 5 两种筛查策略成本效果可接受曲线 |
结果显示,随着HPV低度风险基因型感染比例的增加,HPV多基因型检测在效果上与HPV部分基因型几乎保持一致,成本与阴道镜检查次数的减少幅度有所增加,但CIN状态的筛查率也略有提升,见表 2。
| 表 2 初始人群中HPV低度风险基因型感染比例的敏感性分析结果 |
|
|
根据单因素敏感性分析结果,以减少宫颈癌发病例数为效果指标时,随着HPV多基因型筛查策略中TCT分流检测HPV低度风险基因型感染者(未进展到CIN状态)中假阳性率的下降,以及TCT分流检测CIN1/2/3(HPV低度风险基因型感染)患者灵敏度的上升,HPV多基因型策略相对于HPV部分(16/18)基因型始终具有更高的价值优势,这与Asti等[16]的研究结论相似。且随着TCT分流检测技术灵敏度的不断提升,能更有效地避免假阳性带来的“过诊”,并尽可能减少因放松诊断标准而带来的“漏诊”。
本次研究得到的启示,在宫颈癌筛查中HPV基因型检测与细胞学检查并不能彼此替代,而是具有重要的协同增效作用。敏感性分析结果发现,作为分流检测的TCT,其技术精度对HPV分基因型筛查策略的成本、效果及成本效果均具有至关重要的影响:若TCT的灵敏度低,则可能会带来“漏诊”,从而影响疾病的早发现、早治疗;若TCT的特异度低,则会削弱HPV多基因型策略降低“过诊”问题的功效。同时,要进一步实现风险量化的目的,则需要日后在有关TCT检测的研究报告中,细化TBS(The Bethesda System)各分项结果的报告,以为风险量化标准的确定、效果与价值评估提供更精准的参考。
3.2 TCT检测、阴道镜和组织病理学检查费用的影响分析研究结果显示:TCT检测、阴道镜检查费用或者组织病理学检查费用不影响两种筛查策略优选顺序,HPV多基因型均保持着成本效果优势;阴道镜检测与组织病理学检查的费用变化对两种筛查策略在成本和成本效果差距的影响更显著。这主要是因为HPV多基因型和HPV部分(16/18)基因型检测策略最核心的区别是通过TCT检测实现对HPV低度风险基因型感染者的分流,而所降低的成本,较大部分则来自于由于分流差异化处置而减少的阴道镜检测人次数,那么在TCT分流技术精度不变的情况下,成本主要与阴道镜检查诊断相关的医疗服务项目费用有关。
3.3 蒙特卡洛模拟分析2022年我国人均国内生产总值(gross domestic product,GDP)达到85 698元[17],以3倍人均GDP为参考值,当支付意愿为25 704元时,HPV多基因型具有更高的成本效果优势。可以看出,HPV多基因型具有一定的成本效果优势,这与上述单因素敏感性分析结果相似。
3.4 HPV低度风险基因型感染比例的影响分析研究结果显示,HPV多基因型的效果与价值受人群中HPV低度风险基因型感染比例的影响,两者存在正相关的关系,这是因为HPV低度风险基因型的处理是两种策略的关键差异所在。此外,随着HPV疫苗的不断普及,对HPV 6/11/16/18/31/33/45/52/58型别具有预防作用[18],相应的感染率会有所下降,疫苗所没有覆盖的14种高危基因型中较低风险的HPV 51/35/39/68/56/59/66基因型就需要尤为关注,如能在保证筛查效果的前提下,促进资源利用效能,则可以进一步提升HPV宫颈癌筛查的价值。
3.5 总结与展望目前谈及的高危基因型HPV检测主要是指HPV部分(16/18)基因型,即对16、18型作分型检测且后续直接行阴道镜检查,而另12种则均通过TCT分流(标准相同)后再行阴道镜检查。也许,通过细分感染基因型并建立适宜的风险量化是实现筛查后精准管理、提升筛查管理价值的有益路径[19-20]。研究发现:TCT分流检测技术的精度是确保HPV多基因型筛查策略效果与价值的关键;TCT检测、阴道镜检查与组织病理学检查费用对两种策略的选择亦有影响,特别是后两者费用的增大将进一步增强HPV多基因策略的价值优势;人群中HPV低度风险基因型感染比例也是决策需要考量的重要因素,感染比例越高,HPV多基因型策略的价值优势也会有所提升。须注意的是,多基因型可能带来“漏诊”,而避免“漏诊”的关键是提升TCT分流检测技术的有效性,在评估TCT有效性时,应进一步细化TBS(The Bethesda system)各级结果的研究报告。
本研究的不足之处在于:不同HPV基因型的疾病健康状况转归概率主要来源于他国人群的文献数据;TCT有效性(>ASCUS)的值缺乏真实世界数据支撑。建议日后进一步基于我国人群的真实世界数据完善模型分析结果。
·作者声明本文无实际或潜在的利益冲突
| [1] |
KOH W J, ABU-RUSTUM N R, BEAN S, et al. Cervical cancer, version 3. 2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Ne, 2019, 17(1): 64-84. DOI:10.6004/jnccn.2019.0001 |
| [2] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [3] |
国家卫生健康委员会. 国家卫生健康委将启动试点推进宫颈癌疫苗应用[EB/OL]. [2023-01-10]. http://www.gov.cn/xinwen/2021-04/30/content_5604244.htm.
|
| [4] |
陈伟, 李彦坤, 吴小丽, 等. 2018-2021年天津市适龄女性人乳头瘤病毒疫苗接种率分析[J]. 中国疫苗和免疫, 2022, 28(6): 684-689. |
| [5] |
陈荣兰. 育龄期妇女对HPV疫苗认知情况及接种情况的调查分析[J]. 中国医药指南, 2022, 20(33): 118-120, 124. |
| [6] |
陈丹妮, 张晓华, 揭俊钦, 等. 基于医疗费用的宫颈癌筛查方案成本效果的敏感性分析[J]. 中国卫生资源, 2019, 22(3): 185-189. |
| [7] |
程媛, 齐兵, 吴欣欣, 等. 婺源县妇女HPV感染率、基因分型和疫苗接种意愿调查[J]. 上海预防医学, 2017, 29(11): 872-875, 879. |
| [8] |
杨慧宾, 揭俊钦, 陈丹妮, 等. 基于筛查技术有效性的宫颈癌筛查方案成本效果的敏感性分析[J]. 中国卫生资源, 2019, 22(3): 180-184. |
| [9] |
WORLD HEALTH ORGANIZATION. WHO guideline for screening and treatment of cervical pre-cancer lesions for cervical cancer prevention, second edition[R]. Geneva: World Health Organization, 2021.
|
| [10] |
易驰喆, 陆妹英, 苏讷敏, 等. 人乳头瘤病毒分型联合宫颈液基薄层细胞学检测在宫颈癌筛查中的应用[J]. 上海预防医学, 2022, 34(1): 73-76. |
| [11] |
钟纬经, 梁浩和. 肇庆地区妇女HPV分型检测联合宫颈TCT及宫颈活检结果分析[J]. 中国医学工程, 2020, 28(3): 91-93. |
| [12] |
曾玺, 李静, 康乐妮, 等. 不同检测策略在成都双流地区宫颈癌筛查中的价值研究[J]. 四川大学学报(医学版), 2022, 53(5): 896-903. |
| [13] |
谢锋, 隋龙. HPV感染所致宫颈病变的诊断与治疗[J]. 国际生殖健康/计划生育杂志, 2015, 34(6): 475-479. |
| [14] |
许惠惠, 石卫武, 徐玖飞, 等. HPV基因分型在宫颈癌筛查风险分层管理中的价值[J]. 中华实验和临床病毒学杂志, 2016, 30(1): 14-18. |
| [15] |
国务院. 国务院关于印发中国妇女发展纲要和中国儿童发展纲要的通知[EB/OL]. [2023-01-01]. http://www.gov.cn/xinwen/2021-04/30/content_5604244.htm.
|
| [16] |
ASTI L, HOPLEY C, AVELIS C, et al. The potential clinical and economic value of a human papillomavirus primary screening test that additionally identifies genotypes 31, 45, 51, and 52 individually[J]. Sex Transm Dis, 2021, 48(5): 370-380. |
| [17] |
中华人民共和国中央人民政府. 2022年我国GDP突破120万亿元增长3%[EB/OL]. [2023-02-09]. http://www.gov.cn/shuju/2023-01/17/content_5737514.htm.
|
| [18] |
冯雪娇, 侯海龙, 喻琼, 等. 我国宫颈癌疫苗市场分析及对策研究[J]. 中国生物工程杂志, 2020, 40(11): 96-101. |
| [19] |
SONG F B, YAN P S, HUANG X, et al. Roles of extended human papillomavirus genotyping and multiple infections in early detection of cervical precancer and cancer and HPV vaccination[J]. BMC Cancer, 2022, 22(1): 22-42. |
| [20] |
WRIGHT T C, STOLER M H, PARVU V, et al. Risk detection for high-grade cervical disease using onclarity HPV extended genotyping in women, ≥ 21 years of age, with ASC-US or LSIL cytology[J]. Gynecol Oncol, 2019, 154(2): 360-367. |
 2023, Vol. 26
2023, Vol. 26


