国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球癌症疾病负担数据显示,乳腺癌新发病例数快速增至226万例,首次取代肺癌成全球第一大癌症,平均每8名新发癌症病例中就有1名乳腺癌患者[1]。中国也是乳腺癌发病大国,据国家癌症中心统计,2015年我国女性新发乳腺癌病例数约30.4万例,发病率达45.29/10万,居女性发病首位[2]。乳腺癌是全球主要的公共卫生问题,其引起的疾病负担日益严重。
BRCA1/2基因的致病突变是乳腺癌的重要预测因子。有研究显示,约6%的乳腺癌可由遗传性的BRCA1/2基因突变引起[3],且携带BRCA1/2突变基因的女性在80岁之前患乳腺癌的风险为69%~72%[4]。携带BRCA1/2突变基因的女性可以选择预防性手术(乳房切除术、输卵管卵巢切除术)、化学药物预防和密切的乳腺肿瘤影像学监测[5-6],以降低患癌风险。乳房切除术可降低90%~95%罹患乳腺癌的风险[7-8],输卵管卵巢切除术可降低79%~96%罹患卵巢癌的风险[9-11]。
了解个体的基因突变状态对乳腺癌管理至关重要。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)建议符合某些标准如癌症个人史、家族史、年龄、性别、乳腺癌类型等的患者,可以考虑进行BRCA检测[12]。中华医学会也建议符合特定标准的患者可考虑进行BRCA检测[13]。近年来,越来越多的研究致力于探索面向所有乳腺癌或卵巢癌患者的BRCA检测策略和面向普通人群的检测策略,但这些筛检方法的性价比优势似乎因目标人群和国家背景等的不同而有所不同[14-15]。
目前有两篇已发表的系统综述在证据和方法学上梳理了基因检测应用于乳腺癌的卫生经济学评价研究,但均未完全涵盖现有研究中所涉及的检测策略。具体来说,从证据角度,Koldehoff等[14]在2021年发表的关于基因检测应用于乳腺癌和卵巢癌的成本效果评价综述没有考虑面向普通人群的策略。然而,已有的成本效果分析[16]发现,基于普通健康人群的检测策略在某些高收入国家具有性价比优势,也可能适用于中等收入国家,如中国。这些研究结论是否可靠、研究模型是否可借鉴值得探索。另一篇2016年发表的系统综述虽然考虑了面向普通人群的策略[15],但因纳入的文章截至2015年2月,其证据具有一定的滞后性。众所周知,科技的发展日新月异,在这6年中,基因检测技术也不断优化和创新,基因检测的准确度和市场价格都发生了较大的变化。同样,降低风险的预防措施和精准治疗手段也在持续完善。因此,本综述希望更全面地关注近年来乳腺癌防治中BRCA基因检测策略的最新证据,总结不同筛查策略的成本效果情况,为探索符合中国国情的乳腺癌基因筛查策略提供证据支持。
另一方面,从模型方法角度,得益于近年来出台的BRCA基因检测策略在乳腺癌防治中的临床指南[13],以及国际上对卫生经济学评价方法指南[17-18]的推广,相关研究的模型质量可能获得提升,较早期的建模研究而言,更具借鉴价值。因此,本综述聚焦在近6年该领域中已发表的卫生经济学评价研究,通过审视和比较各研究在方法学上的异同,希望为后续的建模研究提供方法依据,也为构建适应中国本土的模型提供参考。
综上,本研究的目的是:①对BRCA基因检测策略在乳腺癌防治中的最新成本效果证据进行总结,旨在了解不同条件下哪种BRCA基因检测策略具有成本效果优势,为我国开展适宜的BRCA基因检测项目提供证据支持;②比较现有的卫生经济学评价研究中方法学的异同,探索值得改进的地方,从而指导后续原始研究的设计和实施。
1 方法在开展和报告综述的过程中,本研究均遵循了系统评价和meta分析的首选报告项目(preferred reporting items for systematic reviews and meta-Analyses,PRISMA)准则[19]。
1.1 纳入和排除标准采用以下纳入和排除标准来选择相关的原始研究。纳入标准:(1)成本-效果研究应明确评估BRCA基因检测策略在乳腺癌防治中的应用。BRCA基因检测策略则定义为以防治乳腺癌为目的,包括识别BRCA突变携带者的基因检测和后续相应的医疗保健措施。(2)研究应纳入基因检测后医疗保健措施的成本和获益。(3)研究应采用完整的卫生经济学评估设计,例如成本-效果分析(cost-effectiveness analysis,CEA),成本-效益分析(cost-benefit analysis,CBA),成本-效用分析(cost-utility analysis,CUA)和成本最小化分析(cost-minimization analysis, CMA)。排除标准:①研究仅含预算影响分析(budget impact analysis,BIA);②研究仅评估BRCA基因检测后医疗保健措施的成本和获益;③研究评估不包含BRCA基因的多基因检测产品或技术,如Oncotype DX、MammaPrint、EndoPredict、Breast Cancer Index、Prosigna;④研究对象为非人类;⑤文献类型为评论、信件、技术成果、专利、案例报道、方法论评述、综述。
1.2 检索策略系统检索了2015年3月1日—2020年8月8日发表的未纳入2016年综述[15]的原始研究,使用了以下数据库进行系统检索:PubMed、Embase、EconLit、中国生物医学文献数据库、中国知网、万方数据库。灵活采用以下检索词,以减少遗漏任何原始研究的风险:“乳腺癌”“基因检测”“成本”“成本效果”“成本效用”“成本效益”“成本最小化”。检索范围包括文献题目、摘要、关键词和主题词(主题词仅限于部分支持该检索域的数据库)。对每个关键词的中英同义词和近义词调整和修改,以适应不同数据库的检索规则。此外,也对纳入文献中的所有参考文献进行了手工检索。
1.3 文献筛选由两名评价员独立筛选文献和判断相关性,当意见未统一时会通过第三位评价员进行讨论协商解决,具体流程见图 1。
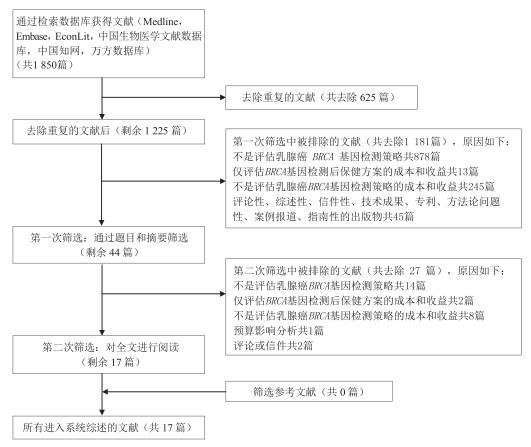
|
注:PRISMA为系统评价和meta分析的首选报告项目(preferred reporting items for system evaluation and meta analysis)。 图 1 系统文献综述PRISMA流程 |
本研究使用Excel 2019结构化表格进行信息提取和质量评估,两位评价员分别独立地对相关原始文献的信息进行提取。对于提取或评估结果不一致或不确定的地方,会与第三位评价员讨论协商解决,确保提取信息的准确性。数据提取内容见表 1和表 2。
| 表 1 系统评价纳入研究中BRCA基因检测策略的基本特征和增量成本-效果比 |
|
|
采用卫生经济学质量(quality of health economic studies, QHES)工具评估纳入研究的质量。QHES工具包括16个条目,主要关注研究方法的合理性、结果的有效性和透明性以及结果的综合报告水平,是目前唯一一个对每条标准赋予权重的质量评价工具[17]。每个条目的定性评价结果为“是”“否”“部分”“不适用”,并可根据各条目的权重分值进行量化评分。考虑到不同文献存在某些条目不适用的情况,为保证不同文献的质量得分具有可比性,调整了计分方式:将每篇文章在各条目的得分累加为实际得分,从100分中将扣除不适用条目的权重总分作为该文章的调整总分,调整得分=实际得分/调整总分×100。调整得分可反映各研究排除不适用条目后实际满足QHES质量评价规范的情况。
1.5 综合证据由于纳入研究之间存在较大异质性,无法进行meta分析,采用定性描述来呈现研究结果。
2 结果 2.1 文献检索结果共纳入17篇文献,系统文献综述PRISMA流程见图 1。
2.2 各BRCA基因检测策略的基本特征和经济性评价结果15篇文献从高收入国家的角度进行了研究,仅4篇模拟了中等收入国家(马来西亚、中国、巴西、印度)的情况。根据文献目标人群的不同,BRCA基因检测策略可大致分为以下3类:①面向普通人群的BRCA基因检测策略(即全人群策略);②符合临床或家族历史标准高危人群的BRCA基因检测策略(即常规策略);③面向乳腺癌或卵巢癌患者的BRCA基因检测策略(即基于癌症患者的策略),其中往往还伴随着级联筛查,即由被检出BRCA基因突变的患者拓展到其家庭成员,并为她们提供基因检测服务。纳入的17篇文献:4篇比较了全人群策略与常规策略[16, 20-22];4篇比较了基于癌症患者的策略和无基因检测策略[23-26],其中3篇结合了级联筛查;3篇比较了常规策略与无基因检测策略[27-29];2篇比较了基于癌症患者的策略和常规策略[30-31],均结合了级联筛查;1篇比较了不同基因检测接受率的全人群策略[32];1篇比较了检测不同基因数量的基于癌症患者的策略并结合级联筛查[33];1篇比较了检测多基因的全人群策略和无基因检测策略[34];1篇比较了检测不同基因数量的常规策略[35]。从基因检测技术上看,12篇文献聚焦仅含BRCA的技术,其余5篇则关注包含了BRCA的多基因检测技术。所有文献的具体增量成本-效果比(incremental cost-effectiveness ratio,ICER)值及阈值见表 1。
2.3 各卫生经济学评价模型的特征从模型结构(表 2)来看,所纳入的17篇文献中,4篇改编自同一个英国模型[16, 20, 22, 30],2篇有共同的巴西源模型[27, 29],另2篇改编自同一个卵巢癌模型[23, 25]。10篇文献采用马尔科夫队列模型,其中:5篇文献是评估全人群的策略;4篇文献使用个人水平的仿真模型且均是评估基于癌症患者的策略;3篇文献使用决策树模型。来自英国同一个模型的4篇文献考虑了罹患冠状动脉粥样硬化性心脏病(coronary heart disease, CHD)的健康状态。16篇文献选取健康效用值作为效果指标,其中4篇文献[22-23, 26, 31]未提及预防性切除手术带来的负面效用影响。
| 表 2 系统评价纳入研究中BRCA基因检测策略的基本特征和经济性评价结果 |
|
|
仅有5篇文献报告了关于模型验证方法的情况,其中,2篇文献通过检查技术的准确性来验证内部有效性[27, 29],2篇文献通过咨询专家检查模型的表面有效性[29, 35],这3篇文献均进行了跨模型验证。5篇中仅1篇采用AdViSHE工具来提供模型验证状态的结构化视图[29]。
共16篇文献报告了概率性敏感性分析,14篇文献报告了确定性敏感性分析。其中,12篇文献的分析中包括了对预防性切除手术的接受度,8篇文献含预防性切除手术的疗效。将所有研究在基础情境下预防性乳房切除术或预防性输卵管卵巢切除术接受度的取值进行汇总可知:在健康人群中,其中位数(范围)分别为0.38(0.06~1.00)和0.55(0.10~1.00);在乳腺癌或卵巢癌患者中,其中位数则为0.35(0.21~0.54)和0.51(0.13~0.71)。预防性切除手术的疗效,即降低乳腺癌或卵巢癌发病风险的程度,其基础情境取值的中位数(范围)分别为0.90(0.36~1.00)和0.88(0.72~1.00)。各模型均假设基因检测技术具备高准确度(范围:0.98~1.00),且基因突变携带者对密切影像学监测的接受度差异显著(范围:0.07~1.00),但所有研究均未对这2个参数进行敏感性分析。
2.4 纳入研究的质量评分结果所纳入文献的QHES质量评分在78~97之间,中位数得分为90。58%(10/17)的文献QHES评分不低于90分,18%(3/17)的文献评分为80~89分,24%(4/17)的文献评分低于80分。对于其中12个,超过75%的文献作了较为详细的分析描述。对于以下4个条目――分析变量的估计(条目3)、参数数据的获取方法(条目7)、健康产出的测量方法(条目11)、研究的潜在偏倚(条目14),分别有12(71%)、5(30%)、5(30%)、2(12%)篇文献给予了明确说明。见图 2。

|
注:纵坐标为卫生经济学评价工具中16个评价条目,n为该条目适用的文章数目;横坐标为该条目中不同得分类型的文章比例;Y为是,即文章在该条目上得满分;N为否,即文章在该条目上不得分;PARTLY为部分是,即文章在该条目上的得分介于0至满分之间。 图 2 质量评分结果 |
以基于英国和美国人口的现有证据来判断,对于绝大多数30岁以上的犹太女性(即阿什肯纳兹犹太人和塞法迪犹太人),从卫生系统/支付方角度(仅考虑直接医疗成本),与常规策略相比,全人群策略具有绝对的成本效果优势。即便将目标人群分别扩展到英国和美国30岁以上的普通女性,无论从卫生系统/支付方角度,还是社会视角,全人群策略仍然是更具优势的策略。同样是与常规策略相比,另一项针对英美乳腺癌患者的研究则表明,无论从支付方角度还是从社会角度,基于癌症患者的策略结合级联筛查也更具性价比。但目前尚未见该策略与全人群策略的比较研究。在探索多基因检测技术方面,对于40岁和50岁具有遗传性乳腺癌高风险的美国女性,对支付方而言,依据家族历史标准的多基因检测比常规的单基因检测更具性价比。扩展到30岁以上的英美非犹太女性,从卫生系统/支付方角度看,全人群的多基因检测策略也比常规BRCA1/2检测策略更有成本效果优势。虽然这些研究在一定程度上支持多基因优于单基因检测,却尚未回答多基因检测技术是更适宜应用于全人群,还是常规高危人群的问题。此外,值得注意的是,当前很少有研究对不同起始年龄的人群进行BRCA基因检测策略的模拟,以评估基因检测在不同起始年龄水平目标人群中的性价比。
针对其他国家开展的BRCA基因检测策略的卫生经济学评价研究偏少。虽然全人群策略也在中国、印度、荷兰、巴西和澳大利亚人群中进行了模拟,但研究证据的质量偏低,难以阐明其相对常规策略是否具有性价比。基于癌症患者的策略结合级联筛查,对挪威人群而言,比常规策略更具有成本效果优势;澳大利亚和加拿大则发现该策略比不做基因检测更具性价比。同样,常规策略在巴西、德国人群中和马来西亚乳腺癌患者中与不做基因检测相比也显示出成本效果优势。多基因检测策略在挪威乳腺癌患者中也进行了探索,但由于缺乏BRCA等多种基因外显率在该人群中的准确数据,难以说明其相对常规BRCA1/2检测策略是否具有更高的成本效果优势。仅有1项日本人群证据表明,在转移性乳腺癌患者中利用BRCA基因检测结果指导药物治疗并不是具有性价比的策略。
3.2 不同检测策略适用于不同的模型在评估BRCA检测的性价比时,虽然马尔科夫队列模型的应用更为常见,但并不一定适用于所有基因检测策略。旨在评估基于癌症患者策略的研究,无论是否结合先证者介导的级联筛查,更倾向于采用个体水平的仿真模型;而评估全人群或常规策略的研究,即更偏向于选择马尔科夫队列模型。比较而言,马尔科夫队列模型在处理重复发生事件时比单独的决策树模型更加灵活,但比那些需要详细数据输入个体水平的仿真模型的灵活性要小。因此,当评估的基因检测策略包括级联筛查时,个体水平的仿真模型也许更合适,它可以记忆每个被模拟的乳腺癌或卵巢癌患者及其家庭成员的属性,体现人群的异质性[36],而马尔科夫队列模型则更适用于同质性较高的目标人群,例如具有BRCA1/2基因突变高风险的人群或普通人群。
3.3 模型验证有待加强本综述中的大多数模型都缺乏对模型验证方法的描述。然而,有效的模型验证有助于确保模型的合理性,识别潜在的不足并评估其可能的影响,发现模型的错误并降低模型风险。模型验证提供了关于模型分析和预测结果是否有效准确的关键信息,只有经过检验并证明为有效的模型,才能让模型使用者和决策者相信模型分析的最终结果[37]。因此,日后基于模型的研究应高度重视模型的全面效度,包括表面效度、内部效度、外部效度,若条件允许甚至可进行交叉效度验证。建模人员还可以使用一些可靠的评估工具来解决模型验证问题,例如健康-经济决策模型验证状态评估工具(AdViSHE)和技术验证清单(TECH-VER checklist)。AdViSHE允许模型开发者用系统的方式报告验证过程及其结果,让模型使用者自行判断模型是可靠、合理还是需要进行额外的验证[38];TECH-VER checklist可帮助识别模型中可能存在的错误并探索错误原因,以提高验证的有效性和透明度[39]。合理的验证和足够的透明度可以使其他人重建并复核该模型,从而提高模型的可信度[40-41]。
3.4 对关键参数的不确定性分析根据所纳入的研究结果来看,以下这4个关键参数往往是造成不确定性的主要因素,是建模者需要重点关注的。
第一个是目标人群中BRCA基因的外显率,这极有可能具有地区特异性。一项巴西研究缺乏BRCA外显率的本地数据[29],而选择了一项国际队列研究的数据,却未进一步阐明数据是否适用,这可能会误判巴西妇女的风险状况。不同的BRCA外显率导致不同的风险评估结果,进而增加成本效果模型的不确定性[42]。同样,多基因检测研究缺乏非BRCA的罕见基因现患率数据,也存在类似问题。
第二个是预防性手术的接受率,这在患者和健康人群中可能不同。一项模拟级联筛查的加拿大研究假设所有BRCA基因检测阳性的女性家庭成员都将接受预防性手术[31]。显然,并非每个阳性结果的家庭成员都愿意接受或有资格获得预防性手术,诸如年龄、绝经后状态和乳腺癌的个人病史等因素都会影响家族性卵巢癌高危女性对输卵管卵巢切除术的接受[43]。对于基因检测的接受率也是如此。
第三个是预防性手术的疗效,马来西亚的研究假设接受预防性手术的患者未来将不存在罹患乳腺癌和卵巢癌的风险[28]。但有证据显示,在BRCA1/2基因突变携带者中,实施双侧预防性乳房切除术后仍有7%的风险在70岁之前罹患乳腺癌[7, 44]。所纳入研究在术后降低乳腺癌或卵巢癌发病风险的程度上的取值差异巨大(36%~100%)。同时,为健康个体提供预防性手术也应考虑地区的手术水平,如手术风险、麻醉风险等[45]。这些不确定性因素均可能造成模型结果的偏倚,但目前一半以上的研究未考虑这一问题。日后的模型需要更加关注预防性手术的疗效、不良反应以及并发症,并对其存在的不确定性问题开展充分的敏感性分析和讨论。
第四个是基因检测技术的特异度和灵敏度,有3项评估多基因检测的研究[24, 26-27]均假设基因检测技术具有100%的特异度和灵敏度,忽略了技术所带来的假阴性和假阳性病例,进而影响成本效果模型的最终结果。有证据表明,基于聚合酶链式反应(polymerase chain reaction,PCR)的测序方法(包括使用PCR扩增的Sanger测序和下一代测序系统)可能会产生假阴性结果,PCR或文库形成中的扩增子也会产生偏差而导致假阳性结果[46]。因此,由于基因检测技术的准确与否而对结果产生的不确定性也应进行相应的敏感性分析。
3.5 与既往综述研究的比较与近期发表的Koldehoff等[14]的系统综述不同,本次综述还纳入了基于全人群的卫生经济学评价研究。评阅这些研究发现,目前的证据仅支持在英美普通女性人群中开展全人群的BRCA筛查策略,而该策略在其他国家是否具有性价比则尚无定论,这是值得关注的研究方向,有待更多更高质量的原始研究来阐明。从方法学上,除了Koldehoff等提出的预防性手术的接受率和BRCA的外显率,本综述还发现现有研究普遍忽视了另外两个关键参数,即多基因检测的诊断准确度、预防性手术的疗效。另外,在构建模型时应充分考虑预防性手术的不良反应及并发症,其中之一就是冠状动脉粥样硬化性心脏病[47],同时预防性手术所带来的健康效用值的降低也不应被忽视,这对现有的系统综述进行了补充,也为日后模型构建提供了一定的技术指导。
3.6 研究局限性本综述也存在一些局限性。方法学层面:①只检索了有限的数据库中公开发表的文献研究,未检索灰色文献,可能存在发表偏倚。②质量评价仍存在一定的主观因素。③由于聚焦于BRCA基因检测在乳腺癌防治中的成本效果研究,而BRCA基因突变也大大增加了罹患卵巢癌的风险,BRCA检测所带来的成本和收益不可避免会包含卵巢癌的部分。尽管没有纳入只针对卵巢癌进行模拟的研究,但是所排除的4篇相关研究所构建的模型往往与所讨论的诸多模型类似或为其中某模型的一部分,因此未纳入的卵巢癌模型不会对结论产生根本影响。④纳入研究的目标人群存在较大异质性(例如年龄),仅对结果做了定性分析,未能进行定量分析。结果外推层面:①纳入研究多基于欧美地区,基因检测项目的人群参与率、预防性手术接受度及医疗资源配置与欠发达地区存在较大差异。②人群研究证据匮乏,多基于模型开展,伴随较多不确定性。③基因突变率和乳腺癌、卵巢癌的疾病转归等流行病学信息多来自西方人群,缺乏亚洲地区人群的数据。即便如此,本研究对全球BRCA基因检测策略的经济学评价研究进行系统综述,其经济学评价研究的方法学及结果对证据匮乏的欠发达地区仍有一定的借鉴意义。
·作者声明本文无实际或潜在的利益冲突
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [3] |
BUYS S S, SANDBACH J F, GAMMON A, et al. A study of over 35 000 women with breast cancer tested with a 25-gene panel of hereditary cancer genes[J]. Cancer, 2017, 123(10): 1721-1730. DOI:10.1002/cncr.30498 |
| [4] |
KUCHENBAECKER K B, HOPPER J L, BARNES D R, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers[J]. JAMA, 2017, 317(23): 2402-2416. DOI:10.1001/jama.2017.7112 |
| [5] |
DE FELICE F, MARCHETTI C, MUSELLA A, et al. Bilateral risk-reduction mastectomy in BRCA1 and BRCA 2 mutation carriers: a meta-analysis[J]. Ann Surg Oncol, 2015, 22(9): 2876-2880. DOI:10.1245/s10434-015-4532-1 |
| [6] |
DOMCHEK S M, FRIEBEL T M, SINGER C F, et al. Association of risk-reducing surgery in BRCA1 or BRCA 2 mutation carriers with cancer risk and mortality[J]. JAMA, 2010, 304(9): 967-975. DOI:10.1001/jama.2010.1237 |
| [7] |
REBBECK T R, FRIEBEL T, LYNCH H T, et al. Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA 2 mutation carriers: the PROSE study group[J]. J Clin Oncol, 2004, 22(6): 1055-1062. DOI:10.1200/JCO.2004.04.188 |
| [8] |
NELSON H D, PAPPAS M, ZAKHER B, et al. Risk assessment, genetic counseling, and genetic testing for BRCA-related cancer in women: a systematic review to update the U.S. preventive services task force recommendation[J]. Ann Intern Med, 2014, 160(4): 255-266. |
| [9] |
KAUFF N D, DOMCHEK S M, FRIEBEL T M, et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study[J]. J Clin Oncol, 2008, 26(8): 1331-1337. DOI:10.1200/JCO.2007.13.9626 |
| [10] |
REBBECK T R, KAUFF N D, DOMCHEK S M. Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers[J]. J Natl Cancer Inst, 2009, 101(2): 80-87. DOI:10.1093/jnci/djn442 |
| [11] |
FINCH A, BEINER M, LUBINSKI J, et al. Salpingo-oophorectomy and the risk of ovarian, fallopian tube, and peritoneal cancers in women with a BRCA1 or BRCA2 mutation[J]. JAMA, 2006, 296(2): 185-192. DOI:10.1001/jama.296.2.185 |
| [12] |
DALY M B, PILARSKI R, BERRY M, et al. NCCN guidelines insights: genetic/familial high-risk assessment: breast and ovarian, version 2.2017[J]. J Natl Compr Canc Netw, 2017, 15(1): 9-20. DOI:10.6004/jnccn.2017.0003 |
| [13] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J]. 中国癌症杂志, 2019, 29(8): 609-680. DOI:10.19401/j.cnki.1007-3639.2019.08.009 |
| [14] |
KOLDEHOFF A, DANNER M, CIVELLO D, et al. Cost-effectiveness of targeted genetic testing for breast and ovarian cancer: a systematic review[J]. Value Health, 2021, 24(2): 303-312. DOI:10.1016/j.jval.2020.09.016 |
| [15] |
D'ANDREA E, MARZUILLO C, DE VITO C, et al. Which BRCA genetic testing programs are ready for implementation in health care? A systematic review of economic evaluations[J]. Genet Med, 2016, 18(12): 1171-1180. DOI:10.1038/gim.2016.29 |
| [16] |
MANCHANDA R, SUN L, PATEL S, et al. Economic evaluation of population-based BRCA1/BRCA2 mutation testing across multiple countries and health systems[J]. Cancers (Basel), 2020, 12(7): 1929. DOI:10.3390/cancers12071929 |
| [17] |
OFMAN J J, SULLIVAN S D, NEUMANN P J, et al. Examining the value and quality of health economic analyses: implications of utilizing the QHES[J]. J Manag Care Pharm, 2003, 9(1): 53-61. |
| [18] |
HUSEREAU D, DRUMMOND M, PETROU S, et al. Consolidated health economic evaluation reporting standards (CHEERS)-explanation and elaboration: a report of the ISPOR health economic evaluation publication guidelines good reporting practices task force[J]. Value Health, 2013, 16(2): 231-250. DOI:10.1016/j.jval.2013.02.002 |
| [19] |
MOHER D, SHAMSEER L, CLARKE M, et al. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P) 2015 statement[J]. Syst Rev, 2015, 4(1): 1. DOI:10.1186/2046-4053-4-1 |
| [20] |
MANCHANDA R, PATEL S, GORDEEV V S, et al. Cost-effectiveness of population-based BRCA1, BRCA2, RAD51C, RAD51D, BRIP1, PALB2 mutation testing in unselected general population women[J]. J Natl Cancer Inst, 2018, 110(7): 714-725. DOI:10.1093/jnci/djx265 |
| [21] |
PATEL S, LEGOOD R, EVANS D G, et al. Cost effectiveness of population based BRCA1 founder mutation testing in Sephardi Jewish women[J]. Am J Obstet Gynecol, 2018. |
| [22] |
MANCHANDA R, PATEL S, ANTONIOU A C, et al. Cost-effectiveness of population based BRCA testing with varying Ashkenazi Jewish ancestry[J]. Am J Obstet Gynecol, 2017, 217(5): 578. e1-578. e12. DOI:10.1016/j.ajog.2017.06.038 |
| [23] |
KEMP Z, TURNBULL A, YOST S, et al. Evaluation of cancer-based criteria for use in mainstream BRCA1 and BRCA2 genetic testing in patients with breast cancer[J]. JAMA Netw Open, 2019, 2(5): e194428. DOI:10.1001/jamanetworkopen.2019.4428 |
| [24] |
TUFFAHA H W, MITCHELL A, WARD R L, et al. Cost-effectiveness analysis of germ-line BRCA testing in women with breast cancer and cascade testing in family members of mutation carriers[J]. Genet Med, 2018, 20(9): 985-994. DOI:10.1038/gim.2017.231 |
| [25] |
HURRY M, ECCLESTON A, DYER M, et al. Canadian cost-effectiveness model of BRCA-driven surgical prevention of breast/ovarian cancers compared to treatment if cancer develops[J]. Int J Technol Assess Health Care, 2020, 36(2): 104-112. DOI:10.1017/S0266462319003519 |
| [26] |
SAITO S, NAKAZAWA K, NAGAHASHI M, et al. Cost-effectiveness of BRCA1/2 mutation profiling to target olaparib use in patients with metastatic breast cancer[J]. Per Med, 2019, 16(6): 439-448. DOI:10.2217/pme-2018-0141 |
| [27] |
MüLLER D, DANNER M, SCHMUTZLER R, et al. Economic modeling of risk-adapted screen-and-treat strategies in women at high risk for breast or ovarian cancer[J]. Eur J Health Econ, 2019, 20(5): 739-750. DOI:10.1007/s10198-019-01038-1 |
| [28] |
LIM K K, YOON S Y, MOHD T N, et al. Is BRCA mutation testing cost effective for early stage breast cancer patients compared to routine clinical surveillance? The case of an upper middle-income country in Asia[J]. Appl Health Econ Health Policy, 2018, 16(3): 395-406. DOI:10.1007/s40258-018-0384-8 |
| [29] |
SIMOES CORREA-GALENDI J, DEL PILAR ESTEVEZ DIZ M, STOCK S, et al. Economic modelling of screen-and-treat strategies for Brazilian women at risk of hereditary breast and ovarian cancer[J]. Appl Health Econ Health Policy, 2021, 19(1): 97-109. DOI:10.1007/s40258-020-00599-0 |
| [30] |
SUN L, BRENTNALL A, PATEL S, et al. A cost-effectiveness analysis of multigene testing for all patients with breast cancer[J]. JAMA Oncol, 2019, 5(12): 1718-1730. DOI:10.1001/jamaoncol.2019.3323 |
| [31] |
NORUM J, GRINDEDAL E M, HERAMB C, et al. BRCA mutation carrier detection. A model-based cost-effectiveness analysis comparing the traditional family history approach and the testing of all patients with breast cancer[J]. ESMO Open, 2018, 3(3): e000328. DOI:10.1136/esmoopen-2018-000328 |
| [32] |
ZHANG L, BAO Y N, RIAZ M, et al. Population genomic screening of all young adults in a health-care system: a cost-effectiveness analysis[J]. Genet Med, 2019, 21(9): 1958-1968. DOI:10.1038/s41436-019-0457-6 |
| [33] |
杜春艳. 乳腺癌多基因面板测序的成本效果分析[J]. 中国卫生政策研究, 2017, 10(11): 59-66. DOI:10.3969/j.issn.1674-2982.2017.11.010 |
| [34] |
LI Y H, ARELLANO A R, BARE L A, et al. A multigene test could cost-effectively help extend life expectancy for women at risk of hereditary breast cancer[J]. Value Health, 2017, 20(4): 547-555. DOI:10.1016/j.jval.2017.01.006 |
| [35] |
ASPHAUG L, MELBERG H O. The cost-effectiveness of multigene panel testing for hereditary breast and ovarian cancer in Norway[J]. MDM Policy Pract, 2019, 4(1): 2381468318821103. DOI:10.1177/2381468318821103 |
| [36] |
YHEC. Patient-level simulation model[EB/OL]. [2021-03-03]. https://yhec.co.uk/glossary/patient-level-simulation-model/.
|
| [37] |
刘国恩. 中国药物经济学评价指南2020(中英双语版)[M]. 北京: 中国市场出版社, 2020.
|
| [38] |
VEMER P, CORRO RAMOS I, VAN VOORN G A K, et al. AdViSHE: a validation-assessment tool of health-economic models for decision makers and model users[J]. Pharmaco Economics, 2016, 34(4): 349-361. DOI:10.1007/s40273-015-0327-2 |
| [39] |
BüYüKKARAMIKLI N C, RUTTEN-VAN MÖLKEN M P M H, SEVERENS J L, et al. TECH-VER: a verification checklist to reduce errors in models and improve their credibility[J]. PharmacoEconomics, 2019, 37(11): 1391-1408. DOI:10.1007/s40273-019-00844-y |
| [40] |
KENT S, BECKER F, FEENSTRA T, et al. The challenge of transparency and validation in health economic decision modelling: a view from mount hood[J]. PharmacoEconomics, 2019, 37(11): 1305-1312. DOI:10.1007/s40273-019-00825-1 |
| [41] |
EDDY D M, HOLLINGWORTH W, CARO J J, et al. Model transparency and validation: a report of the ISPOR-SMDM modeling good research practices task force-7[J]. Med Decis Making, 2012, 32(5): 733-743. DOI:10.1177/0272989X12454579 |
| [42] |
CHEN S N, PARMIGIANI G. Meta-analysis of BRCA1 and BRCA2 penetrance[J]. J Clin Oncol, 2007, 25(11): 1329-1333. DOI:10.1200/JCO.2006.09.1066 |
| [43] |
MANCHANDA R, BURNELL M, ABDELRAHEIM A, et al. Factors influencing uptake and timing of risk reducing salpingo-oophorectomy in women at risk of familial ovarian cancer: a competing risk time to event analysis[J]. BJOG, 2012, 119(5): 527-536. DOI:10.1111/j.1471-0528.2011.03257.x |
| [44] |
BROSE M S, REBBECK T R, CALZONE K A, et al. Cancer risk estimates for BRCA1 mutation carriers identified in a risk evaluation program[J]. J Natl Cancer Inst, 2002, 94(18): 1365-1372. DOI:10.1093/jnci/94.18.1365 |
| [45] |
GHOSH K, HARTMANN L C. Current status of prophylactic mastectomy[J]. Oncology (Williston Park), 2002, 16(10): 1319-1325, 1329-1330, 1332. |
| [46] |
STROM C M, RIVERA S, ELZINGA C, et al. Development and validation of a next-generation sequencing assay for BRCA1 and BRCA2 variants for the clinical laboratory[J]. PLoS One, 2015, 10(8): e0136419. DOI:10.1371/journal.pone.0136419 |
| [47] |
PARKER W H, FESKANICH D, BRODER M S, et al. Long-term mortality associated with oophorectomy compared with ovarian conservation in the nurses' health study[J]. Obstet Gynecol, 2013, 121(4): 709-716. DOI:10.1097/AOG.0b013e3182864350 |
 2022, Vol. 25
2022, Vol. 25


