生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品[1]。自2006年欧洲药品管理局(European Medicines Agency,EMA)批准全球第一个生物类似药以来,此类药物以较低的价格逐步推动市场竞争、降低生物药费用、提高药品可支付性和可获得性[2]。
德国目前已有19个品种的生物类似药上市。生物类似药与化学仿制药定价管理方式相同,均采用参考价格组的形式确定医疗保险(以下简称“医保”)支付标准。价格组结合药品属性、市场竞争等情况,按照活性成分、药理作用、适应证等标准划分,已形成相对成熟的法律依据和实施框架。分组情况体现德国药品管理部门在生物类似药价格管理实践中,对其结构复杂性、免疫原性、与原研药可比性、多适应证等特点的态度和考量。现对德国生物类似药定价分组情况进行案例分析,关注其分组过程中针对生物类似药特殊性的考量,以期为完善我国生物类似药相关管理政策提供参考。
1 德国生物类似药上市情况和参考价格组分类概述 1.1 德国生物类似药上市品种截至2022年5月27日,共有71个生物类似药在德国上市,涉及19个品种(表 1)。首个上市的生物类似药为生长激素Genotropin®的生物类似药Omnitrope®,由山德士在2006年申请上市[3]。
| 表 1 德国生物类似药上市情况 |
|
|
内部参考价格组分为3类: 第一类为相同活性成分的药品,第二类为药理学及治疗学可比药品,第三类为具有相同适应证的复方制剂(表 2)[4],已过专利保护期的原研药和生物类似药可被纳入参考价格组同组管理。
| 表 2 德国药品参考价格分组 |
|
|
德国已上市的19种生物类似药中,3种按第一类管理,6种按第二类管理,尚未有品种纳入第三类管理。此外,10种药品未进行分组,具体是生长激素、门冬胰岛素、甘精胰岛素、赖脯胰岛素、贝伐珠单抗、重组人促卵泡激素、雷珠单抗、利妥昔单抗、特立帕肽、曲妥珠单抗,可能与品种分组难度大、市场竞争不充分等多种因素有关。
1.3 参考价格组的作用 1.3.1 对生物药价格的影响参考价格组是德国管理生物类似药价格的主要措施之一。德国并不通过官方管理措施直接确定生物类似药价格,而是划分不同的参考组,根据组内药品国内价格水平确定医保支付标准上限,药品超出医保支付上限部分需患者自付,从而间接管理生物类似药价格。
未按参考价格组管理的生物类似药医保全额报销,但药品上市许可持有人需按照销售额的7%向全国法定医保基金协会(GKV-Spitzenverband, GKV-SV)返还费用。
1.3.2 对生物药临床使用的影响形成参考价格组并不代表组内生物药可自动替代或需强制替代。尤其对按第二类参考价格组管理的药品来说,在临床选择中,仍由医师根据实际情况选择适宜的药品。将药品价格管理与临床替代使用分离,在促进生物药降价的同时,从一定程度上减少了生物类似药替代的问题。
1.4 参考价格组分组流程在确定生物类似药参考价格组的分类时,包括提议、审议、决议3个阶段(图 1)。在提议阶段,由GKV-SV向联邦联合委员会(Gemeinsamer Bundesausschuss, G-BA)提议组建新的参考价格组或将药品纳入已有参考价格组管理。
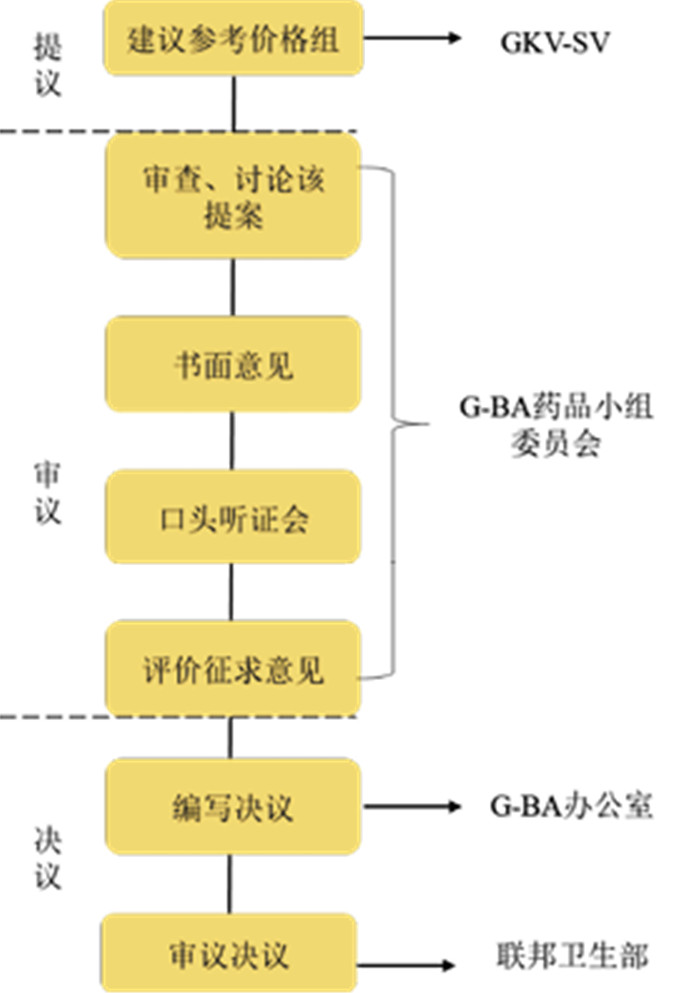
|
注: GKV-SV为德国法定医疗保险基金协会(GKV-Spitzenverband);G-BA为德国联邦联合委员会(Gemeinsamer Bundesausschuss)。 图 1 德国药品参考价格组设定流程 |
审议阶段由G-BA对提议进行效益评估并启动征求意见程序,将提议草案发送给德国制药工业协会(Bundesverband der Pharmazeutischen Industrie e. V, BPI)、德国研究型制药公司协会(Verband Forschender Arzneimittelhersteller e. V, vfa)、德国医学药物委员会(Arzneimittelkommission der Deutschen Ärzteschaft, AcdÄ)、德国药剂师协会(Bundesvereinigung Deutscher Apothekerverbände, ABDA)等行业协会及患者组织。医学专家、药学专家、制药企业代表、药剂师及患者代表等利益相关方通过协会或组织获得草案信息,并向G-BA递交书面意见。G-BA根据收到的书面意见组织口头听证会,并综合考虑意见作出初步决议。
G-BA办公室对决议进行评估,根据《社会第五法典》(Sozialgesetzbuch Fünftes Buch, SGB-Ⅴ)第91条的规定编制和汇总决议草案、决策理由和文件摘要,提交至联邦卫生部。联邦卫生部如无异议,则发布联邦公告公布参考价格组分类信息;如存在异议,则交由G-BA药品小组委员会重新讨论和审核提议[5]。
2 相同活性成分生物类似药分组案例分析 2.1 分组方式相同活性成分的药品按第一类分组,同组药品根据影响疗效的按生物利用度差异划分亚组,以数字1、2、3……依次表示。
纳入第一类管理的品种现有人胰岛素、非格司亭、英夫利西。其中,人胰岛素根据作用时间划分为长效中效组、速效组和预混胰岛素3个亚组。依那西普和人生长激素曾按相同活性成分分组管理,后因市场格局变化调出。
2.2 人胰岛素组 2.2.1 分组情况人胰岛素设立参考价格组的征求意见程序于2013年8月6日启动,书面意见及口头听证会均邀请了诺和诺德、赛诺菲、礼来3家公司参加[6]。在启动征求意见程序时,德国共有Actraphane®、Insuman®等6种人胰岛素上市。经过书面意见、口头听证等程序,最终确定按照起效时间、剂型等将人胰岛素分为3个亚组(表 3)[7]。决议在2014年9月18日公布,2014年11月18日生效[8]。
| 表 3 人胰岛素分组情况 |
|
|
(1)注射辅助装置。胰岛素使用中包括胰岛素预填充笔、胰岛素注射器、胰岛素泵等不同给药方式。在征求意见阶段,公司认为应当考虑不同给药方式的生产成本、临床效益、患者互换成本,建议根据注射辅助装置划分亚组[9-10]。G-BA方面则关注不同给药方式的临床疗效差异,考虑到胰岛素泵对于特殊人群的作用,将专用于胰岛素泵的胰岛素排除在分组外;预填充笔与胰岛素注射笔等装置的使用均需要专业培训,其差异可通过护理、培训等方式弥补,不足以作为区分亚组的依据。
(2)预混胰岛素分组。根据起效时间/作用时间的不同,G-BA将人胰岛素分为速效组、长效中效组和预混胰岛素组3个亚组分别确定医保支付上限。公司提出预混胰岛素组成中不同成分比例不尽相同,可对该亚组进一步细分。对此,G-BA答复称人用胰岛素的效应特征取决于多种因素,专家意见只能提供指示性信息,根据其混合比例进一步形成参考价格亚组既无法准确界定分组也不符合临床使用习惯,因此未予采纳。
(3)儿童用药。在征求意见过程中,赛诺菲主张其提供的40 IU/ml胰岛素相比100 IU/ml规格,可以更方便获取小剂量胰岛素,且含量较低时从皮下组织进入血液吸收往往更快,可更有效地控制餐后血糖水平。因其仅供儿童和青少年使用,市场规模较小导致成本更高,因此不应被纳入分组。G-BA则通过专家咨询及临床指南判断40 IU/ml与100 IU/ml药代动力学及药效学参数相同,且40 IU/ml可通过100 IU/ml稀释后替代,不存在临床优势。此外,G-BA还以国际市场中40 IU/ml已几乎不再出售来佐证该剂量并无“儿童适用”的临床价值,最终未予采纳。
2.3 非格司亭组 2.3.1 分组情况非格司亭设立参考价格组的征求意见程序于2017年6月启动,最终决议于2018年5月公布,2018年7月4日生效[11-12]。在启动征求意见程序时,非格司亭已有7种生物类似药在德国获批上市,且最早获批的生物类似药Hexal®(上市时间2009年2月1日)已上市8年有余。
2.3.2 分组中的关键问题(1)生物类似药与原研药差异性。制药公司强调生物类似药与原研药并非完全相同的活性成分,存在异质性及差异,并且没有证据表明生物类似药之间具有相同的生物利用度。G-BA则根据《联邦联合委员会议事规则》(Verfahrensordnung des Gemeinsamen Bundesausschusses, VerfO)对相同活性成分的定义,认为生物类似药与原研药可视为相同活性成分[13]。
(2)儿童用药。公司提出较小剂量(12 000/0.2 ml)可降低儿童的毒性风险,减少公共资源浪费,并援引《澳大利亚非格司亭的公共评估报告》(Australian Public Assessment Report for Filgrastim)内容作为依据,建议将该剂量排除在参考价格组外。G-BA关注临床实践中儿童是否仅可使用小剂量药品,认为非格司亭在使用时需用葡萄糖溶液稀释,不同剂量并无明显临床疗效差别,且与30 000/0.5 ml的常用规格相比,较小剂量仅是减少药品体积,无实质性差异。因此,不予支持12 000/0.2 ml剂量以儿童专用剂量为由排除分组[14-15]。
2.4 英夫利西组 2.4.1 分组情况英夫利西单抗设立参考价格组征求意见程序于2016年12月6日启动,最终决议在2017年11月17日公布,2018年1月13日生效[16-17]。在启动征求意见程序时,已有3种英夫利西单抗生物类似药上市,分别是辉瑞公司的Inflectra®(2013年9月1日)和三星生物制药公司的Flixabi®(2016年5月26日)。
2.4.2 分组中的关键问题与非格司亭组类似,英夫利西组的焦点问题也集中于生物类似药和原研药是否为相同活性成分以及是否可互换[18-19]。公司认为,英夫利西单抗作为单克隆抗体,其复杂程度明显高于非格司亭等重组蛋白类生物制品,不同细胞系导致生物类似药(Flixabi®,CHO细胞)及原研药(Remicade®,Maus细胞)存在糖基化的微小差异,并以EMA与联邦药物和医疗器械研究所(Bundesinstitut für Arzneimittel und Medizinprodukte, BfArM)均要求英夫利西生物类似药接受额外监测为由,认为原研药与生物类似药不完全一致,尚不足以成立该组[20]。
G-BA则主要依据EMA审评报告,认为糖基化差异以及C端氨基酸差异不影响药品安全性及有效性,获得生物类似药上市授权则意味着与原研药相比其质量、疗效和安全性得到证明,可被归类为可比较的产品。
3 药理学及治疗可比生物类似药分组案例分析 3.1 分组方式药理学和治疗可比的药品按第二种分组,该组形成基础是世界卫生组织发布的解剖学治疗学及化学分类(Anatomical Therapeutic Chemical, ATC),以ATC-4级为分组依据,根据疗效差异、临床需求等因素划分不同亚组。
纳入第二类管理的品种现有阿达木单抗、依那西普、重组促红细胞生成素α、重组促红细胞生成素ζ、硫培非格司亭、依诺肝素钠。
门冬胰岛素、甘精胰岛素、赖脯胰岛素3种胰岛素类似物曾按“药理学及治疗可比”原则提出分组,但最终由于临床使用受限、分组理由矛盾等因素未予以实施[21]。依诺肝素钠为G-BA成立前设立分组,未查阅到分组形成文件。
3.2 TNF-α抑制剂 3.2.1 分组情况TNF-α抑制剂组目前包括培塞利珠单抗、阿达木单抗、依那西普、戈利木单抗等4个品种(表 4)。该组别征求意见程序于2019年9月10日启动,最终决议在2020年11月20日公布,2021年1月19日生效[22-23]。在启动征求意见程序时,原依那西普分组尚未正式实施,有2个生物类似药在德国上市;阿达木单抗有6个生物类似药在德国上市;培塞利珠单抗、戈利木单抗尚无生物类似药获批。
| 表 4 第二类参考价格组TNF-α抑制剂 |
|
|
该组形成的药理学依据是活性物质均为肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)抑制剂(ATC代码L04AB),通过与促炎症细胞因子TNF-α结合,阻断TNF与细胞p55和p75 TNF受体的相互作用发挥其药理作用。治疗学可比性基于4种药品均可治疗中轴型脊柱关节炎、银屑病关节炎、类风湿关节炎[24]。
3.2.2 分组中的关键问题(1)药理学可比性。4种药品均为TNF-α抑制剂,但药理机制并不完全相同。如阿达木单抗和戈利木单抗作为双价单克隆抗体可以结合2个TNF-α,依那西普与培塞利珠单抗均与一个TNF形成复合物,形成较小的1:1复合物,公司认为这种不同可能会导致免疫原性的差异。此外,体外研究表明,依那西普与阿达木单抗Fc区构型不同导致其诱发补体依赖的细胞毒性(complement dependent cytotoxicity, CDC)或抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-medicated cytotoxicity, ADCC)反应强度不同,这可能导致2种药品细胞毒性作用强弱差异。G-BA认为上述差异属于ATC-4级分类下的进一步差别,没有临床试验或真实世界证据证明其在临床终点具有差别,因此不作为排除分组的依据。
(2)免疫原性。在书面意见反馈中,公司根据1份涉及68项实验的荟萃研究报告及Thomas等2015年发表的文章指出,不同TNF-α抑制剂免疫原性存在较大差异,不应同组管理。G-BA则援引欧盟公众评估报告(EPAR)和专家信息指出,组内所有生物药均会在部分患者体内引起免疫原性,并可能降低疗效。多种因素可诱发免疫原性的产生,包括疾病进程、用药剂量、给药途径、合并用药、遗传因素等。因此,不能以特定人群中某种药品免疫原性低作为该药品具有临床治疗优势的依据。
(3)多适应证。征求意见中,公司认为划入该组的4种药物适应证不完全相同,且有3种适应证仅阿达木单抗获批(表 5),会限制临床选择,因此不符合分组条件。G-BA则认为充分临床选择既包括不同药品可以治疗同一适应证,如溃疡性结肠炎和斑块状银屑病组内均有超过1种药品可以治疗,也包括适应证仅有1种药品可以治疗但存在生物类似药的情况,如该组中仅有阿达木单抗可治疗葡萄膜炎,但阿达木单抗已获批6个生物类似药[25]。值得注意的是,同为TNF-α抑制剂的英夫利西单抗,G-BA以临床需求为由未划入该组,但并未在《决议理由》中给出具体原因,仅在《摘要》中提及这与保障适应证克罗恩病的临床选择有关[26]。
| 表 5 TNF-α抑制剂组活性成分适应证 |
|
|
(4)儿童用药。在规格方面,若专业资料表明仅用于儿童及青少年,且使用剂量与体重相关,则G-BA将其排除在分组外。G-BA未以书面形式划定专业资料范围,在实践中专业资料包括药品说明书、公开文献、临床指南以及专家意见等。因此,本组≤20 mg的阿达木单抗、≤10 mg的依那西普和≤45 mg的戈利木单抗未纳入参考价格组。
3.3 其他抗贫血药 3.3.1 分组情况该参考价格组于2007年2月形成,包括阿法达贝泊(darbepoetin alfa)、阿法依伯汀(epoetin alfa)和倍他依泊汀(epoetin beta)3种药物。2007年11月15日,epoetin delta被纳入该组;2008年11月18日,epoetin zeta生物类似药上市1年后被纳入该组管理;2009年9月17日,epoetin的长效制剂被纳入该组管理;2010年9月16日,epoetin theta被纳入管理。目前,该参考价格组共8种药品(表 6)[27-28]。
| 表 6 第二类参考价格组其他抗贫血药组 |
|
|
该组成立的药理学依据为活性物质与红细胞祖细胞上的红细胞生成素受体结合后,刺激红细胞增殖、分化和抵抗凋亡,从而特异性地促进红细胞的形成。治疗学可比性是基于该组内药品均可治疗肾性贫血。
3.3.2 分组中的关键问题公司关注该组部分药品导致个别患者的严重不良反应(形成抗促红素抗体并伴有严重贫血),甚至引发纯红细胞再生障碍性贫血(pure red-cell anemia,PRCA)的报道,推断该组药品间存在疗效差异,不能形成分组。
G-BA根据文献及美国食品药品监督管理局(FDA)的评估报告指出,该不良反应主要出现在使用Eprex®(epoetin alfa)的患者中,这种现象不是由于活性成分差异,而是由于辅料差异产生,因此不能作为排除分组的理由。
3.4 聚乙二醇化集落刺激因子 3.4.1 分组情况聚乙二醇化集落刺激因子组目前包括硫培非格司亭、聚乙二醇化非格司亭(表 7)。该组别的征求意见程序于2020年12月8日启动,最终决议于2021年9月16日公布,2021年11月6日生效[29-30]。在启动征求意见程序时,聚乙二醇化非格司亭(pegfilgrastim)的第一个生物类似药已于2018年9月21日上市,德国尚无硫培非格司亭(lipegfilgrastim)生物类似药获批。
| 表 7 第二类参考价格组聚乙二醇化集落刺激因子 |
|
|
该组成立的药理学依据为活性物质都属于集落刺激因子(ATC代码L03AA),调节中性粒细胞的形成及其从骨髓中的释放,且这2种活性物质均为长效制剂。治疗学可比性基于“减少细胞毒性化疗后中性粒细胞减少的持续时间和发热性中性粒细胞减少的发生率”这一适应证[31]。
3.4.2 分组中的关键问题(1)疗效差异。硫培非格司亭和聚乙二醇化非格司亭的乙酰基位置不同。有公司提出这会导致2种药品药代动力学、免疫原性、不良反应等实验室指标的差异。G-BA则重点关注这些指标差异是否带来临床主要终点和次要终点的差异。对于治疗性改善的证据选择,G-BA强调应当在随机盲法的对照研究中得到证明,其方法需符合国际标准,并且具有治疗意义[32-33]。此外公司还关注较高体重(>95 kg)患者可能存在的聚乙二醇化非格司亭药效学反应降低情况。G-BA指出,在个案中选择合适的制剂是医生的决定,参考价格组的形成并不限制医生的用药选择。
(2)未来效益。公司关注硫培非格司亭正在审批的适应证未来可能获得新的临床效益,认为分组时应予以考虑,而G-BA分组时仅依据当前医药市场情况,市场发生变化后会依据新的市场情况进行调整。
4 分组影响因素对德国生物类似药参考价格组分组梳理发现,制药行业及G-BA等各方关注的问题和争议点主要聚焦2个方面: 一是是否符合分组成立的基本条件,二是部分药品是否可以被豁免分组。
4.1 成立条件是否符合分组条件是各方讨论的焦点问题。因第一类、第二类分组原则不同,实践中利益相关方对两类分组成立条件关注侧重有所不同。
第一类参考价格组形成条件为“相同活性成分”,实践中体现为同通用名药物。制药行业认为同通用名生物药生产过程中使用不同细胞系、化学结构存在差异,不是“相同活性成分”。G-BA强调根据VerfO,生物类似药与原研药符合“相同活性成分”的定义。生物类似药获批上市代表其与原研药具有可比性。值得注意的是,在参考价格组形成文件中,除引用VerfO,G-BA多使用原研药与生物类似药“等效”而非“相同”的表述。
第二类参考价格组形成原则为“药理学和治疗学可比性,不限制临床选择”,实践中体现为生物类似药属于同一ATC-4级分类,有相同适应证且每种适应证有超过1种商品名药品可供选择。
4.2 豁免因素豁免因素主要体现在疗效改善和儿童用药两方面。治疗性改善的关注焦点主要在免疫原性、疗效改善、不良反应差异等3种情形。对于不良反应差异和疗效改善,G-BA强调指标应选取与临床终点密切相关的,其证据选择应当在符合国际标准的随机盲法对照试验中得到证明,并且具有治疗意义。考虑参考价格组形成后的影响范围,在目前的分组实践中,特定人群免疫原性较低的药品不会被豁免分组,而是由临床医生在实践中根据患者情况选择适宜药品。
儿童用药是德国生物药豁免参考价格组的重要考量之一,在已有的生物类似药分组实例中,共3个组别涉及儿童用药的豁免。目前G-BA采纳“仅儿童使用”和获批儿童专用适应证2种情形作为豁免分组因素。人胰岛素组“小剂量药品,临床可由其他剂量替代”情形和非格司亭组“浓度相同的小体积药品”未被G-BA认定为可豁免分组条件。
5 启示及建议 5.1 德国生物类似药参考价格组分组特点 5.1.1 以行业协会为纽带,利益相关方参与度高德国生物类似药参考价格组制定过程中,G-BA根据法律规定将提议草案发送给相关行业协会,通过协会力量传达信息,信息传递较为有序高效。制药公司、临床医师、药剂师、患者等可以通过所在协会(组织)和G-BA官网获知分组信息,以书面意见或口头听证会的形式参与意见陈述。G-BA需对意见进行审理与答复,并将其公布在《决议摘要》中,决议在一定程度上体现了各方博弈的结果,更加科学合理。
5.1.2 以相同活性成分分组为基础,药理学及疗效可比分组成为趋势从德国已上市的生物类似药价格分组来看,药理学及疗效可比分组的比例明显高于化学药。该分组方式对相同靶点的不同药物在价格上有一定的协同制约机制,有助于刺激公司开发新靶点,避免对同一靶点的重复开发与低效创新。不过,对于发展尚不充分的生物药产业来说,较早开展“药理学及疗效可比”分组可能不利于生物类似药的研发投入。
5.1.3 分组管理注重临床疗效,兼顾儿童用药特殊性在德国生物类似药分组管理中,对于分组因素的考量,G-BA多从临床使用角度出发,分组保证临床的充分选择,对于临床主要终点、次要终点有改善的生物药,可豁免分组。此外,德国SGB-V第35条规定,参考价格组设定需考虑儿童适用剂型。在生物类似药分组实践中,G-BA从专家意见、说明书、临床指南等多种信息判断“儿童适用剂型”。在目前德国生物类似药分组案例中,仅儿童专用剂量和获批儿童适应证可被G-BA判定为符合“儿童适用情况”,不纳入参考组。
5.1.4 根据市场情况适时建立、动态调整分组G-BA根据市场竞争状况对生物类似药适时进行分组管理,已设立分组的生物类似药大多在首个生物类似药上市3年内进行分组管理。分组主要目的是引发有效的价格竞争,以最经济的供应方案为导向。因此,G-BA会根据临床使用及市场规模对动态调整分组。如依那西普在生物类似药上市后按相同活性成分分组,后由于TNF-α抑制剂药品增多且有相同适应证,以“药理学及治疗可比性”原则重新进行分组。第二类参考价格组“其他抗贫血药品”,自2007年形成时包含3种活性成分,经过不断调整,至2022年已增加为8种活性成分。
5.2 对我国的启示和建议目前,我国生物药产业正快速发展。2019年2月,国家药品监督管理局批准复宏汉霖研制的汉利康(利妥昔单抗注射液)上市,用于非霍奇金淋巴瘤的治疗,为我国上市的首个生物类似药。截至2022年4月底,NMPA已批准上市20个单抗类生物类似药,涉及5种原研药。2021年,国务院办公厅发布《关于推动药品集中带量采购工作常态化制度化开展的意见》,提出探索对适应证或功能主治相似的不同通用名药品合并分组[33]。2021年底开展的胰岛素国家专项采购,兼顾临床特点,分为11个报价单元分别竞价。未来在单抗类生物类似药价格发现过程中,分组方式也将在一定程度上影响单抗药物的价格形成。现基于德国的生物类似药参考价格组管理经验,对我国单抗药物价格管理政策提出如下建议。
首先,提高利益相关方参与程度。生物类似药价格形成和调整政策涉及供应保障、临床使用、产业发展等多个方面,需要多方共同商议权衡。可以参考德国生物类似药参考价格组形成流程中信息沟通方式,通过行业协会等力量,提高各方的参与度,兼顾利益平衡。
其次,关注儿童用药情况。在广东联盟单抗药物集中采购中,已有分组规则规定“仅限于儿童使用的药品单独分组”,但尚未有药品适用这一规定[34]。建议未来国家层面同样考虑儿童用药的特殊性,并参考德国对“儿童适用”标准的实践,结合我国临床使用经验,科学、合理制定生物类似药价格管理政策。
最后,探索合理的生物类似药分组方式。德国在参考价格组形成中兼顾药品属性、临床使用、市场竞争等因素,不同品种分组方式相对独立,并根据医保数据、药品上市情况等进行动态调整。我国目前尚未形成系统的药品价格管理分组方式,建议结合我国生物类似药品种成熟度、临床经验、市场规模、产业基础等因素,探索精细长效的分组管理体系,明确启动条件、分组流程和动态调整方式等,建立规范化、科学化的生物类似药价格形成管理体系。
·作者声明本文无实际或潜在的利益冲突
| [1] |
国家食品药品监督管理总局. 生物类似药研发与评价技术指导原则(试行)[EB/OL]. [2022-06-25]. www.mpagov.cn/WS04/CL2138/300003.html.
|
| [2] |
徐巍巍, 吴晶. 欧洲生物类似药市场准入政策解读与思考[J]. 中国药物经济学, 2018, 13(11): 16-21. |
| [3] |
Vfa. Zugelassene gentechnische arzneimittel in Deutschland[EB/OL]. [2022-05-27]. https://www.vfa-bio.de/vb-de/aktuelle-themen/arzneimittel-datenbanken-vb/amzulassungen-gentec.html.
|
| [4] |
BMJ. Sozialgesetzbuch(SGB)Fünftes Buch(V)§35 Festbeträge für Arznei- und Verbandmittel[EB/OL]. [2022-05-26]. https://www.gesetze-im-internet.de/sgb_5/_35.html.
|
| [5] |
常峰, 崔鹏磊, 夏强, 等. 德国药品参考价格体系对构建我国医保支付标准的启示[J]. 中国卫生政策研究, 2015, 8(7): 55-60. |
| [6] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Einleitung eines Stellungnahmeverfahrens-Festbetragsgruppenbildung Humaninsulin, Gruppe 1 bis 3, in Stufe 1 [EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/1794/.
|
| [7] |
G-BA. Humaninsulin, Gruppe 1 bis 3 Beschlusstext[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/39-261-2068/2014-09-18_AM-RL-IX_Humaninsulin_G1-3S1_BAnz.pdf.
|
| [8] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Festbetragsgruppenbildung Humaninsulin, Gruppe 1 bis 3, in Stufe 1[EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/2068/.
|
| [9] |
G-BA. Humaninsulin, Gruppe 1 bis 3 Tragende Gründe zum Beschluss[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-2956/2014-09-18_AM-RL-IX_Humaninsulin_G1-3S1_TrG.pdf.
|
| [10] |
G-BA. Humaninsulin, Gruppe 1 bis 3 Zusammenfassende Dokumentation[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-2957/2014-09-18_AM-RL-IX_Humaninsulin_G1-3S1_ZD.pdf.
|
| [11] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Einleitung eines Stellungnahmeverfahrens-Festbetragsgruppenbildung Filgrastim, Gruppe 1, in Stufe 1[EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/3003/.
|
| [12] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Festbetragsgruppenbildung Filgrastim, Gruppe 1, in Stufe 1[EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/3339/.
|
| [13] |
G-BA. Filgrastim Beschlusstext[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/39-261-3339/2018-05-17_AM-RL-IX_Filgrastim_G1S1_BAnz.pdf.
|
| [14] |
G-BA. Filgrastim Tragende Gründe zum Beschluss[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-5008/2018-05-17_AM-RL-IX_Filgrastim_G1S1_TrG.pdf.
|
| [15] |
G-BA. Filgrastim Zusammenfassende Dokumentation[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-5009/2018-05-17_AM-RL-IX_Filgrastim_G1S1_ZD.pdf.
|
| [16] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Einleitung eines Stellungnahmeverfahrens-Festbetragsgruppenbildung Infliximab, Gruppe 1, in Stufe 1[EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/2787/.
|
| [17] |
G-BA. Arzneimittel-Richtlinie/Anlage IX: Infliximab, Gruppe 1, in Stufe 1[EB/OL]. [2022-06-18]. https://www.g-ba.de/beschluesse/3132/。.
|
| [18] |
G-BA. Infliximab Beschlusstext[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/39-261-3132/2017-11-17_AM-RL-IX_Infliximab_G1S1_BAnz.pdf.
|
| [19] |
G-BA. Infliximab Tragende Gründe zum Beschluss[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-4667/2017-11-17_AM-RL-IX_Infliximab_G1S1_TrG.pdf.
|
| [20] |
G-BA. Infliximab Zusammenfassende Dokumentation[EB/OL]. [2022-06-18]. https://www.g-ba.de/downloads/40-268-4668/2017-11-17_AM-RL-IX_Infliximab_G1S1_ZD.pdf.
|
| [21] |
G-BA. Arzneimittel-Richtlinie/ Anlage IX, X, Ⅲ: Festbetragsgruppenbildung und Aktualisierung von Vergleichsgrößen Humaninsulin und Analoga, Gruppe 1, 2 und 3 in Stufe 2, Übersicht der Verordnungseinschränkungen und -ausschlüsse Nummer 33 und 33a[EB/OL]. [2022-06-21]. https://www.g-ba.de/beschluesse/1661/.
|
| [22] |
G-BA. Arzneimittel-Richtlinie/Anlage IX und X: Einleitung eines Stellungnahmeverfahrens-Festbetragsgruppenbildung und Aktualisierung von Vergleichsgrößen TNF-alpha-Inhibitoren, Gruppe 1, in Stufe 2 sowie Aufhebung der Festbetragsgruppe Etanercept, Gruppe 1, in Stufe 1[EB/OL]. [2022-06-20]. https://www.g-ba.de/beschluesse/4550/.
|
| [23] |
G-BA. Arzneimittel-Richtlinie/Anlage IX und X: Festbetragsgruppenbildung und Vergleichsgrößenaktualisierung-TNF-alpha-Inhibitoren, Gruppe 1, in Stufe 2[EB/OL]. [2022-06-20]. https://www.g-ba.de/beschluesse/3972/.
|
| [24] |
G-BA. TNF-alpha-Inhibitoren Beschlusstext[EB/OL]. [2022-06-20]. https://www.g-ba.de/downloads/39-261-4550/2020-11-20_AM-RL-IX-X_TNF-alpha-Inhibitoren_G1S2_BAnz.pdf.
|
| [25] |
G-BA. TNF-alpha-Inhibitoren Tragende Gründe zum Beschluss[EB/OL]. [2022-06-20]. https://www.g-ba.de/downloads/40-268-7056/2020-11-20_AM-RL-IX-X_TNF-alpha-Inhibitoren_G1S2_TrG.pdf.
|
| [26] |
G-BA. TNF-alpha-Inhibitoren Zusammenfassende Dokumentation[EB/OL]. [2022-06-20]. https://www.g-ba.de/downloads/40-268-7057/2020-11-20_AM-RL-IX-X_TNF-alpha-Inhibitoren_G1S2_ZD.pdf.
|
| [27] |
G-BA. Arzneimittel-Richtlinie/ Anlage IX Antianämika, andere, Gruppe 1, in Stufe 2[EB/OL]. [2022-06-28]. https://www.g-ba.de/beschluesse/883/.
|
| [28] |
G-BA. Arzneimittel-Richtlinie/ Anlage IX Antianämika, andere, Gruppe 1, in Stufe 2[EB/OL]. [2022-06-28]. https://www.g-ba.de/beschluesse/1190/.
|
| [29] |
G-BA. Arzneimittel-Richtlinie/Anlage IX und X: Einleitung eines Stellungnahmeverfahrens-Festbetragsgruppenbildung und Aktualisierung von Vergleichsgrößen Koloniestimulierende Faktoren, pegyliert, Gruppe 1, in Stufe 2[EB/OL]. [2022-06-23]. https://www.g-ba.de/beschluesse/4603/.
|
| [30] |
G-BA. Arzneimittel-Richtlinie/Anlage IX und Anlage X: Festbetragsgruppenbildung und Vergleichsgrößenaktualisierung- Koloniestimulierende Faktoren, pegyliert, Gruppe 1, in Stufe 2[EB/OL]. [2022-06-23]. https://www.g-ba.de/beschluesse/5035/.
|
| [31] |
G-BA. Koloniestimulierende-Faktoren Beschlusstext[EB/OL]. [2022-06-23]. https://www.g-ba.de/downloads/39-261-5035/2021-09-16_AM-RL-IX-X_Koloniestimulierende-Faktoren_G1S2_BAnz.pdf.
|
| [32] |
G-BA. Koloniestimulierende-Faktoren Tragende Gründe zum Beschluss[EB/OL]. [2022-06-23]. https://www.g-ba.de/downloads/40-268-7871/2021-09-16_AM-RL-IX-X_Koloniestimulierende-Faktoren_G1S2_TrG.pdf.
|
| [33] |
G-BA. Koloniestimulierende-Faktoren Zusammenfassende Dokumentation[EB/OL]. [2022-06-23]. https://www.g-ba.de/downloads/40-268-7872/2021-09-16_AM-RL-IX-X_Koloniestimulierende-Faktoren_G1S2_ZD.pdf.
|
| [34] |
国务院办公厅. 国务院办公厅关于推动药品集中带量采购工作常态化制度化开展的意见: 国办发[2021]2号[A]. 2021.
|
| [35] |
广东省药品交易中心. 广东联盟双氯芬酸等药品集中带量采购文件[EB/OL]. [2022-06-29]. https://www.gdmede.com.cn/announcement/announcement/detail?id=1483598897170354176.
|
 2022, Vol. 25
2022, Vol. 25


