生物药(bio-therapeutics)是指采用生物技术制备的、临床上用于疾病治疗的大分子生物制品,具有结构复杂、异质性高等特点[1]。生物类似药的名字源自“biosimilar”的中文翻译,之所以称为类似药而不是仿制药,原因在于重组表达的生物大分子药物本身(包括原研药)的复杂且相对不均一的特性[2]。
由于研发的技术难度、临床研究的长时间及临床效果的不确定性,生物药研发投入成本高昂,上市后价格居高难下,普通患者难以承受。生物类似药的研发和上市极大地降低了患者使用负担,提高了生物药的可及性。生物药难以像小分子化学仿制药一样易于仿制并得到结构完全相同和均一的活性物质,故化学仿制药的评价原则和法规并不适用于生物类似药[3]。2006年欧盟率先提出“生物类似药”的概念及相关技术要求,随后,世界卫生组织、韩国、日本和美国也相继发布了生物类似药的相关技术要求。2015年2月国家食品药品监督管理总局颁布了《生物类似药研发与评价技术指导原则(试行)》(以下简称《指导原则》),文件明确生物类似药是指在质量、安全性和有效性方面与已获准上市的参照药具有相似性的治疗性生物制品[4]。《指导原则》基本与国际通行的世界卫生组织、美国食品药品监督管理局(FDA)和欧盟药品监督管理部门(EMA)执行的政策一致,主要有四大原则: 逐步递进原则、比对原则、相似性原则和一致性原则。在整个生物类似药的研发过程中,与参照药的比对贯穿始终,开发过程中所采用工艺、处方和分析方法等应与参照药保持一致(一致性原则);药学、非临床和临床的研发逐步递进,只有前面取得相似性的结论,后面的研究才能继续相似性评价(逐步递进和相似性原则)[5]。同时,《指导原则》也指出,此指导原则适用于结构和功能明确的治疗用重组蛋白质制品,因此,本文主要讨论重组表达的生物大分子的生物类似药。
生物大分子本身内在的复杂的结构性质和特点,生产工艺上的微小区别,如由不同宿主细胞生产的控制条件、表达环境及纯化制备过程和条件等,都可能使其类似药与参照药间在产品纯度、杂质种类和活性方面有所不同,从而产生安全、有效性的差异。因此,生物类似药的研发和生产与创新药相比有其本身的特点: 一方面其最突出的特点是在药物开发的各个阶段与参照药的相似性的对比贯穿始终;另一方面由于知识产权保护、参照药工艺保密等原因,生物类似药的生产工艺不可能与参照药完全一致,这也加大了相似性评估的难度。本文从生物类似药生产工艺开发的特点、生产放大的特点和质量研究的特点进行了分析,并佐以实例进行说明,以期为生物类似药的开发提供参考思路。
1 生物类似药生产工艺开发的特点与创新药可选择适合产品本身的工艺不同,生物类似药的生产工艺的开发主要围绕产品质量与参照药的相似性开展,一般采用“逆向工程”的研发策略(reverse engineering)。首先,尽可能地收集多批次、具有代表性的参照药,使用多种正交分析技术(以多种方式测量多个属性)对参照药进行详细分析,采用这些数据创建生物类似药可接受特征的边界。然后,采用“迭代模式”(iterative mode)进行生产工艺开发。通过在上游分子构建/克隆筛选、发酵/细胞培养、下游纯化等阶段反复优化,确定生物类似药的制备工艺可以生产出与参照药质量相似的产品。最后,通过对生物类似药和参照药进行充分的相似性比对研究,获得与参照药相同的临床适应证应用[6]。
1.1 上游工艺研发宿主细胞是生物药开发的基础,《指导原则》指出: “应考虑参照药所使用的宿主细胞,也可采用当前常用的宿主细胞。对与参照药不一致的,需进行研究证明与有效性、安全性等方面无临床意义的差别。”[4]由于生物药分子的复杂性,不同类型的宿主细胞往往会产生不同类型的杂质差异,如二硫键、翻译后修饰、糖基化等产品相关杂质的差异[7-8],这有可能会对后期与参照药相似性研究造成难以解决的困难。因此,企业在开发生物类似药时大多会选择与参照药相同的宿主细胞,只有在由于技术或专利等原因无法实现时才会选用其他宿主细胞,并进行充分的评估。
上游工艺条件比如培养基组成、pH、温度、溶氧等参数会对产品质量产生重要影响,尤其是翻译后修饰、糖基化等产品相关杂质。这些修饰由于在相对分子质量、电荷性质等方面与目的蛋白非常相似,因此难以通过纯化步骤去除,需要对上游工艺反复优化获得与参照药相似的产品纯度。例如,抗体的糖基化影响产品的有效性和安全性,不同糖型影响到抗体空间结构,进而影响Fc段介导的效应功能[9]。对生物类似药来说,糖基化作为主要的关键指标,在工艺开发过程中更需要注意与参照药的相似性。齐鲁制药有限公司开发的某单抗类生物类似药初期,发现与参照药的糖基化有明显差异,主要表现在去岩藻糖化糖(A-fuc)比例为参照药的1.3倍,导致抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)显著高于参照药。同时,半乳糖苷化糖(Gal)比例也高于参照药。通过培养工艺的优化和调整,从细胞密度、培养温度和补料体积等方面进行研究,结果表明,培养温度和培养后期的pH控制是影响糖型比例的关键控制条件,优化后产品质量与参照药基本一致,达到相似性要求。见图 1。
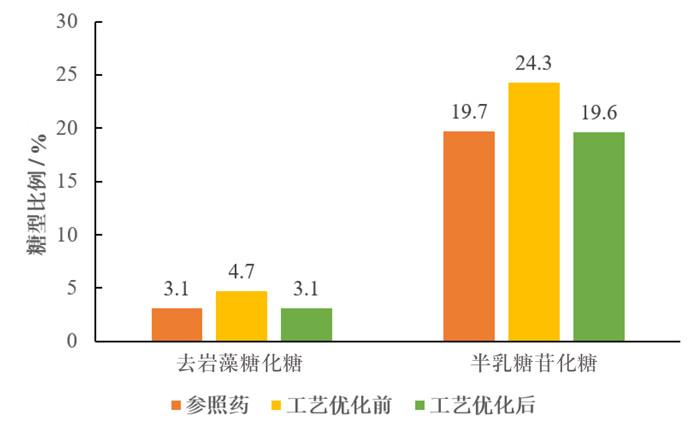
|
图 1 上游工艺优化前后糖型比例与参照药对比 |
生物药的下游纯化步骤主要目的为去除工艺相关杂质和产品相关杂质,获得高纯度的原液。生物类似药的开发关键点是产品质量与参照药的相似性,因此纯化工艺在生物类似药的开发中尤为重要。生物类似药的纯化步骤应根据产品特点设计,尽量与参照药保持一致,尤其是工艺步骤的原理和先后顺序及中间过程控制的要求[4]。由于知识产权等因素,生物类似药的生产商往往不能获得参照药生产过程的具体信息,增加了产品被精确复制的难度。生物类似物一般具有较为繁杂的分离纯化步骤,采用不同的纯化方法会得到不同的产品质量属性。需要综合分析参照药的关键质量属性,确定纯化工艺使用的层析、过滤等方法,纯化步骤的先后顺序及过程控制也会影响目标蛋白的纯度和活性等质量属性。此外,还要关注步骤中的温度、pH、缓冲液体系等都可能会影响目标蛋白的活性。
与创新药相比,生物类似药在下游纯化工艺开发中最大的挑战还是杂质的种类和含量与参照药的相似性。若存在未知杂质,则需要进行大量的分离鉴定工作,以证明杂质对安全有效性的影响,而这种鉴定和评估往往是非常困难的,因此去除未知杂质是最佳选择。在创新药开发过程中,痕量的杂质在工艺开发过程中可能不需要特别关注,但是在生物类似药的分离纯化过程中,除了需要根据蛋白自身的理化性质和纯化原理设置合理的纯化步骤,还要对比参照药质量对纯化步骤的参数进行反复优化,以期达到质量相似的目标。例如,齐鲁制药有限公司在PEG-G-CSF生物类似药(参照药Neulasta)的下游工艺开发过程中,初期工艺获得的产品在IEC-HPLC检测时发现拖尾杂质,含量大约0.8%,但参照药并不含有此杂质。通过大量的纯化工艺优化,包括筛选层析介质种类、优化层析上样和洗脱条件等方法,最终成功去除了此杂质,实现了与参照药的质量相似。见图 2。
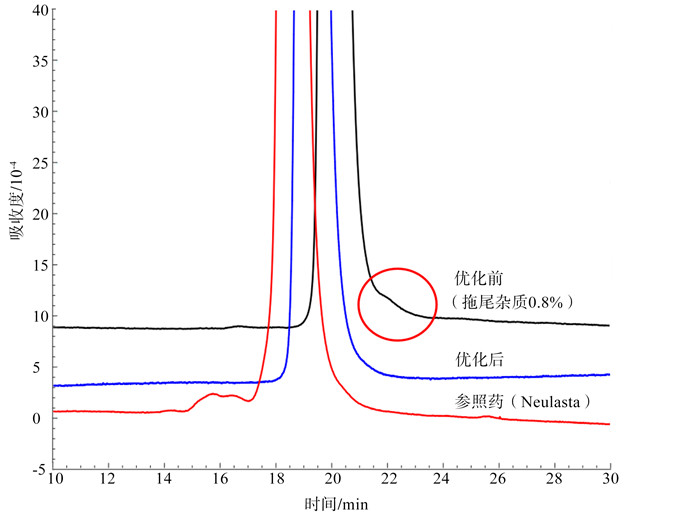
|
图 2 PEG-G-CSF生物类似药纯化工艺优化前后和参照药Neulasta的IEC-HPLC对比图谱 |
《指导原则》[4]规定,生物类似药应进行处方筛选研究,并尽可能与参照药一致。对不一致的,应有充足的理由。一般来说,制剂处方与参照药保持一致可以保证产品的稳定性、药代动力学等的一致性。但在现实中,企业开发时由于专利保护等原因,生物类似药的制剂处方可能无法与参照药一致。这种情况下,应对制剂处方进行充分的研究,比较产品质量、稳定性等,同时在临床前药理毒理研究和临床研究阶段进一步确证安全性和有效性的一致。
2 生物类似药生产放大的特点生物类似药在工艺开发完成后即需要进行逐级放大到商业化生产规模。在规模放大前,需由研发、生产、质量控制、质量保证等多部门联合进行规模差异风险评估,基于已获得的产品相关知识和经验,对放大前后的任何设备差异、工艺条件差异等进行风险分析,并对风险项进行研究。第一次在生产规模放大可先进行工程批(engineering batch)生产,用于收集工艺数据、质量数据和稳定性数据,这些数据对于后续的临床样品生产、工艺验证等非常有价值。
规模放大需要密切关注与规模相关的参数和工艺条件的变化对产品质量的影响,如上游工艺放大过程中搅拌和混匀的变化、下游工艺放大过程中引起的温度和工艺时长变化等,并将与参照药的质量对比研究贯穿其中。
工艺表征(process characterization)在生物类似药的工艺开发过程中也发挥着重要作用。本着质量源于设计的理念,候选药与参照药的质量相似性与工艺条件参数的设定息息相关。因此,在工艺表征时应同时充分考虑参照药质量的相似性范围和产品质量标准,并在工艺表征过程中作为设计空间(design space)的依据。如果仅以产品质量标准为设计空间的依据,获得的产品质量在相似性评估时会存在一定风险。所以,生物类似药工艺参数的操作范围较创新药更窄,从而大规模生产上的可操作性受到限制,工艺的控制难度更大。
此外,生产工艺规模放大属于中等以上的变更,通常发生在非临床研究之后、确证性临床研究之前,因此需要可比性研究证明变更前的非临床和临床数据适用于变更后的产品,以推进开发并最终支持其获得上市批准。成功的规模放大,产品产量、收率、质量和稳定性应与放大前保持一致,并与参照药相似。工艺变更的可比性研究可参照ICH Q5E《生物制品在生产工艺变更前后的可比性》进行。
3 生物类似药质量研究的特点生物类似药的质量研究聚焦于与参照药的相似性评估,目的是确立生物类似药和参照药之间的相似性,同时排除两者可能存在的差异,以确认参照药所具备的安全性和有效性可以适用于生物类似药。国内外指导原则对于“质量相似性”的阐述大同小异。例如: 世界卫生组织的指导原则认为,质量可比性应包括“生产工艺、结构表征、质量标准、分析技术和稳定性”[10];欧盟的指导原则认为,质量相似性研究主要包括“理化性质、生物活性、免疫化学、纯度与杂质和含量”5个方面[11];美国的相关指导原则认为,质量相似性研究应关注“表达系统、生产工艺、理化性质、功能活性、受体结合与免疫学、杂质、参考品与参考质量标准、制剂和稳定性”等方面[12]。国内的《指导原则》指出药学研究和评价的主要内容包括: 工艺研究、分析方法、特性研究(理化特性、生物学活性、纯度与杂质、免疫学特性)、质量标准、稳定性、其他(宿主细胞、制剂处方、规格与包装材料)。同时,药学相似性评价结论可分为“相似、存在差别和不相似”[4]。质量相似性是整个生物类似药相似性的物质基础,质量相似程度直接决定后续非临床、临床研究能否简化[13]。
3.1 参照药批次的选择对于相似性研究的样品批次,应尽可能采用多批次具有工艺代表性的样品,使用统计学方法进行相似性评价。在申报临床阶段,相似性研究样品数量应至少包括具有工艺代表性的3批参照药、3批中试规模以上的自制品和1批自制参考品。在申报生产阶段,国际上欧盟EMA和美国FDA的要求基本相同,应进行包含至少10批参照药的质量相似性比对研究,且涵盖原研药的效期范围。对于候选生物类似药,需要包含6~10个代表商业化生产工艺批次的样品,通常包括关键临床批和工艺验证批[14]。
3.2 质量相似性研究中的关键点生物类似药的质量相似性研究重点关注的质量属性,包括结构(一级结构、二级结构、高级结构)、理化性质(蛋白质含量、电荷异质性、分子大小变异体、颗粒分析、杂质分析等)、生物学活性及免疫学特性等。
3.2.1 结构生物类似药的结构表征一般包括一级结构、二级结构和高级结构。一级结构指的是氨基酸序列,是高级结构及生物学功能的基础。生物类似药原则上要求氨基酸序列和参照药保持一致。一级结构的表征方法一般是基于液质联用技术(LC-MS)从分子的不同水平进行分析,再辅以其他方法进行正交分析。从完整相对分子质量分析、肽质量指纹图谱、UV肽图和二硫键分析多个维度,可以全面地比对分析生物类似药和参照药的氨基酸序列的一致性。
高级结构对蛋白的生物学功能发挥十分重要。二级结构分析一般采用远紫外圆二色谱和红外光谱2种技术,高级结构分析可使用近紫外圆二色谱的方法,此外,荧光光谱、差示扫描量热(DSC)和分析型超速离心(AUC)也是表征高级结构的常用方法。荧光光谱可反映蛋白质中特定氨基酸(色氨酸等)在空间的位置和环境;DSC通过蛋白质的热稳定性变化反映高级结构的变化;AUC通过对比蛋白质单体、碎片及聚体在自然状态下的沉降速率,从而反映蛋白质在溶液状态下的高级结构差异。图 3选取了齐鲁制药有限公司开发的雷珠单抗生物类似药(代号QL1205)和参照药lucentis在结构表征方面肽质量指纹图谱、远紫外圆二色谱、UV肽图和DSC的对比结果,显示出候选药和参照药之间结构的高度相似性。
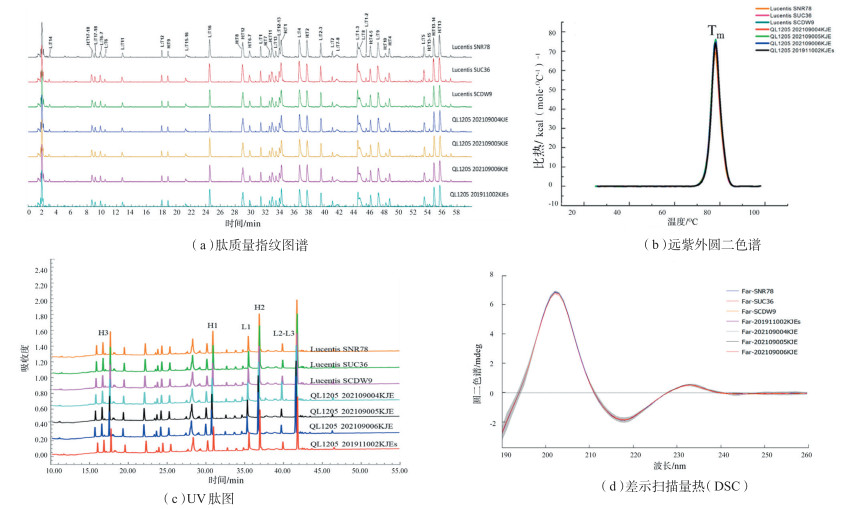
|
图 3 生物类似药QL1205和参照药lucentis结构表征相似性研究 |
根据ICH Q6B,产品的杂质可分为产品相关杂质(product-related impurities)和工艺相关杂质(process-related impurities)。在相似性评估中,需要重点评估产品相关杂质对安全性和有效性的影响。首先要确认候选药的杂质的种类和含量要与参照药相似,否则要加以鉴定和评估。相似性评估的标准一般需要对至少10批次以上参照药分析数据的计算得出。分子大小变异体的分析常用方法包括: 分子排阻色谱(SEC-HPLC)、毛细管电泳(CE-SDS)、分析型超速离心(AUC)等;电荷异质性分析根据不同原理可采用离子交换色谱(IEC-HPLC)、毛细管等电聚焦(iCIEF)2种方法分析;疏水异构体可采用疏水色谱(HIC-HPLC)分析。此外,翻译后修饰、含量、不溶性微粒等可能影响安全性和有效性的质量属性均需要与参照药进行比对分析。图 4为QL1205和参照药纯度相似性研究对比图谱,显示了在分子大小变异体、电荷异质性和疏水异构体方面高度相似。
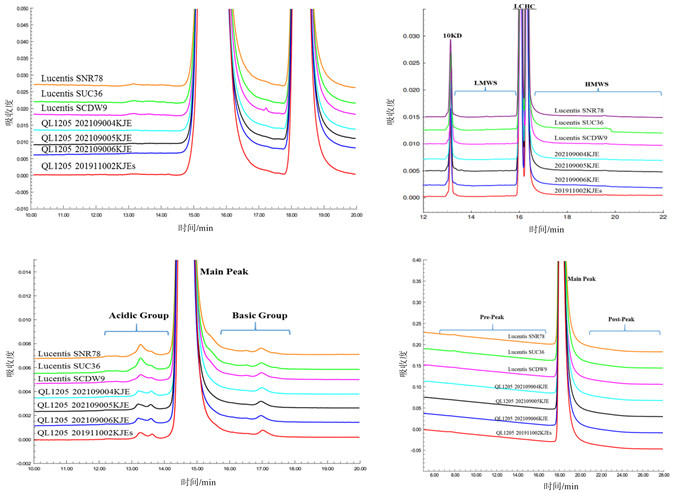
|
图 4 生物类似药QL1205和参照药Lucentis纯度相似性研究 |
工艺相关杂质主要影响产品的安全性,因此需要严格控制。工艺相关杂质种类和残留量与具体工艺情况密切相关,需要采用先进、灵敏的分析方法进行检测和必要控制,使其在安全的限值以内[9]。一般工艺添加物如抗生素残留、消泡剂残留等不需要与参照药进行对比,但与参照药相似的宿主蛋白、DNA残留和内毒素等推荐与参照药进行数值上的对比。
3.2.3 生物学活性及免疫学特性生物学活性和生物类似药的有效性直接相关,因此生物学活性分析是相似性评价的重点。《指导原则》指出: “应采用先进的、敏感的方法进行生物活性比对试验研究,首先考虑采用与参照药一致的方法。”[4]此外,生物学活性与分子的翻译后修饰、纯度、高级结构等质量属性密切相关,当以上属性相似性存在不确定性时,可以用生物学活性进一步说明和佐证。对于具有免疫学特性的产品的比对试验研究应尽可能采用与参照药相似原理的技术和方法。在实际研究中需要结合产品预期的作用机制和作用特点,采用多种分析方法对生物学活性和免疫学特性进行多层次的对比研究。
3.2.4 稳定性国内外的生物类似药指导原则中均提到了对于加速稳定性和强制降解试验,生物类似药和参照药应进行头对头的稳定性研究,以评价生物类似药和参照药的降解趋势和途径的相似性[4, 11]。
4 总结与展望近年来,生物类似药的研发方兴未艾,上市产品日趋增多,对于提高药物可及性、满足临床用药需求和降低医药费用具有显著的积极作用。生物类似药的研发和生产难度高、周期长、资金投入大,对开发企业综合水平有很高的要求。本文基于多年来对生物类似药的开发和国内外申报经验,在总结国内外最新生物类似药法规基础上,对生物类似药的研发和生产特点进行了总结,系统介绍了生物类似药的生产工艺开发、生产放大研究和质量相似性评价,为生物类似药研发提供参考思路,以期提高国内生物类似药研发水平,及早使更多的生物类似药进入临床应用,最终惠及广大患者。
·作者声明本文无实际或潜在的利益冲突
| [1] |
曹萌, 赵宇豪, 郭中平. 从国际非专利名称纵观全球生物药发展[J]. 中国生物工程杂志, 2020, 40(1/2): 154-165. |
| [2] |
罗建辉, 韦薇, 项金忠, 等. 关于生物类似药研发与评价的思考[J]. 中国药学杂志, 2015, 50(6): 473-476. |
| [3] |
郭中平. 生物药和生物类似药研究的现状与发展[J]. 临床药物治疗杂志, 2020, 18(5): 1-6. DOI:10.3969/j.issn.1672-3384.2020.05.001 |
| [4] |
国家食品药品监督管理总局. 生物类似药研发与评价技术指导原则(试行). 国家食品药品监督管理总局关于发布生物类似药研发与评价技术指导原则的通告: 2015年第7号[EB/OL]. [2022-08-01]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20150228155701114.html.
|
| [5] |
周爱萍. 生物治疗药物和生物类似药研究进展[J]. 中国新药杂志, 2017, 26(3): 296-299. |
| [6] |
MCCAMISH M, WOOLLETT G. The state of the art in the development of biosimilars[J]. Clin Pharmacol Ther, 2012, 91(3): 405-417. DOI:10.1038/clpt.2011.343 |
| [7] |
POROWIŃSKA D, WUJAK M, ROSZEK K, et al. Prokaryotic expression systems[J]. Postepy Hig Med Dosw, 2013, 67(863688): 119-129. |
| [8] |
KHAN K H. Gene expression in mammalian cells and its applications[J]. Adv Pharm Bull, 2013, 3(2): 296-299. |
| [9] |
李思鹏, 张仲理, 许圣昌, 等. 单抗生物类似药与原研药质量相似性研究解析[J]. 中国新药杂志, 2022, 31(6): 523-531. |
| [10] |
WHO. Guidelines on evaluation of similar biotherapeutic products(SBPs)[R]. Geneva: WHO, 2009.
|
| [11] |
EMA. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues[R]. Amsterdam: EMA, 2014.
|
| [12] |
FDA. Quality considerations in demonstrating biosimilarity of a therapeutic protein product to a reference product guidance for industry[R]. Silver Spring: FDA, 2015.
|
| [13] |
刘伯宁, 白玉, 罗建辉. 关于单抗生物类似药"质量相似性"的思考[J]. 中国药学杂志, 2017, 52(13): 1194-1200. |
| [14] |
FDA. Development of therapeutic protein biosimilars: comparative analytical assessment and other quality-related considerations guidance for industry[R]. Silver Spring: FDA, 2019.
|
 2022, Vol. 25
2022, Vol. 25


