2. 复旦大学公共卫生学院,上海 200032;
3. 广东省类器官工程技术研究中心,广东 广州 510535
卵巢癌是常见的女性生殖系统恶性肿瘤之一,在40岁以上女性中发病率随年龄增加呈快速上升趋势[1]。2020年,中国新发卵巢癌5.5万例,占全球卵巢癌新发病例的17.6%,居中国女性癌症发病谱的第10位[2]。卵巢癌发病隐匿,缺少有效的早筛手段,约70.0%的卵巢癌患者诊断时已处于晚期[3],患者总体预后较差,平均生存期约为59个月[4]。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期,Ⅲ期或Ⅳ期卵巢癌患者5年生存率仅13.0%~45.0%[5]。卵巢癌的治疗以手术为主,辅助化疗,化疗在卵巢癌辅助治疗和复发治疗中占有重要地位[6], 然而目前临床缺乏有效的精准用药指导检测模型。紫杉醇联合卡铂是上皮性卵巢癌一线化疗的标准和首选方案[3],有效率达80.0%[6],31.3%~67.0%的患者可以达到完全缓解[7-10],但是在这部分患者中,50.0%~70.0%经历复发,平均复发时间为16~18个月,多数患者最终死于肿瘤复发耐药[3, 11],给患者和社会均带来沉重的临床负担和经济负担。2016年,四川省卵巢恶性肿瘤治疗费用高达2.45亿元,居恶性肿瘤治疗费用的第10位[12]。
类器官是由干细胞在体外基质培养下,诱导分化形成的三维多细胞复合体,类似于微型器官结构,可以较好地重现其来源组织的特征[13]。肿瘤来源的类器官(patient-derived tumor organoid,PDTO)目前已经在多种癌症中成功培养[7]。相较于二维肿瘤细胞系,PDTO可以更加稳定地维持来源肿瘤的体内特征[7]。已有许多研究证实PDTO可以在较短时间内培养成功,用于药敏检测时也可以有效预测患者的临床反应,准确性达75.0%~84.4%[14-21]。
利用PDTO进行抗癌药物筛选并支持癌症患者临床精准用药具有广阔的应用前景,类器官药敏检测技术的经济价值值得探讨。目前,全面、详细的卫生经济学研究正在开展,基于文献调研结果,结合广东省类器官工程技术研究中心关于类器官个体化药敏检测技术(accurate drug sensitivity testing,ADST)的相关研究数据,现对类器官药敏检测技术用于卵巢癌患者抗癌药物筛选的经济价值进行初步估算。
1 研究方法 1.1 模型构建本研究通过构建决策树模型(图 1),模拟上皮性卵巢癌初治患者的药物选择及治疗结果和药物花费,估算不使用类器官药敏检测技术、使用类器官药敏检测技术依据指南推荐用药进行药物筛选、使用类器官药敏检测技术直接进行药物筛选3种路径下卵巢癌患者的药品成本。
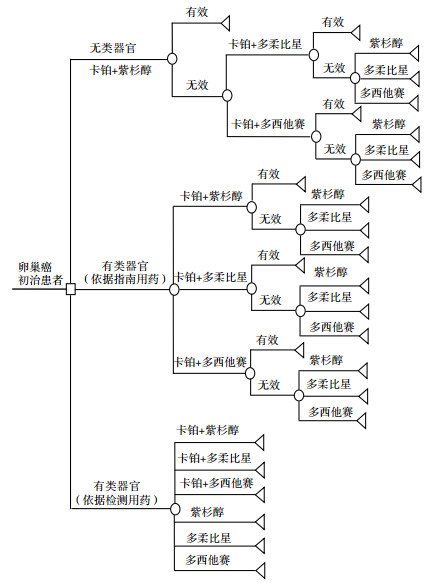
|
图 1 决策树模型结构 |
根据《卵巢癌诊疗规范(2018年版)》临床路径[3]及《卵巢恶性肿瘤诊断与治疗指南(2021年版)》[6]推荐的上皮性卵巢癌一线化疗方案,卵巢癌初治患者以含铂化疗方案为一线化疗方案,约80.0%的患者使用含铂方案可达到部分缓解或完全缓解,但仍存在20.0%的患者对一线含铂化疗不敏感,即为原发性耐药。当发现患者为原发性耐药时,即改用不含铂方案的单药化疗。在使用类器官药敏检测技术进行药物筛选路径下,分为两种情景,情景一:依据指南用药顺序,类器官优先筛选3种含铂方案,若无效患者则常规使用不含铂方案;情景二:使用类器官药敏检测技术对含铂方案和不含铂单药化疗方案同时进行筛选。
确定卵巢癌化疗方案如下:含铂化疗方案,卡铂+紫杉醇、卡铂+多柔比星、卡铂+多西他赛;不含铂单药方案,紫杉醇、多柔比星、多西他赛。根据广东省类器官工程技术研究中心的研究数据,ADST用于卵巢癌患者抗癌药物筛选的敏感性为91.0%,特异性为75.0%。
1.2 模型假设根据文献调研结果,假设在不使用类器官药敏检测技术路径下,以各治疗方案的客观缓解率(objective response rate,ORR)作为有效率指标,治疗无效患者在完成指南推荐的治疗周期后换药。在使用类器官药敏检测技术路径下,通过类器官药敏检测技术的敏感性及铂敏感患者占比计算得到各含铂化疗方案的有效率。有类器官药敏检测(依据指南用药)情景中3种含铂方案同时筛选,由于同类型的不同治疗方案之间存在药效重合(即患者可能对3种含铂方案中的多种方案敏感),假设药效重合率为80.0%。由于无详尽的化疗方案市场份额参数,因此对市场份额进行假设,在不使用类器官药敏检测技术情景下,根据指南推荐等级估计市场份额参数,在使用类器官药敏检测技术情景下,市场份额参数受治疗方案有效率及药品价格共同影响。
1.3 模型参数本研究估算的参数主要分为临床疗效参数和成本参数。临床疗效参数来源于各治疗方案的临床试验[10, 22-26],成本参数仅考虑药品费用,药品费用数据来源于药智网药品中标价格,并根据《卵巢癌诊疗规范(2018年版)》推荐的用法用量计算完成各治疗方案所需的药品费用。见表 1、表 2、表 3。
| 表 1 不同化疗方案市场份额参数占比 |
|
|
| 表 2 不同化疗方案疗效参数 |
|
|
| 表 3 不同化疗方案成本参数 |
|
|
对于无类器官药敏感检测队列,根据临床路径分为3个阶段,分别为卡铂+紫杉醇阶段、卡铂+多柔比星/卡铂+多西他赛阶段及最后含铂方案无效的单药方案阶段。
第一阶段:
| $ C_{{\rm{卡铂+紫杉醇}}}= C_{{\rm{卡铂+紫杉醇月费用}}} \times T_{{\rm{使用时长}}} \times S_{{\rm{卡铂+紫杉醇市场份额}}} $ |
第二阶段:
| $\begin{array}{l} \;\;\;\;C_{{\rm{卡铂+多柔比星}}/{\rm{卡铂+多西他赛}}}= (1-{\rm{ORR}}_{{\rm{卡铂+紫杉醇}}}) \times S_{{\rm{卡铂}}+}\\ _{{\rm{紫杉醇市场份额}}} \times C_{{\rm{卡铂+多柔比星/卡铂+多西他赛月费用}}} \times T_{{\rm{使用时长}}} \end{array} $ |
第三阶段:
| $ \begin{array}{l} \;\;\;\;\; C_{\rm{卡铂+多柔比星/卡铂+多西他赛(无效患者)各单药费用}}=(1-{\rm{ORR}}_{\rm{卡铂}}\\ _{\rm{+紫杉醇}}) \times S_{\rm{卡铂+紫杉醇市场份额}} \times [1- {\rm{ORR}}_{\rm{卡铂+多柔比星/卡铂+多西他赛}} \times \\ (1-R_{\rm{药效重合率}})] \times C_{\rm{单药月费用}} \times T_{\rm{单药使用时长}} \times S_{\rm{单药市场份额}} \end{array} $ |
对于有类器官药敏检测(依据指南用药),成本估算分为含铂方案有效及无效两个阶段。
第一阶段:
| $ \begin{array}{l} \;\;\;\;C_{\rm{含铂方案有效}}=[P_{\rm{铂敏感患者比例}} \times P_{\rm{类器官敏感性}}+ P_{\rm{铂耐药患者比例 }}\times\\ ( 1- P_{\rm{类器官特异性}} )] \times C_{\rm{含铂方案月费用}} \times T_{\rm{使用时长}} \times S_{\rm{含铂方案市场份额}}, \end{array} $ |
第二阶段:
| $ \begin{array}{l} \;\;\;\;\; C_{\rm{含铂方案无效}}=(1- P_{\rm{铂敏感患者比例}} \times P_{\rm{类器官敏感性}}) \times S_{\rm{含铂方案}}\\ _{\rm{市场份额}} \times C_{\rm{单药月费用}} \times T_{\rm{单药使用时长}} \times S_{\rm{单药市场份额}} \end{array} $ |
有类器官药敏检测(根据检测用药):
| $ C_ {\rm{各方案}}= C_{\rm{各方案月费用}} \times T_{\rm{使用时长}} \times S_{\rm{市场份额}} $ |
以上各公式中,C、T、S分别代表各治疗阶段治疗方案的成本、治疗方案使用时长和治疗方案市场份额,ORR为治疗方案的客观缓解率,R为假设的含铂方案药效重合率。
2 结果通过现有数据经成本估算方法对相关费用进行估算可得:在不使用类器官药敏检测技术的情景下,卵巢癌初治患者化疗方案的药品总费用为25 841.72元;在使用类器官药敏检测技术的情景下,依据指南推荐进行药物筛选情景的药品总费用为18 428.65元,直接根据检测用药情景的药品总费用为9 456.75元。使用类器官药敏检测技术的两种情景相较不使用类器官药敏检测情景可以分别减少约7 413.07元和16 384.97元的药品费用,见表 4。
| 表 4 3种情景下卵巢癌初治患者化疗的费用结果 |
|
|
在中国卵巢癌的临床治疗中,药品费用约占总治疗费用的70.0%以上[27-28]。高昂的药品费用是造成癌症患者经济负担沉重的重要原因,降低药品成本对于减轻癌症患者经济负担至关重要。卵巢癌异质性较高,导致相同的药物在不同患者中效果差异较大,许多化疗方案有效率较低。多腺苷二磷酸核糖聚合酶(poly adenosine diphosphate-ribose polymerase,PARP)抑制剂给一部分患者带来了更大的临床获益[29-32],但是在中国卵巢癌患者中,BRCA1/2突变的发生率仅为16.7%~28.5%[33-35],非BRCA突变的患者在PARP抑制剂的获益较小,部分患者即使有相应的基因改变,也不一定对治疗有反应[36]。缺乏个体化用药指导可能导致患者用药无效。
类器官是能够表征体内肿瘤特性的体外模型,能够为患者提供比单纯基因检测更好的临床用药指导。一项研究[17]发现携带BRCA1突变的同源重组修复缺陷(homologous recombination deficiency,HRD)患者来源的类器官药敏试验显示出与患者临床反应一致的奥拉帕利抗性,考虑到BRCA1/2突变或HRD阳性是临床使用PARP抑制剂的生物标志物[37],说明类器官药敏检测对患者临床反应的预测可能比单纯的基因检测更加准确,能够在一定程度上弥补基因检测的不足。此外,有研究使用类器官为多重耐药或转移性乳腺癌患者进行药物筛选并指导临床治疗,所有使用了经类器官预测为敏感的治疗方案的患者均实现了部分缓解、疾病稳定或长期无病生存[21],给复发、耐药的癌症患者的治疗带来了希望。
许多关于肿瘤类器官用于支持癌症精准治疗的临床研究正在开展中[38],国内外尚无针对类器官药敏检测技术的卫生经济学评价结果报道。本研究结果显示,基于假设的前提,类器官药敏检测技术用于支持卵巢癌患者精准治疗可以降低患者的用药成本为7 413.07~16 384.97元,占卵巢癌治疗药品费用的28.7%~63.4%。
目前,类器官药敏检测技术尚未广泛应用于临床,本研究探索性地构建决策树模型,考虑不使用类器官药敏检测技术、使用类器官药敏检测技术依据指南推荐用药、使用类器官药敏检测技术依据检测结果用药3种临床情景,模拟卵巢癌初治患者的用药选择。结果显示,相较于不使用类器官药敏检测技术,类器官药敏检测技术的应用可以减少患者无效用药的发生,减少患者换药次数,从而降低患者的药品成本。本研究从患者角度出发,在成本参数中,目前仅考虑患者的药品成本,暂未将卵巢癌患者除药品费用外的其他医疗成本和非医疗成本纳入计算。考虑到类器官药敏检测技术预测癌症患者用药后临床反应的准确性高达75.0 %以上[14-21],用于支持患者精准治疗可以减少治疗延误的发生,改善患者预后,预期可以减少患者的其他医疗成本和非医疗成本。此外,由于类器官药敏检测技术目前尚无明确的定价,本研究未将类器官药敏检测技术的成本纳入计算,考虑到创新技术的成本一般较高,其成本效益仍需综合患者治疗过程中的成本和使用类器官药敏检测技术给患者带来的生存预后、生命质量的影响进一步评估。
综上所述,类器官药敏检测技术用于支持卵巢癌患者精准治疗可以减少患者的药品成本,在一定程度上减轻患者由疾病导致的经济负担。本研究的结果可以为类器官药敏检测技术的临床使用和后续针对类器官药敏检测技术的经济学研究的开展提供参考。本研究也存在一定的局限性:第一,市场份额数据方面,由于缺乏各化疗方案临床使用的市场份额数据,研究综合考虑指南推荐等级、各化疗方案的疗效和价格对市场份额参数进行假设,可能与实际临床使用情况存在差异。第二,治疗方案疗效方面,由于数据来源的限制,本研究假设同一治疗方案处于二线或三线治疗时的客观缓解率和处于一线治疗的客观缓解率相同,可能会高估二线或三线治疗时的客观缓解率。第三,成本方面,由于数据来源的限制,本研究仅考虑了药物费用,还有待从全社会角度下对相关的直接医疗成本、直接非医疗成本和间接成本进行全面的考量。
最后,建议开展更多研究,促进肿瘤类器官的培养标准化,优化其在药敏检测中的敏感性和准确性,推动肿瘤类器官药敏检测技术的临床转化实践,开展全面的卫生经济学研究评估其成本效益。
·作者声明本文无实际或潜在的利益冲突
| [1] |
刘杰, 颜玮, 徐艳, 等. 2015年中国卵巢癌发病与死亡分析[J]. 中华肿瘤防治杂志, 2021, 28(6): 407-411. DOI:10.16073/j.cnki.cjcpt.2021.06.01 |
| [2] |
刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-13. |
| [3] |
中华人民共和国国家卫生健康委员会. 卵巢癌诊疗规范(2018年版)[EB/OL]. [2021-12-12]. https://wenku.baidu.com/view/700b4a87c4da50e2524de518964bcf84b9d52da7.html.
|
| [4] |
LI X L, XU H Y, YAN L M, et al. A novel clinical nomogram for predicting cancer-specific survival in adult patients after primary surgery for epithelial ovarian cancer: a real-world analysis based on the surveillance, epidemiology, and end results database and external validation in a tertiary center[J]. Front Oncol, 2021, 11: 670644. DOI:10.3389/fronc.2021.670644 |
| [5] |
TORRE L A, TRABERT B, DESANTISE C E, et al. Ovarian cancer statistics, 2018[J]. CA: Cancer J Clin, 2018, 68(4): 284-296. DOI:10.3322/caac.21456 |
| [6] |
中国抗癌协会妇科肿瘤专业委员会. 卵巢恶性肿瘤诊断与治疗指南(2021年版)[J]. 中国癌症杂志, 2021, 31(6): 490-500. DOI:10.19401/j.cnki.1007-3639.2021.06.07 |
| [7] |
NERO C, VIZZIELLI G, LORUSSO D, et al. Patient-derived organoids and high grade serous ovarian cancer: from disease modeling to personalized medicine[J]. J Exp Clin Cancer Res, 2021, 40(1): 116. DOI:10.1186/s13046-021-01917-7 |
| [8] |
OZOLS R F, BUND B N, GREER B E, et al. Phase Ⅲ trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage Ⅲ ovarian cancer: a gynecologic oncology group study[J]. J Clin Oncol, 2003, 21(17): 3194-3200. DOI:10.1200/JCO.2003.02.153 |
| [9] |
PERREN T J, SWART A M, PFISTERER J, et al. A phase 3 trial of bevacizumab in ovarian cancer[J]. N Engl J Med, 2011, 365(26): 2484-2496. DOI:10.1056/NEJMoa1103799 |
| [10] |
DU BOIS A, LÜCK H J, MEIER W, et al. A randomized clinical trial of cisplatin/paclitaxel versus carboplatin/paclitaxel as first-line treatment of ovarian cancer[J]. J Natl Cancer Inst, 2003, 95(17): 1320-1329. DOI:10.1093/jnci/djg036 |
| [11] |
LIU X D, LIU Y, GONG T T, et al. Prognostic influence of the time interval between surgery and chemotherapy in epithelial ovarian cancer[J]. J Cancer, 2018, 9(22): 4172-4178. DOI:10.7150/jca.27409 |
| [12] |
刘臻, 谭玲, 杨练, 等. 基于卫生费用核算体系2011的2016年四川省恶性肿瘤治疗费用核算分析[J]. 中国慢性病预防与控制, 2019, 27(5): 321-325. DOI:10.16386/j.cjpccd.issn.1004-6194.2019.05.001 |
| [13] |
SINGH T, NEAL A S, MOATAMED N A, et al. Exploring the potential of drug response assays for precision medicine in ovarian cancer[J]. Int J Mol Sci, 2020, 22(1): 305. DOI:10.3390/ijms22010305 |
| [14] |
VLACHOGIANNIS G, HEDAYAT S, VATSIOU A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers[J]. Science, 2018, 359(6378): 920-926. DOI:10.1126/science.aao2774 |
| [15] |
PHAN N, HONG J J, TOFIG B, et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids[J]. Commun Biol, 2019, 2: 78. DOI:10.1038/s42003-019-0305-x |
| [16] |
DE WITTE C J, VALLE-INCLAN J E, HAMI N, et al. Patient-derived ovarian cancer organoids mimic clinical response and exhibit heterogeneous inter-and intrapatient drug responses[J]. Cell reports, 2020, 31(11): 107762. DOI:10.1016/j.celrep.2020.107762 |
| [17] |
HILL S J, DECKER B, ROBERTS E A, et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids[J]. Cancer Discov, 2018, 8(11): 1404-1421. DOI:10.1158/2159-8290.CD-18-0474 |
| [18] |
WANG T, PAN W J, ZHENG H, et al. Accuracy of using a patient-derived tumor organoid culture model to predict the response to chemotherapy regimens in stage Ⅳ colorectal cancer: a blinded study[J]. Dis Colon Rectum, 2021, 64(7): 833-850. DOI:10.1097/DCR.0000000000001971 |
| [19] |
YAO Y, XU X Y, YANG L F, et al. Patient-derived organoids predict chemoradiation responses of locally advanced rectal cancer[J]. Cell Stem Cell, 2020, 26(1): 17-26. |
| [20] |
KIM S Y, KIM S M, LIM S, et al. Modeling clinical responses to targeted therapies by patient-derived organoids of advanced lung adenocarcinoma[J]. Clin Cancer Res, 2021, 27(15): 4397-4409. DOI:10.1158/1078-0432.CCR-20-5026 |
| [21] |
CHEN P, ZHANG X, DING R B, et al. Patient‐derived organoids can guide personalized‐therapies for patients with advanced breast cancer[J]. Adv Sci(Weinh), 2021, 8(22): e2101176. DOI:10.1002/advs.202101176 |
| [22] |
PIGNATA S, SCAMBIA G, FERRANDINA G, et al. Carboplatin plus paclitaxel versus carboplatin plus pegylated liposomal doxorubicin as first-line treatment for patients with ovarian cancer: the MITO-2 randomized phase Ⅲ trial[J]. J Clin Oncol, 2011, 29(27): 3628-3635. DOI:10.1200/JCO.2010.33.8566 |
| [23] |
VASEY P A, JAYSON G C, GORDON A, et al. Phase Ⅲ randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma[J]. J Natl Cancer Inst, 2004, 96(22): 1682-1691. DOI:10.1093/jnci/djh323 |
| [24] |
MUGGIA F M, BRALY P S, BRADY M F, et al. Phase Ⅲ randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage Ⅲ or Ⅳ ovarian cancer: a gynecologic oncology group study[J]. J Clinl Oncol, 2000, 18(1): 106-115. DOI:10.1200/JCO.2000.18.1.106 |
| [25] |
MUTCH D G, ORLANDO M, GOSS T, et al. Randomized phase Ⅲ trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer[J]. J Clin Oncol, 2007, 25(19): 2811-2818. DOI:10.1200/JCO.2006.09.6735 |
| [26] |
ROSE P G, BLESSING J A, BALL H G, et al. A phase Ⅱ study of docetaxel in paclitaxel-resistant ovarian and peritoneal carcinoma: a gynecologic oncology group study[J]. Gynecol Oncol, 2003, 88(2): 130-135. DOI:10.1016/S0090-8258(02)00091-4 |
| [27] |
韩晓梅, 刘志云, 阿布都沙拉木·依米提, 等. 基于DRGs的卵巢癌患者住院费用分析[J]. 中国卫生统计, 2016, 33(2): 298-300, 303. |
| [28] |
干小红, 冯维, 王颖, 等. 贝伐珠单抗联合化疗用于高危卵巢癌患者的成本-效果分析[J]. 中南药学, 2013, 11(9): 714-717. |
| [29] |
PENSON R T, VALENCIA R V, CIBULA D, et al. Olaparib versus nonplatinum chemotherapy in patients with platinum-sensitive relapsed ovarian cancer and a germline BRCA1/2 mutation (SOLO3): a randomized phase Ⅲ trial[J]. J Clin Oncol, 2020, 38(11): 1164-1174. DOI:10.1200/JCO.19.02745 |
| [30] |
PUJADE-LAURAINE E, LEDERMANN J A, SELLE F, et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2017, 18(9): 1274-1284. DOI:10.1016/S1470-2045(17)30469-2 |
| [31] |
FRIEDLANDER M, MATULONIS U, GOURLEY C, et al. Long-term efficacy, tolerability and overall survival in patients with platinum-sensitive, recurrent high-grade serous ovarian cancer treated with maintenance olaparib capsules following response to chemotherapy[J]. Br J Cancer, 2018, 119(9): 1075-1085. DOI:10.1038/s41416-018-0271-y |
| [32] |
MIRZA M R, MONK B J, HERRSTEDT J, et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer[J]. N Engl J Med, 2016, 375(22): 2154-2164. DOI:10.1056/NEJMoa1611310 |
| [33] |
BU H L, CHEN J Y, LI Q S, et al. BRCA mutation frequency and clinical features of ovarian cancer patients: a report from a Chinese study group[J]. J Obstet Gynaecol Res, 2019, 45(11): 2267-2274. DOI:10.1111/jog.14090 |
| [34] |
SHI T Y, WANG P, XIE C X, et al. BRCA1 and BRCA2 mutations in ovarian cancer patients from China: ethnic‐related mutations in BRCA1 associated with an increased risk of ovarian cancer[J]. Int J Cancer, 2017, 140(9): 2051-2059. DOI:10.1002/ijc.30633 |
| [35] |
WU X H, WU L Y, KONG B H, et al. The first nationwide multicenter prevalence study of germline BRCA1 and BRCA2 mutations in Chinese ovarian cancer patients[J]. Int J Gynecol Cancer, 2017, 27(8): 1650-1657. DOI:10.1097/IGC.0000000000001065 |
| [36] |
PAUL C, HOPKINS B D, PRANDI D, et al. Personalized in vitro and in vivo cancer models to guide precision medicine[J]. Cancer Discov, 2017, 7(5): 462-477. DOI:10.1158/2159-8290.CD-16-1154 |
| [37] |
中国抗癌协会妇科肿瘤专业委员会, 中华医学会病理学分会. 上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识[J]. 中国癌症杂志, 2020, 30(10): 841-848. DOI:10.19401/j.cnki.1007-3639.2020.10.017 |
| [38] |
张秀梅, 翟运开, 赵杰, 等. 类器官模型国内外数据库近10年文献研究热点分析[J]. 中国组织工程研究, 2021, 25(8): 1249-1255. |
 2022, Vol. 25
2022, Vol. 25


