2. 艾昆纬企业管理咨询(上海)有限公司,上海 200041
卫生技术评估(health technology assessment, HTA)是通过明确的方法来确定卫生技术在其生命周期中不同阶段价值的一个多学科评估与实践过程,旨在为决策提供信息,以建立一个公平、高效和高质量的卫生系统[1]。随着对HTA应用的深入,研究者、决策者普遍意识到HTA缺乏对不同利益相关方价值观点的全面考虑,可能导致评估信息获取不充分,最终难以形成决策共识。
在HTA中的审慎评议是通过开展一系列的协调活动,在不同利益相关方之间进行信息传递和交流,通过对证据、观点和价值观的不确定性进行批判性审查,得出基于整体的综合判断的系统化过程[2-3],是实现民主与循证决策有机结合的手段。其产出可以是一项具有约束力的决策,也可以是一般性的建议,或者仅为后续决策提供信息,多用于创新药品、医疗器械、外科手术方式和诊断测试手段等医疗卫生技术的报销和准入决策[3]。作为知情的、基于价值的、变革性的论证程序,HTA审慎评议越来越受到卫生部门的重视[4-5]。
通过HTA进行科学、审慎的决策已成为当前国际讨论的热点和面临的挑战,其中涉及证据的生成及质量问题,不同利益相关方的视角、价值、偏好选择,以及医疗、支付体系的场景和影响等问题。为应对上述问题,2020年国际卫生技术评估全球政策论坛(Health Technology Assessment International Global Policy Forum, HTAi GPF)将审慎评议作为会议主题,商定一套审慎评议过程的核心原则和围绕审慎评议过程的支持行动,以助推医疗保险(以下简称“医保”)报销决策的改革与完善[6]。当前中国鲜有围绕审慎评议的构成要素、运行机制及其在HTA中规范运用等相关研究。基于此,现系统介绍HTA审慎评议的主要步骤和审慎评议过程的主要原则,以期为中国HTA审慎评议体制机制建设及发展提供参考和借鉴。
1 HTA审慎评议的原则基于《HTA审慎评议原则构建指南》[7],HTAi GPF会议成员经过3轮讨论与投票,最终从11项原则中遴选出3项HTA审慎评议过程中应遵循的核心原则,即透明性(transparency)、公正性(impartiality)和包容性(inclusivity) [5],三者互为补充、互相促进,用以支持审慎评议的活动过程。
1.1 透明性原则透明性是指要公开并明确描述审慎评议程序以及建议或决策的依据。审慎评议程序的透明性促进了“合理性问责(accountability for reasonableness, A4R)”进一步完善,使利益相关方能够判断审慎评议过程及其结论是否公正合理[8]。基于该原则的相关行为还涉及为参与审慎评议的利益相关方提供信息并帮助了解谁将参与决策、如何作出决策,以及决策基于哪些价值维度考量等。
1.2 包容性原则包容性指将不同观点汇聚在一起来反映决策受众的现实需求。权力易扭曲思想背后的思维方式,权力不平衡往往影响各方的意见表达,导致低效的决策。实现包容性除了需要对利益相关方“授权”,还需要构建开放的审慎评议环境,使其能够充分、建设性地分享观点,并且最大限度地减少参与方之间的权力差异。
1.3 公正性原则公正性指每个决策所启动的审慎评议程序及其相关人员应保持客观独立,不受内部(如支持HTA程序的机构)和外部(特定议题中的既得利益者)影响。支持这一原则的行动包括对所有参与者的利益冲突充分披露,并限制存在利益冲突的成员参与审慎评议,以及审慎评议委员会主任要控制发言时间与会议进程,防止“意见领袖”影响最终决策。
2 HTA审慎评议的运行机制HTAi GPF会议成员应用输入-生产-输出(input-throughput-output, ITO)模型描述审慎评议的运行机制[4],该模型于2003年正式提出,用于解决急诊科资源配置问题[9],后常用来阐述信息处理过程和复杂的医疗保健路径,指导循证决策的制定过程[10]。基于ITO模型的审慎评议一般包含如下程序:(1)构建审慎评议环境。根据政治及文化背景差异,基于“5W1H”[原因(Why)、对象(What)、地点(Where)、时间(When)、人员(Who)、方式(How)]分析法建立审慎评议委员会,包括审慎评议人员、时间、地点、范畴,为什么及如何审慎评议等[11],并明确审慎评议委员会的职权范围。(2)输入过程。收集证据信息以形成审慎评议的循证基础,包括临床试验、成本-效果以及各方观点等多样化证据。(3)生产过程。该过程描述了审慎评议的具体实施流程,包括严格审查证据信息,确保纳入最佳证据,并呈现所审慎评议的卫生技术的事实、价值和原因,通过讨论协调审慎评议者的认知及社会关系并达成决策共识,同时根据需要收集额外的证据信息。(4)输出过程。指审慎评议的内容和审慎评议结果通过何种途径巩固和传播的过程,同时根据需要可能存在复审流程。(5)利益相关方全过程参与。指在审慎评议过程中综合患者、临床医生、企业代表、支付方等各方立场,并将其纳入讨论、审查证据及决策制定的全过程。(6)评价审慎评议过程及效率改进。评估审慎评议流程是否遵循核心原则与价值框架,解决实践过程中的矛盾冲突,持续改进HTA审慎评议机制。见图 1。
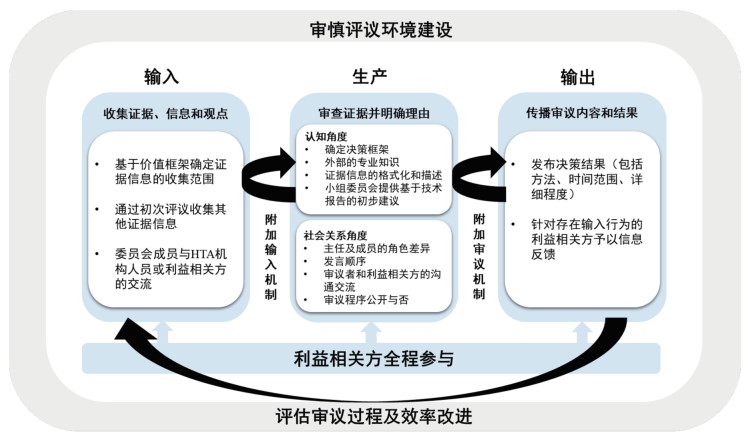
|
注:为便于理解,本研究对原模型[3]进行了适应性调整。HTA为卫生技术评估(health technology assessment)。 图 1 基于输入-生产-输出模型的审慎评议运行机制 |
(1)权责关系。审慎评议首先要明确审慎评议委员会与隶属机构的权责关系,以确保“问责制”的有效执行。应避免审慎评议委员会隶属机构过度参与审慎评议程序,否则会威胁建议或决策的公正客观。(2)委员会构成。为确保观点及价值观的多样性,审慎评议委员会一般应纳入医生、临床流行病、卫生经济等专业技术人员以及患者、公众等不同专业领域、不同视角的成员。同时根据议题需要,还须考虑不同角色、职责下的成员及委员会规模的更替频率。(3)利益冲突。为确保各成员与议题没有利益冲突,首次参与审慎评议的人员均应报告利益冲突,委员会固定成员也应于每次会议前更新利益冲突。
3.2 输入要素(1)证据信息的收集。通常由制造商提供卫生技术的临床疗效和成本效益证据,并交由审慎评议委员会进行评审。为了便于不同卫生技术的比较与审慎评议,委员会可提供标准报告模板或指导意见,以规范制造商提交的材料内容及详细程度。(2)技术支持。基于审慎评议议题的复杂程度,审慎评议委员会可下设专业技术人员组成的技术委员会,评估卫生技术的科学信息和背景证据,为正式审慎评议提供初步建议。(3)附加证据输入。审慎评议委员会针对审慎评议需要,可要求卫生技术制造商提交补充材料。(4)证据信息的保密机制。制造商在提交证据信息、委员会在审慎评议报告的文本编辑时,应尽可能保证信息的透明度与真实性,对不可披露的信息尽可能保证与产出结果的一致性。
3.3 生产要素在形成建议或决策的过程中,要考虑认知与社会关系两大生产要素。
在认知方面:(1)建立决策框架。通过建立决策框架对决策中涉及的事实、原因和结论进行有组织的讨论,确定优先事项。该过程强调多准则决策分析(multicriteria decision analysis, MCDA)的适用性[12]。(2)缩小认知差异。一般很难确保审慎评议委员会成员对广泛证据信息均拥有所需的技能和知识[13],因此需要所有成员持续学习以弥补认知缺失,从而适应复杂的决策过程。可在终审之前允许利益相关方参与,以收集更多信息以减少不确定性,提供教育课程以增加委员会成员的知识素养等。(3)审慎评议时间。基于特定需求确定不同的讨论频率与时间长短。
在社会关系方面:(1)委员会主任的职责。主任的专业背景和对不同类型证据的态度可能会影响委员会讨论的性质以及对特定信息的重视程度[14],其职责一般包括管理会议议程、促进平等讨论并探索不确定性或分歧、帮助理解和解释证据等。主任需关注主流声音,同时还要征询弱势群体意见,以落实包容性原则。(2)委员会成员的互动关系。良好的团队合作意识从根本上决定了委员会的工作效率和审慎评议的成功与否,因此委员会成员间允许存在意见分歧但应相互尊重。此外,是否公开审慎评议的过程可能会影响委员会成员间意见交换的程度,需加以考虑。(3)达成建议或决策。根据审慎评议委员会仅提供参考建议或作出具有法律约束力决策的职能差异,可考虑选择多数票通过或协商一致等不同方式以形成共识。
3.4 输出要素(1)报告建议或决策。公布审慎评议报告应及时准确并明确理由,同时应考虑报告的详细程度,可选择报告证据信息及利益相关方在审慎评议中提出的意见等。(2)决策转化与传播。考虑如何将委员会的报销建议转化为支付方和其他利益相关方执行,以便价格谈判和准入标准设置(基于需要可将其纳入审慎评议委员会权限范围内)。(3)复审及争议处理。由于部分卫生技术的优势可能在传统的临床和经济评估过程中无法完全体现,制造商可以对不利意见提出复审,并对新技术的额外优势予以阐述后再次评议。
3.5 利益相关方参与在投入方面,HTA审慎评议委员会要扩大成员纳入范围,着重将患者群体纳入利益相关方,既要收集基于患者的定性定量证据,也要征求患者群体的意见,以确保患者观点可为审慎评议和决策提供信息[15],并促进不同事项优先级的准确识别[16]。在生产方面,基于审慎评议委员会特点,一种形式是直接将利益相关方纳入审慎评议程序,而另一种形式则提供意见而不直接参与审慎评议过程。在产出方面,强调信息的双向流动。需要报告利益相关方对审慎评议过程、建议或决策的贡献,对利益相关方投入的证据或信息给予反馈,使其知晓提供信息的价值,并提高流程的透明度和效率。同时也应给予利益相关方针对建议或决策草案进行评论的机会。
3.6 评价审慎评议过程及效率改进HTA机构应对审慎评议过程的各个方面进行审查,以确保项目评价流程的完整性。目前尚不确定特定社会总体健康状况的改善或医疗保健分配的公正与否等远期结果是否可以归因于审慎评议,因此评估应该侧重于过程结果,强调决策结果的一致性、决策的更大可信度与可接受性,以及新技术的更快获得与实施。可利用INTEGRATE-HTA(integrated health technology assessment for the evaluation of complex technologies)框架结合A4R条件来评价审慎评议过程的全面性与合理性[17]。参考快速HTA的报告流程,有必要进一步简化审慎评议程序,控制证据收集、利益相关方参与等不确定性因素的发生,平衡资源、时间和质量,实现效率改进。
4 对中国HTA审慎评议发展路径的思考 4.1 博采众长,发展具有中国特色的HTA审慎评议模式当前,欧美国家相关机构如英国国家健康与临床卓越研究所(National Institute for Health and Care Excellence,NICE)、加拿大药物和卫生技术局(Canadian Agency for Drugs and Technologies in Health, CADTH)以及美国临床和经济审查研究所(Institute for Clinical and Economic Review, ICER)均已经在不同程度上建立或应用了审慎评议制度。Oortwijn等[18]也于近期发布了HTA审慎评议行动指南,这均为中国HTA机构建立审慎评议制度提供了参考。但就如何解决复审及争议处理、利益冲突管理不善以及缺乏将证据用于决策的政治意愿等问题,需要结合中国政治、经济和文化背景及组织价值观等环境要素具体问题具体分析。通过引导形成合理有序的证据生产及决策传播机制,探索实践最低标准或最佳做法,逐步建立中国HTA审慎评议指南,提高HTA的评审意见及决策建议的权威性。
4.2 引导多方参与,考虑患方在审慎评议中的重要地位审慎决策涵盖了循证判断与主观价值判断的双重标准,其决策是否公正合理依赖于对利益相关方多元化利益的考量。各利益相关方基于其自身利益及所处环境来评价政策选择并确定其优先次序[19],各方共同参与决策的制定、审慎评议、执行等不同阶段,对决策交互审慎评议并最终达成共识,可以改善HTA审慎评议委员会内部可能存在的判断或决策偏差。同时,审慎评议结果应尽可能反映利益相关方的偏好,尤其是针对患者而言,仅仅考虑药品及其他卫生技术的安全性及有效性可能并不能反映对患者及公众的实际受益。为了实现卫生技术的价值最大化,从新兴技术的识别到范围界定、评估、评价及最终决策等各环节,患者都应拥有“发言权”。
4.3 以医保准入为例,发挥HTA审慎评议制度的决策支持作用医疗机构主要关注治疗方案的安全性和有效性维度,医疗保障部门更关注资金配置效率与预算影响是否合理,而患者则希望能够最大化治疗获益及降低经济负担,不同利益相关方价值偏好的冲突凸显了HTA审慎评议应用于医保报销决策的社会价值。目前医保准入与报销决策更多地利用了药物经济学的理论与方法,而在决策流程的规范化以及对流程与结果的质量控制方面仍存在不足。将HTA审慎评议机制纳入医保准入与价格谈判等操作层面,不仅可以识别优先卫生技术,促进卫生资源的合理配置,对于高质量报告的产出与传播也具有一定的积极作用,有利于促进医保准入和报销决策透明、负责、公平,并为关键利益相关方所接受。
4.4 支持决策转化,探索HTA审慎评议制度拓展到试点实践领域鉴于审慎评议在HTA和医疗卫生资源配置中的重要作用,有必要在中国HTA中引入审慎评议这一概念。但目前关于审慎评议的研究多集中在理论研究层面,其实践的有效性仍有待考量,包括了解与HTA机构相关的特定文化、卫生系统、政治结构等关键环境要素以及不同委员会评估模式的潜在影响等,均需通过实践进行论证与评估,实现审慎评议机制的效率改进。我国目前HTA决策转化的适宜路径尚未明确,HTA审慎评议更强调科学决策的过程,以透明、包容、公正为原则的审慎评议机制规范了卫生决策流程,有利于提高HTA能力建设,对于决策转化的有效落实起到一定的推动作用,促进循证决策纳入宏观国家决策参考之中。
·作者声明本文无实际或潜在的利益冲突
| [1] |
HEALTH TECHNOLOGY ASSESSMENT INTERNATIONAL. What is HTA?[EB/OL]. (2020-12-13)[2021-07-02]. https://htai.org/about-htai/.
|
| [2] |
GAUVIN F P. What is a deliberative process? Fact sheet: for up-to-date-knowledge relating to healthy public policy[R]. Ottawa: The National Collaborating Centre for Healthy Public Policy, 2009.
|
| [3] |
BOND K, STIFFELL R, OLLENDORF D A. Principles for deliberative processes in health technology assessment[J]. Int J Technol Assess Health Care, 2020, 36(4): 445-452. DOI:10.1017/S0266462320000550 |
| [4] |
BLACKSHER E, DIEBEL A, FOREST P G, et al. What is public deliberation?[J]. Hastings Cent Rep, 2012, 42(2): 14-17. DOI:10.1002/hast.26 |
| [5] |
ABELSON J, FOREST P G, EYLES J, et al. Deliberations about deliberative methods: issues in the design and evaluation of public participation processes[J]. Soc Sci Med, 2003, 57(2): 239-251. DOI:10.1016/S0277-9536(02)00343-X |
| [6] |
BOND K. Deliberative processes in health technology assessment: prospects, problems, and policy proposals: HTAi global policy forum, New Orleans, 2020[EB/OL]. [2021-08-02]. https://htai.org/wp-content/uploads/2020/02/HTAi_GPF-newOrleans_program_background-paper.pdf.
|
| [7] |
BOND K. Guide to constructing principles for deliberative processes in HTA: HTAi Global Policy Forum, New Orleans, USA, 2020[EB/OL]. [2021-08-02]. https://htai.org/wp-content/uploads/2020/02/HTAi_GPF-newOrleans_program_guide-to-constructing-principles.pdf.
|
| [8] |
ROSENBERG-YUNGER Z R S, BAYOUMI A M. Transparency in Canadian public drug advisory committees[J]. Health Policy, 2014, 118(2): 255-263. DOI:10.1016/j.healthpol.2014.08.010 |
| [9] |
ASPLIN B R, MAGID D J, RHODES K V, et al. A conceptual model of emergency department crowding[J]. Ann Emerg Med, 2003, 42(2): 173-180. DOI:10.1067/mem.2003.302 |
| [10] |
OXMAN A D, LAVIS J N, LEWIN S, et al. Support tools for evidence-informed health policymaking (STP) 1: What is evidence-informed policymaking?[J]. Health Res Policy Syst, 2009, 7(Suppl 1): S1. |
| [11] |
GLASGOW R E, ESTABROOKS P E. Pragmatic applications of RE-AIM for health care initiatives in community and clinical settings[J]. Prev Chronic Dis, 2018, 15: 170271. DOI:10.5888/pcd15.170271 |
| [12] |
OORTWIJN W, JANSEN M, BALTUSSEN R. Use of evidence-informed deliberative processes by health technology assessment agencies around the globe[J]. Int J Health Policy Manag, 2020, 9(1): 27-33. |
| [13] |
CULYER A J. Where are the limits of cost-effectiveness analysis and health technology assessment?[J]. J Med Assoc Thai, 2014, 97(Suppl 5): S1-S2. |
| [14] |
WEEKS L, POLISENA J, SCOTT A M, et al. Evaluation of patient and public involvement initiatives in health technology assessment: a survey of international agencies[J]. Int J Technol Assess Health Care, 2017, 33(6): 715-723. DOI:10.1017/S0266462317000976 |
| [15] |
ROZMOVITS L, MAI H, CHAMBERS A, et al. What does meaningful look like? A qualitative study of patient engagement at the Pan-Canadian oncology drug review: perspectives of reviewers and payers[J]. J Health Serv Res Policy, 2018, 23(2): 72-79. DOI:10.1177/1355819617750686 |
| [16] |
BALTUSSEN R, JANSEN M P, MIKKELSEN E, et al. Priority setting for universal health coverage: we need evidence-informed deliberative processes, not just more evidence on cost-effectiveness[J]. Int J Health Policy Manag, 2016, 5(11): 615-618. DOI:10.15171/ijhpm.2016.83 |
| [17] |
OORTWIJN W, DETERMANN D, SCHIFFERS K, et al. Towards integrated health technology assessment for improving decision making in selected countries[J]. Value Health, 2017, 20(8): 1121-1130. DOI:10.1016/j.jval.2017.03.011 |
| [18] |
OORTWIJN W, JANSEN M, BALTUSSEN R. Evidence-informed deliberative processes. A practical guide for HTA bodies for legitimate benefit package design. Version 2.0[R]. Nijmegen: Radboud University Medical Center, 2021.
|
| [19] |
BALTUSSEN R, JANSEN M, BIJLMAKERS L. Stakeholder participation on the path to universal health coverage: the use of evidence-informed deliberative processes[J]. Trop Med Int Health, 2018, 23(10): 1071-1074. DOI:10.1111/tmi.13138 |
 2022, Vol. 25
2022, Vol. 25


