2. 上海市卫生和健康发展研究中心(上海市医学科学技术情报研究所), 上海 200031;
3. 上海市奉贤区医疗保险事务中心, 上海 201400
医用耗材是卫生技术的重要组成部分,是医疗服务供给的重要支撑。长期以来,我国大多数地区医用耗材的医疗保险(以下简称“医保”)准入管理相对滞后,与当前医疗技术发展及临床服务不适应[1-2]。国家医疗保障局成立后,积极转变医用耗材的管理模式,探索构建基于准入法的“基本医疗保险医用耗材目录”,突出强调将临床价值高、经济性评价优良的医用耗材优先纳入。但医用耗材与药品在市场准入、卫生技术评估(health technology assessment, HTA)等多个方面存在明显差异[3],探索基于医用耗材的特点构建适宜的医保准入机制是当前亟待解决的重要议题。现简要梳理医用耗材医保准入的国际实践经验及挑战,结合国内实践,提出我国医用耗材医保准入优化策略及建议,为我国政府医用耗材医保准入改革提供依据。
1 国际医用耗材医保准入实践经验及挑战 1.1 基于HTA的医用耗材医保准入是国际主要运作机制欧洲等地区和澳大利亚、加拿大等多数国家通常采用HTA程序及方法进行医用耗材的医保准入[4]。如英国国家健康临床优化研究院(National Institute for Health and Care Excellence, NICE)、澳大利亚医疗服务咨询委员会(Medical Services Advisory Committee, MSAC)、加拿大药物和卫生技术局(Canadian Agency for Drugs and Technologies in Health, CADTH)等机构承担其国家的医用耗材HTA工作[5-11],基于HTA的评估结果支撑医用耗材医保目录准入。HTA程序一般包括申请、评估、评审及决策等。但各国的医用耗材运作机制略有不同。(1)从评估范围来看,英国及加拿大基于确定的遴选原则选择部分医用耗材进行评估,澳大利亚则对申请的医用耗材全部进行评估。(2)从评估实施来看,英国和加拿大主要通过独立的评估团队来开展,而澳大利亚则通过申请人开展,由独立的学术团体进行复核。(3)从评估准入的阈值来看,英国明确增量成本-效果比阈值,而澳大利亚及加拿大则为隐性阈值。(4)从决策效力来看,英国及加拿大的评估机构具有较强的决策权,而澳大利亚则为推荐建议。
1.2 医用耗材医保准入与支付标准衔接呈现多种模式国际上,一般医用耗材医保准入与支付标准形成同步衔接。总体来看,医用耗材支付标准的形成主要有3种模式。(1)基于HTA的价值定价,如英国、澳大利亚及加拿大等国家通过经济学评价结果及阈值合理测定医用耗材的价值,作为医保支付标准的主要参考。(2)基于临床获益程度分类形成溢价及定价规则,如在无明显获益进行同类产品的参考定价,有明显获益情况则根据获益的大小进行分类,基于分类结果确定相应的溢价谈判规则,典型的国家包括德国及法国等[12]。(3)基于多维价值综合评分确定相应的支付标准制定规则,如韩国对于创新医用耗材,采用医用耗材评分工具vas2(Value Appraisal Standard 2)进行综合评分,内容包括了临床效果、成本-效果及生活质量等维度,针对评估医用耗材相对对照品的改善程度综合评分确定相应明确的溢价规则,以此作为定价的依据[13]。
1.3 国际医用耗材HTA准入机制面临的挑战基于HTA准入机制医用耗材医保准入面临的挑战包括以下几个方面:一是评估的证据不足,医用耗材通常缺少临床试验,这主要与各国医用耗材市场准入过程中临床试验数据要求明显低于药品相关[3, 14]。二是学习曲线有差异。医用耗材的效果不仅取决于其本身,更与使用者的技能与熟练度有关,各地区间医用耗材的培训投入及实施时间的长短可造成学习曲线的差异,进而反应在临床效果上的变异[15]。三是成本的测量有差异,医用耗材成本不仅包括一次性耗材成本,也包括维护成本,其平均成本与申请地区的服务量等紧密相关,使得不同地区及机构间成本存在较大差异。四是医用耗材更新及定价调整频繁[16],表现为产品在短时间内更新换代,其价格也经常随市场变动。以上这些均对HTA及结果的稳定性提出了挑战,在一定程度上造成了医保准入决策的不确定性。
2 我国医用耗材医保准入机制实践及优化策略 2.1 我国医用耗材医保准入机制处于探索起步阶段长期以来,我国医用耗材的管理采用排除法,多数地区没有形成医用耗材的目录。仅有少数地区进行了医用耗材目录管理。如2009年上海市探索对医用耗材实行目录管理,2010年进一步要求对医用耗材的安全性、有效性、适宜性评估并综合临床需求、医保基金承受能力及卫生技术评估结果形成医保准入决策,逐步形成了上海市的高值医用耗材编码库。2019年上海公布了《可另收费的一次性使用医疗器械目录》,以进一步强化医用耗材的目录管理[17]。从以上实践来看,上海市前期的探索经验与当前医用耗材目录化管理高度一致,且同国际的HTA理念较一致,是值得参考的实践经验。
2.2 探索构建基于价值导向的医用耗材分类准入及支付的新机制基于国内外实践经验,研究认为我国医用耗材医保准入机制应关注2个维度:一是突出价值导向,二是突出分类管理。其中,价值导向是多元的综合价值,如临床价值、经济价值,以及与各地医保相适应的适宜可及等。分类管理突出医用耗材精准分层,区分不同价值下的准入管理路径。具体来看,新机制主要由4个环节组成,包括申请、综合评审、支付标准确定及结果发布实施。其中,综合评审基于申报医用耗材的综合价值确定分类准入,包括谈判准入、直接准入及不予准入。对于临床价值高且费用高的医用耗材探索建立HTA机制,以支撑准入决策及支付标准确定(图 1)。
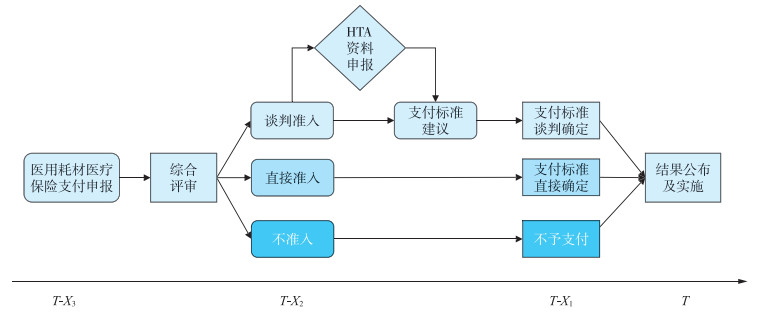
|
注:HTA为卫生技术评估(health technology assessment);T为时间,X1、X2、X3是指时间间隔变量。 图 1 我国医用耗材医疗保险准入决策机制 |
医用耗材医保准入申报主体可以是医疗机构或医用耗材企业,以提升申请广度及效率。申请资料应涵盖以下几个方面:医用耗材的基本情况(包括名称,所属的一级、二级及三级目录类别,材质、规格、产地及注册证号等)、对照品、创新类别(如是全新的、第二代或下一代更新产品,替代技术还是补充技术),以及相对对照品在安全性、效果、费用、创新、适宜及效率方面的改善程度及证据质量等。
2.2.2 医用耗材申报的综合评审综合评审的目的是对已申报的医用耗材的价值进行筛选及准入分层,以提升准入的效率。综合评审专家组应涵盖医用耗材管理、医保管理及卫生经济等多学科专家。基于已有申报数据,综合评审专家组从多维价值进行综合评价及评分,基于评估结果分类确定医保耗材的医保准入路径,如对独家创新性及价格高的医用耗材进行谈判准入,针对临床获益大且价格较低的医用耗材进行直接准入,针对效果差且费用高的医用耗材不予准入。
2.2.3 谈判准入医用耗材的HTA针对需要谈判准入的医用耗材,申请医院或企业应进一步提交相应的HTA申请材料。HTA证据处理主要分为两个环节:①HTA资料的申请;②HTA申请资料评审及支付标准建议。申请评估的资料主要包括临床需求、安全性、有效性等数据。HTA专家评审则聚焦结果的真实可靠性、数据的调整及撰写评价报告,综合提出医保支付标准建议。见图 2。
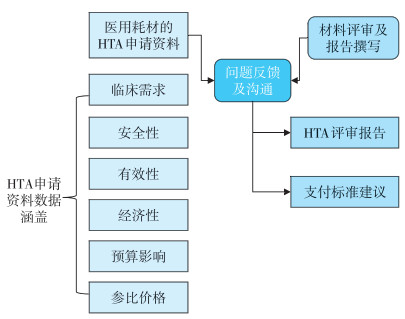
|
注:HTA为卫生技术评估(health technology assessment)。 图 2 卫生技术评估资料提交及评审 |
针对需要谈判确定的医用耗材,在基于HTA测算支付标准的建议上,组织专家组对相应医用耗材的价格进行谈判协商,当满足条件时予以准入并确定支付标准。对于直接准入的医用耗材,根据其同类产品的支付标准情况参比或集中采购、阳光采购平台数据等确定,并根据其对医保基金冲击情况确定是全额还是部分支付以及支付比例。
2.2.5 医用耗材医保准入的周期各地应根据医保管理配置实际明确医用耗材医保准入的申报周期,一般不超过1个季度。针对不同价值的医用耗材,可设置不同周期的申报通道,以加快准入和可及。如对重大创新、经济性高、临床迫切需求、涉及特殊群体的医用耗材等给予快速准入及支付。其他类技术则采用常规准入及支付处理。
2.2.6 医用耗材医保准入配套工具及机制以上基于申请评估的准入机制实施需要配套条件。一是管理机制上需要构建专家评审委员会及专家团队,可以结合医学会、高校及研究机构等人才资源。二是开发相应的申请工具表格,以规范申请者材料内容及确保质量,包括综合评审工具表、HTA申请工具表等。三是探索构建相应数据库,包括申报纳入医用耗材及同类对照品的多维度价值信息,以支撑后续评估。四是构建医用耗材的谈判机制,包括谈判规则及谈判流程等内容的开发构建。
· 作者声明本文无实际或潜在的利益冲突
| [1] |
杨建龙. 我国高值医用耗材医保准入管理探究[J]. 中国医疗保险, 2020(8): 17-21. |
| [2] |
肖月, 邱英鹏, 赵羽西, 等. 价值医疗视角下高值医用耗材的综合治理改革[J]. 中国医院管理, 2021, 41(3): 1-5. |
| [3] |
CIANI O, WILCHER B, VAN GIESSEN A, et al. Linking the regulatory and reimbursement processes for medical devices: the need for integrated assessments[J]. Health Econ, 2017, 26(Suppl 1): 13-29. |
| [4] |
FUCHS S, OLBERG B, PANTELI D, et al. Health technology assessment of medical devices in Europe: processes, practices, and methods[J]. Int J Technol Assess Health Care, 2016, 32(4): 246-255. DOI:10.1017/S0266462316000349 |
| [5] |
吕兰婷, 余浏洁. 英国NICE医用耗材准入流程及启示[J]. 中国医疗保险, 2019(10): 77-80. |
| [6] |
NATIONAL INSTITUTE FOR HEALTH AND CARE EXCELLENCE. Technology appraisal processes[EB/OL]. (2018-04-20)[2021-07-05]. https://www.nice.org.uk/about/what-we-do/our-programmes/nice-guidance/nice-technology-appraisal-guidance/process.
|
| [7] |
茅艺伟, 陈英耀, 唐檬, 等. 澳大利亚卫生技术评估的应用[J]. 中国卫生资源, 2014, 17(6): 484-486. DOI:10.3969/j.issn.1007-953X.2014.06.037 |
| [8] |
MEDICAL SERVICES ADVISORY COMMITTEE. MSAC process framework[EB/OL]. (2016-03-20)[2021-07-05]. http://www.msac.gov.au/internet/msac/publishing.nsf/Content/msac-process-framework.
|
| [9] |
BULFONE L, YOUNIE S, CARTER R, 等. 卫生技术评估: 澳大利亚的反映[J]. 中国药物经济学, 2010(3): 65-82. DOI:10.3969/j.issn.1673-5846.2010.03.009 |
| [10] |
郭祖德, 周萍, 夏志远, 等. 加拿大卫生技术评估机构研究: 以加拿大药物和卫生技术局为例[J]. 中国卫生资源, 2016, 19(3): 187-190. |
| [11] |
CANADIAN AGENCY HEALTH. CADTH reimbursement reviews process in brief[EB/OL]. (2021-07-19)[2021-07-20]. https://www.cadth.ca/cadth-reimbursement-reviews-process-brief.
|
| [12] |
吕兰婷, 付荣华. 德国卫生技术评估决策转化路径及方法探析[J]. 中国卫生政策研究, 2017, 10(4): 51-56. DOI:10.3969/j.issn.1674-2982.2017.04.009 |
| [13] |
丁锦希, 黄新锋, 李伟, 等. 域外高值医用耗材医保准入制度研究及我国启示[J]. 上海医药, 2021, 42(1): 65-69. DOI:10.3969/j.issn.1006-1533.2021.01.015 |
| [14] |
DAUBNER-BENDES R, KOVÁCS S, NIEWADA M, et al. Quo Vadis HTA for medical devices in central and eastern Europe? Recommendations to address methodological challenges[J]. Front Public Health, 2021, 8: 612410. DOI:10.3389/fpubh.2020.612410 |
| [15] |
明坚, 魏艳, 何运臻, 等. 医疗器械和诊断产品的卫生技术评估路在何方: 基于国际经验的启示[J]. 中国医疗保险, 2021(6): 69-74. |
| [16] |
PESQUÉ R, PERCHERON R, CORDONNIER A L, et al. Health technology assessment of innovative medical devices: timing and decision at national and local level[J]. Ann Pharm Fr, 2020, 78(2): 189-197. DOI:10.1016/j.pharma.2019.10.002 |
| [17] |
上海市医疗保障局, 上海市卫生健康委员会. 关于公布本市医疗机构《可另收费的一次性使用医疗器械目录》的通知: 沪医保价采[2019] 84号[A]. 2019.
|
 2021, Vol. 24
2021, Vol. 24


