2. 青海省疾病预防控制中心, 青海 西宁 810007;
3. 上海市第十人民医院, 上海 200070
疫苗是一种作用于人体的预防性生物制品,可以预防急性传染病及与感染相关的慢性病[1]。根据世界卫生组织的报告,每年全球有250多万儿童因接种疫苗避免了死亡[2]。因此,国家的免疫规划事业关系到国民身体素质。
作为全民公费医疗的代表国家之一,英国于1948年建立了国家医疗服务体系(National Health Service, NHS),如今NHS已发展为欧洲最大的公费医疗制度,世界卫生组织认为NHS是世界上最好的医疗服务体系之一。作为NHS的重要组成部分,免疫接种系统承担着保障英国民众健康的重任。尽管免疫接种在英国不具有强制性,但英国政府发布的资料显示,近3年英国儿童的疫苗接种率均高于世界卫生组织规定的95%[3],这从侧面反映出人们对NHS的高度信任和英国免疫接种工作的有条不紊。
现系统梳理英国免疫接种系统及其工作程序,并从疫苗的采购、配送及异常反应监测等方面与我国进行比较,以期为我国免疫接种工作提供借鉴和启示。
1 资料与方法通过浏览国家卫生健康委员会、中国疾病预防控制中心(以下简称“疾控中心”)、英国卫生部、国际疫苗联盟等政府机构及国际组织的官方网站,收集中英两国疫苗采购、配送和管理的相关政策、文件、新技术应用等信息。同时,检索中国知网、PubMed等中英文数据库,系统评阅、梳理中英两国疫苗采购、配送和管理的主要模式,剖析相关模式的优缺点及对我国免疫接种工作的启示。
2 结果 2.1 免疫接种工作体系 2.1.1 背景英国所有的免疫接种工作均由NHS来执行。与中国一类和二类疫苗相似,英国的疫苗也分为2类:一类是纳入国家免疫规划的疫苗,由NHS统一采购并免费提供给公民接种;另一类是NHS未提供的疫苗和旅行疫苗,需英国公民自费接种。与NHS提供的疫苗相比,英国的私人疫苗市场规模微不足道。英国仅在20世纪初执行强制接种政策。
由于英国并非甲型肝炎、乙型肝炎的流行地,甲型肝炎疫苗、乙型肝炎疫苗未纳入国家免疫规划。英国儿童在2 ~ 6岁每年需注射一次儿童流行性感冒疫苗。纳入英国国家免疫规划的疫苗与中国一类疫苗的比较见表 1。
| 表 1 纳入英国国家免疫规划的疫苗与中国一类疫苗比较 |
|
|
卫生部主导英国免疫接种政策的制定和实施,下设免疫接种处和采购投资商业局,前者负责制定并实施免疫接种政策,后者负责疫苗的采购和分发。疫苗接种和免疫联合委员会(Joint Committee on Vaccination and Immunization, JCVI)作为提供免疫接种政策建议的唯一法定专家委员会,其职责是就传染性疾病和免疫接种可预防疾病的相关事宜向卫生部部长提供建议[4]。英国药品和健康产品管理局(the Medicines and Healthcare Products Regulatory Agency, MHRA)负责监测疫苗上市后的安全问题,下设国家生物标准及控制研究院、临床试验研究数据链及综合监督管理中心3个职能部门,共同致力于保障和促进公共卫生服务。人用药品委员会(the Commission on Human Medicines, CHM)就疫苗的安全性、质量和功效向MHRA提供专家建议。见图 1。
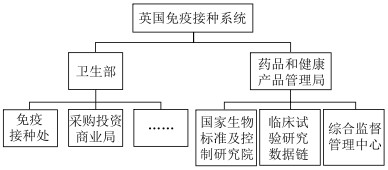
|
图 1 英国免疫接种系统组织结构 |
纳入英国国家免疫规划的疫苗由卫生部统一招标采购。首先,卫生部的免疫接种处会确定该疫苗的供应要求,包括品种和所需数量,并在欧洲联盟官方公报(Official Journal of the European Union,OJEU)及网站上刊登广告,邀请疫苗生产企业投标。在选择疫苗生产企业时,原则上卫生部的目标是使预算所得的质量调整生命年(quality-adjusted life years, QALY)最大化,目前的成本效益阈值为每QALY 20 000英镑,并且综合考虑企业以往合同的安全性、有效性、可用性和价格等。合同有效期通常为1年,可延长1年,这保证了疫苗采购的灵活性。续约可确保疫苗价格在第2年保持不变。其次,出于对供应安全的考虑,只要有可能,卫生部会选择多个供应商。英国的全科医生通过政府指定的网站(ImmForm)订购疫苗。通常,全科医生可以选择他们青睐的生产企业。
我国的疫苗供应一直采用由疾控中心统一管理的计划管理模式。2016年我国修订《疫苗流通和预防接种管理条例》后,一类和二类疫苗均经省(自治区、直辖市)级公共资源交易平台采购。由国家组织一类疫苗集中采购的省(自治区、直辖市)由省(自治区、直辖市)级疾控中心根据当地传染病预防控制的需要、结合国家免疫规划制定一类疫苗的需求计划。国家负责采购一类疫苗的部门会进行招标,并与中标的生产企业签订政府采购合同。疫苗生产企业会按照合同约定的疫苗品种、数量以及价格等,向省(自治区、直辖市)级疾控中心供应一类疫苗。省(自治区、直辖市)级疾控中心承担一类疫苗的分发工作,组织各区(县)在公共资源交易平台上集中采购二类疫苗,不同省(自治区、直辖市)的采购方案不同,但总体框架一致,即由省(自治区、直辖市)级机构组织疫苗的首次遴选,形成该省(自治区、直辖市)二类疫苗推荐目录,使符合资质要求的疫苗进入省(自治区、直辖市)公共资源平台,区(县)级疾控机构按需采购。
2.2.2 疫苗生产企业疫苗行业的市场集中度非常高,世界五大跨国疫苗生产商占据了全球市场份额的80%。其中,排名第一的葛兰素史克公司(GlaxoSmithKline)占全球市场份额的24%[5],其产品主要为先进的联合疫苗,且已开始使用基因技术研发新疫苗。相比之下,作为我国最大的疫苗生产企业,中国生物技术集团公司仅占全球市场份额的2%,且已有疫苗的种类,新疫苗的研发、生产技术和国际认证的成熟性等方面较五大跨国疫苗生产商仍有较大差距。就疫苗生产企业的数量而言,英国制药行业协会有64家注册公司,但其中只有7家获得了英国卫生部批准的疫苗生产资格。相比之下,我国疫苗市场的生产企业数量庞大,有45家,但企业规模普遍较小,产业集中度较低,产业素质有待提高。
2.3 冷链配送疫苗从生产到接种都需要存储于医药级冷藏设备中,且规定温度为2℃ ~ 8℃。目前,疫苗运输主要有2种模式:内部供应链和外包供应链。内部供应链是指由政府部门管理疫苗采购和流通的整个过程,流程一般为疫苗生产企业—省(自治区、直辖市)级疾控中心—各级疾控机构—接种单位。外包供应链是指政府部门为了在整个供应链中确保疫苗的质量并降低成本,委托专业的第三方冷链物流公司进行疫苗储存、配送工作,疫苗供应链外包策略能弥补疫苗供应资源的不足,提升疫苗供应的绩效[6]。
英国的疫苗运输采用外包供应链,卫生部通过竞争性招标购买全国的疫苗储存和分发服务,每3~5年拟定一份合同。现任承包商为Movianto UK Ltd.,其从疫苗生产企业接收疫苗并妥善存放,每周或每2周将疫苗送到接种单位,配送费用由英国卫生部支付。我国各省(自治区、直辖市)的疫苗配送情况不一。通常各级疾控中心均配有冷库、冷藏运输车,如江苏和广东的所有疫苗均由市疾控中心通过冷链系统统一分发到各接种单位[7],也有一些地区积极探索通过政府购买服务的方式配送疫苗,如北京、上海、天津等[8]。
2.4 异常反应监测与处理 2.4.1 异常反应监测系统英国于1968年建立了自愿报告系统(spontaneous reporting system, SRS)。SRS采用黄色卡片以提高医务人员对药品异常反应、疑似预防接种异常反应(adverse events following immunization, AEFI)的警惕性,故SRS又称黄卡计划[9]。目前SRS采取主动监测的方式,英国所有的医师和患者可通过网站、电话、电子邮件等多种形式反馈异常反应。报告者提交黄卡后,所有电子和纸质报告会立即进入由MHRA管理的异常反应数据库。持续审阅黄卡报告和搜索安全信号可以识别以前没有发现过的药品或疫苗安全问题,并为后续进一步调查提供科学依据。黄卡数据会与其他药品监管数据、医药文献以及临床试验数据一起由药品安全专家团队进行评估。MHRA根据评估结果进行相应的监督管理,如召回疫苗,更多的是对疫苗上市许可证的修订,如改进使用限制、剂量说明等。
我国于1988年在北京和上海等地区的14家医疗机构开展药品异常反应报告试点工作[10]。2005年,我国正式建立专门的AEFI监测系统,并通过全国预防接种信息管理系统进行网络直报。区别于英国的主动监测,我国的AEFI监测系统采用传统的被动监测方式,即需要家长主动向提供预防接种服务的门诊报告儿童AEFI,由门诊报告给当地疾控中心,由疾控中心专业人员在AEFI监测系统填报信息并开展后续调查。监测的灵敏度在较大程度上依赖于患儿家长的报告意识,因此,监测掌握的AEFI发生率可能低于实际水平。2010年发布的《全国疑似预防接种异常反应监测方案》对调查时间有明确的规定,区(县)级疾控机构应在接到报告后48 h内展开调查,且需在调查开始后3 d内完成AEFI个案调查表。不同于英国将AEFI数据与其他药品监督管理数据、临床试验数据进行联合分析,我国的AEFI数据目前主要集中在各级疾控中心,且AEFI监测系统与我国药品异常反应监测系统互相独立,监测信息难以共享。
2.4.2 疫苗损害赔偿制度英国于1979年通过了《疫苗损害赔偿法》,主张用非诉讼方式解决免疫接种后的异常反应[11]。该法案规定由国家向受损害的家庭进行赔偿,赔偿金额从最开始的1万英镑逐年提高到目前一次性免税支付12万英镑。赔偿流程为:由受种者本人或其监护人在接种后6年内填写索赔申请表,包括受种者、接种单位、接种疫苗的详细信息以及接种记录,并发送至卫生部疫苗损害赔偿科(Vaccine Damage Payments Unit),通过调查后即会发放赔偿金。如果调查认为受种者不符合赔偿条件,受种者还可继续向社会保障法庭申诉。该法庭独立于政府,可以保证仲裁的公平性,且对申诉时间和次数没有限制。
在《疫苗管理法》未正式实施之前,我国《疫苗流通和预防接种管理条例》规定:由一类疫苗引起的AEFI且需要给予补偿的,补偿金由政府相关部门从预防接种经费中支出;由二类疫苗引起的AEFI且需要给予补偿的,补偿金由疫苗生产企业承担。同时,国家鼓励以商业保险等形式进行补偿。《疫苗流通和预防接种管理条例》仅按照疫苗分类规定了相应的补偿主体和费用来源,但是对具体的补偿标准和办法并未作明确阐述。因此,各省(自治区、直辖市)颁布了关于疫苗损害补偿的相关文件应对可能的AEFI。例如,2015年上海出台的《上海市预防接种AEFI补偿办法》按照“分项目计算,按级别限额”的方式进行补偿,同时根据各类AEFI的特点建立了快速补偿通道。但各省(自治区、直辖市)的补偿标准和办法也各不相同,易引发“同命不同价”的现象,2016年一项关于我国疫苗致损救济制度的研究[12]显示,在相同条件下,北京市的补偿金额比四川省高出几十万元。
最新出台的《疫苗管理法》规定:“国家对补偿范围实行目录管理,并根据实际情况进行动态调整。”这一规定将使AEFI的调查和诊断更为科学规范,补偿更为公平合理。只有收集、整理和分析大量AEFI数据,才能建立目录以确保补偿在全国范围内相对公平,在规定实施后根据实际情况及时调整。
3 讨论与建议 3.1 生产源头:提高疫苗生产企业的准入门槛疫苗是一种特殊的药品,对疫苗生产企业应实行严于一般药品生产企业的准入制度。相比英国只有7家企业获得卫生部批准的疫苗生产资格,我国有多达45家疫苗生产企业获批,但获批企业的规模化、集中化程度均不高。对此,政府应通过宏观政策逐步引导行业提升集中度,通过提高市场准入门槛、加强产业规划、推进企业重组整合等方式适当减少我国疫苗生产企业的数量,在日常监督管理中淘汰一些落后产能、不合规、生产品种单一的企业,形成以核心、骨干企业为主的行业格局。同时,这些核心、骨干企业在新技术、新品种的研发上要起带头作用,加强企业研发投入,在疫苗的种类、生产技术和国际认证等方面积极向国际领先水平靠拢。另外,还应进一步完善政府采购机制,加大对部分紧缺苗种的采购力度,出台相应的应急预案,确保在提高疫苗生产企业准入门槛的同时保证国内疫苗及时供应。
3.2 流通运输:大力发展我国医药冷链物流业疫苗生产企业的重心是新产品的研发、生产和质量控制,将疫苗的配送业务移交给第三方医药冷链物流公司可以解决运输过程中难以把控温度的问题。即使疫苗种类多、数量少或发货地零散,物流公司依然可以充分整合资源、多仓联动,以发挥其行业优势。所以,从企业的长远发展和医药市场的需求来看,由第三方冷链物流配送疫苗是未来的一大趋势。解决目前我国医药冷链物流业普遍存在的企业规模小、流通效率低、地域分散等问题的做法:首先,应鼓励中小企业自行建立运输联盟,在同一条供应链中相互合作,在确保有充足、稳定货源的基础上提高冷链设备的利用率;其次,我国偏远农村地区或山区的末端配送应在运输联盟的基础上自筹基金,成立医药冷链基金部门[13],同时可与各省(自治区、直辖市)的药品监督管理部门合作,按营业额的一定比例向药品生产企业、经营企业、医疗机构、零售药房等定期收取医药冷链发展税;最后,任何一个行业的发展都离不开人才,目前我国的医药冷链物流人才缺口很大,急需建立政府、高校、科研院所、医药企业、医疗卫生机构共育人才的模式,构建适应当前医药物流环境的产、学、研相结合的人才培养机制。
3.3 异常反应监测:逐步完善我国AEFI监测系统AEFI监测系统是获取异常反应第一手数据的有力抓手,对评价疫苗安全性和完善相应的损害赔偿制度至关重要。我国的AEFI监测系统应进一步提升灵敏度和分析效率:一方面应借鉴英国主动监测的模式,采用开放的、由被接种者自主填报的方式,同时鼓励接种单位与被接种者主动沟通,引导家长认识预防接种可能引发的异常反应,这样既可以提高监测的灵敏度,也可以减轻医务人员收集和整理数据的工作压力;另一方面,监测系统应积极对接我国药品异常反应监测系统、医疗系统,从而更深入地分析相关数据和案例,这有助于AEFI监测系统更好地发挥作用,从硬件上夯实我国疫苗安全监管的体系。
·作者声明本文无实际或潜在的利益冲突
| [1] |
张蕾. CDC对二类疫苗的经营现状[J]. 企业改革与管理, 2017(20): 99. |
| [2] |
SHIMAZAWA R, IKEDA M. The vaccine gap between Japan and the UK[J]. Health Policy, 2012, 107(2-3): 312-317. DOI:10.1016/j.healthpol.2012.05.012 |
| [3] |
PUBLIC HEALTH ENGLAND. Vaccine uptake guidance and the latest coverage data[EB/OL]. (2013-09-30)[2020-09-01]. https://www.gov.uk/government/collections/vaccine-uptake.
|
| [4] |
SUSSEX J, SHAH K. The publicly funded vaccines market in the UK[R]. London: Office of Health Economics, 2010.
|
| [5] |
范红, 于振行, 苏月, 等. 疫苗市场概况和发展趋势[J]. 中国医药, 2019, 14(6): 940-944. DOI:10.3760/j.issn.1673-4777.2019.06.034 |
| [6] |
LYDON P, RAUBENHEIMER T, ARNOT-KRUGER M, et al. Outsourcing vaccine logistics to the private sector: the evidence and lessons learned from the Western Cape Province in South-Africa[J]. Vaccine, 2015, 33(29): 3429-3434. DOI:10.1016/j.vaccine.2015.03.042 |
| [7] |
吴坚, 周祥国. 如皋市疫苗冷链管理的实践与建议[J]. 中国农村卫生事业管理, 2017, 37(10): 1201-1203. DOI:10.3969/j.issn.1005-5916.2017.10.021 |
| [8] |
阎立红, 高志刚, 宋旺. 天津市免疫规划疫苗储存配送服务外包管理策略[J]. 职业与健康, 2017, 33(11): 1565-1567. |
| [9] |
PUBLIC HEALTH ENGLAND. Surveillance and monitoring for vaccine safety: the green book, chapter 9[EB/OL]. (2013-03-20)[2020-09-01]. https://www.gov.uk/government/publications/surveillance-and-monitoring-for-vaccine-safety-the-green-book-chapter-9.
|
| [10] |
周围, 刘艾林, 杜冠华. 中国与英国药品不良反应监测制度的对比研究[J]. 中国药物评价, 2015, 32(6): 376-380. DOI:10.3969/j.issn.2095-3593.2015.06.015 |
| [11] |
MILLWARD G. A disability act? The vaccine damage payments act 1979 and the British government's response to the pertussis vaccine scare[J]. Soc Hist of Med, 2017, 30(2): 429-447. |
| [12] |
张雪娇. 我国疫苗致损救济制度存在问题及对策分析: 以现阶段救济制度及司法实践为视角[J]. 广西政法管理干部学院学报, 2016, 31(5): 50-58. DOI:10.3969/j.issn.1008-8628.2016.05.008 |
| [13] |
雍佳松, 杨世民. 我国医药冷链体系的现状及其发展建议[J]. 中国药房, 2014, 25(25): 2308-2311. DOI:10.6039/j.issn.1001-0408.2014.25.02 |
 2021, Vol. 24
2021, Vol. 24


