根据相关文件的精神,上海市需要推进临床检验创新成果的转化及临床实验室自建检测方法的临床研究应用。现从临床实验室自建检测方法的政策环境、现状、需求出发,讨论并提出政策建议,以期进一步推动临床实验室自建检测方法的政策落地。
1 临床实验室自建检测方法的政策环境美国临床病理学会(American Society for Clinical Pathologists,ASCP)将临床实验室自建检测方法定义为临床实验室自行研发、验证和使用的检测项目,项目仅在研发实验室内部使用,不作为商品出售给其他实验室、医院及个人[1-2]。不少国家及地区都允许临床实验室自建检测方法的开展。我国针对临床实验室自建检测方法至今没有明确的定义及适用范围,因此,当临床医疗有需求,但市场上无产品供应、不能有效满足临床需求的时候,建议临床实验室可自行研发检测方法和技术,但方法和技术仅限实验室内部使用。
近30年来,检验医学为疾病的预防、预测、临床诊断等提供了大量的基础数据,对临床医疗决策有较大贡献。
检验技术现已步入了分子技术时代。国外检测机构如美国LabCorp、德国SYNLAB开展的实验室检测项目已多达5 000多项,而目前我国大多数三级甲等医院开展的检验项目在500项左右。从分子技术角度看,国外检测项目达到2 000多项,而中国仅为145项左右(数据来源于《医疗机构临床检验目录(2013年版)》),造成检测项目数差距的主要原因是我国在临床实验室自建检测方法开展方面处于受限制状态。受限制的原因是临床实验室自建检测方法的过程可能涉及自行配制部分试剂和自行开发设备属试剂和设备没有取得药品监督管理部门批准,而根据国家法规和规章,临床实验室开展检测项目的试剂和设备需要取得批准(表 1)。因此,临床实验室自建检测方法因法规和政策的限制尚不能正常实施。
| 表 1 涉及限制实验室自建检测方法开展的相关管理规定汇总 |
|
|
对全市二级甲等及以上医疗机构和独立实验室及社会办医院共115家机构开展临床实验室自建检测方法的现况进行了问卷调查,仅有19家医疗机构表示开展临床实验室自建检测且反馈了开展临床实验室自建检测的情况,其中三级医疗机构16家、二级医疗机构1家、其他医疗机构2家。反馈的临床实验室自建检测方法中使用分子诊断技术的占73.55%,使用流式细胞技术的占4.35%,使用质谱技术的占20.65%,使用其他技术的占3.98%(部分检测方法需要同时涉及多项技术)。根据医疗机构的反馈进行现场调查,经确认全市开展临床实验室自建检测方法的项目数达到302项次,年检测量为823 135例。
2.2 临床需求临床实验室自建检测方法建立与临床需求密切相关,部分项目是指导用药的关键。例如,近几年相关部门要求在使用某些靶向药物前进行基因检测来提高药物的安全性和有效性,而这些基因检测项目往往属于临床实验室自建检测方法的范畴[3]。同时,约有80%的罕见病由基因缺陷导致[4],基因检测是认识、诊断、治疗罕见病的关键。但现阶段基因检测所涉及的设备和试剂没有医疗器械许可证,开展的项目所涉及的底物由实验室自行合成,医疗机构收费目录中没有具体收费项目,且部分项目较小众,厂商研制产品的动力不足,检测成本非常昂贵,仅靠临床研究的经费无法满足临床需求。
2.3 诊断依据临床检验的结果原则上是辅助诊断的依据,但是随着医学发展和科学技术的革新,部分新型的检查指标已经作为临床诊断的重要依据。如儿茶酚胺项目的指标已被作为嗜铬细胞瘤诊断的标准,临床医师根据患者的症状结合儿茶酚胺项目的指标,确定手术的指征,而该项目最准确的检测方法为高效液相色谱法[5],因没有试剂和医疗器械产品许可证,开展该项目属临床实验室自建检测方法,实验室无法出具正规的报告,检测结果仅在病例中体现,存在医疗不合规的风险。
2.4 管理盲点根据国家有关规定,仅试点单位可以开展高通量分子检测项目,上海市共有11家试点单位,其中开展遗传病诊断2家、产前筛查与诊断4家、肿瘤诊断与治疗5家,试点单位开展项目也受限制,仅作为临床试点不能收费。考虑到临床的需求,部分临床医师请患者自行赴基因公司进行检测[6],因基因公司属于非医疗机构,其检测过程和结果并不受卫生行政部门和药品监督管理部门的监督,其检测结果却被作为临床医师用药的依据,其中存在医疗隐患。
总之,一味禁止临床实验室自建检测方法的开展不利于医学检验技术和临床诊疗的发展,考虑医疗安全的因素,建议在规范管理的基础上推动临床实验室自建检测方法应用于临床。
3 临床实验室自建检测方法政策讨论 3.1 质量管理方面上海市临床实验室在人员资质、实验室设置、项目准入、质量管理方面有相关规定,美国临床实验室在人员资质和质量管理方面有规定,在实验室设置和项目准入方面无规定。上海市临床实验室在自建方法方面有限制,而美国临床实验室在此方面没有限制。上海市临床实验室有《医疗机构临床实验室管理办法》作为依据,而美国临床实验室遵循《临床检验改正修订计划》(Clinical Laboratory Improvement Amendments,CLIA)的要求。总的来说,上海市临床实验室的管理与美国相比更为严格。
3.2 参考政策方面药品监督管理部门在《药品管理办法》中提到,允许医疗机构配制制剂,可经所在地省、自治区、直辖市人民政府卫生行政部门审核同意,由省、自治区、直辖市人民政府药品监督管理部门批准,发给医疗机构制剂许可证。该政策沿用至今,放管结合有利于医疗机构配制制剂的管理。临床实验室自建检测方法有自配制剂,制剂管理的模式具有借鉴意义。
3.3 跨机构合作方面2015年,原国家卫生和计划生育委员会、原国家食品药品监督管理总局联合印发了《关于印发干细胞临床研究管理办法(试行)的通知》(国卫科教发〔2015〕48号)[7],将干细胞技术从3类医疗技术中划出。可通过医疗机构自我监管、卫生行政部门和药品监管部门联合日常监督管理、专家委员会和伦理委员会的技术支持来做好项目的管理工作。临床实验室自建检测方法同样受到卫生行政部门和药品监管部门的双重管理,可以借鉴干细胞技术的管理模式。
3.4 类似技术的管理方面2018年8月,国家卫生健康委员会出台了《医疗技术临床应用管理办法》(中华人民共和国国家卫生健康委员会令第1号)[8],要求对限制类技术实施备案管理,通过医疗机构申报、第三方评价机构评估的方式来确定该类技术是否可应用于临床,并最终以技术备案的方式予以实施。临床实验室自建检测方法可根据所涉及的技术进行划分,通过技术备案的方式予以管理。
3.5 定价管理方面2019年5月,上海市医疗保障局、上海市卫生健康委员会发布《关于继续做好本市新增医疗服务项目价格管理的通知》(沪医保价采〔2019〕35号)[9],提出对于全市首次开展的医疗技术,医疗机构可以申请服务项目价格,对于非首次开展的医疗技术,医疗机构可以先在卫生行政部门备案后再申请服务项目价格。申请的新技术不能与现行法律、法规、政策规定有抵触。临床实验室自建检测方法开展受到检测收费的限制,如打通新技术收费的环节,就解决了技术在临床上应用的症结。
总之,上海市有良好的临床实验室监管和新技术备案的管理基础,可以参照干细胞和药品制剂的管理模式,开展多部门协同监管,在确定项目的临床可及性的基础上,进一步确认制剂产品的质量和临床适用性。
4 政策建议 4.1 基本原则坚持试点先行、评估备案、强化监管、联合管理的政策管理原则,在政策实施的第一年,选取部分医疗机构开展试点工作,通过第三方机构评估,以卫生行政部门备案的方式开展运行,卫生行政部门和药品监管部门联合委托相关业务机构开展监管,确保项目安全、顺利地开展。
4.2 各临床实验室自建检测方法管理机构的职责临床实验室自建检测方法涉及的管理部门的管理范畴划定的建议见表 2。
| 表 2 各部门管理范畴建议 |
|
|
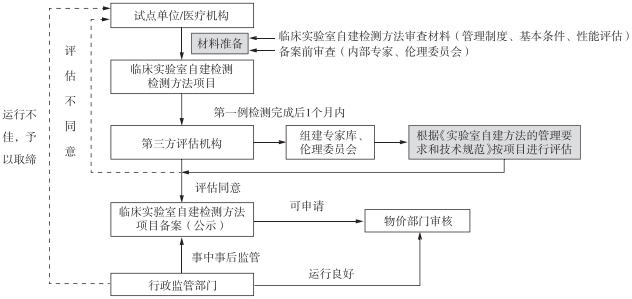
具体监管流程见图 1。
|
图 1 临床实验室自建检测方法管理的流程 |
调查发现,仅部分三级综合医院和专科医院有开展临床实验室自建方法的需求,可先行试点。试点实验室的遴选依据为实验室能力、资质水平、开展项目管理情况。试点的工作流程是针对现行医疗机构已开展或相对成熟的临床实验室自建检测方法,由第三方机构(专家委员会、伦理委员会)组织评估,在二代测序检测和质谱检测中选取部分医疗机构的部分项目予以试点运行,试点运行期间不可收取检测费用。试点运行为期半年,其间事中事后监管部门不定期进行现场督查。试点运行期结束后,医疗机构应对运行情况进行总结报告,报卫生行政部门和药品监督管理部门。根据试运行的结果,行政部门可甄别项目是否可持续开展及进入备案,并公示试运行情况。
4.3.2 备案管理(1)医疗机构。医疗机构应建立临床实验室自建检测方法立项审查程序和相关工作制度,立项前应按照相关立项审查程序和工作制度,由项目负责人提交项目备案材料以及项目伦理审查申请表。实验室主任为项目第一技术责任人。项目投入临床,完成第一例检测后1个月内,医疗机构向第三方评估机构提出评估申请。(2)第三方评估机构(专家委员会、伦理委员会)。按照卫生行政部门和药品监督管理部门对临床实验室自建检测方法项目的日常监管需要,及时了解本地区临床实验室自建检测方法的发展状况和存在问题,提出政策建议,提供技术支撑;对医疗机构提交的临床实验室自建检测方法项目申请进行评估,并出具评估报告;培训相关人员。(3)备案资料。项目备案应提交的资料包括机构的执业许可、概况、开展项目所需的资格及卫生技术人员、相关技术能力与设施情况,医疗机构学术委员会组成、标准操作规范,项目负责人、主要参与人员的情况和相关培训的情况等,项目开展的科学性、可行性,防范风险管理机制和处理不良反应事件的措施,检测项目的一致性和稳定性报告,检测项目临床适用性报告,检测项目的标准操作规程的制定,检测项目的质量管理、评价标准和相应的设备设施管理情况。涉及伦理项目需增加机构伦理委员会组成、标准操作规范;研究项目伦理审查过程和记录,包括风险/受益评估及对策等;对知情同意书的讨论和批准的样本;伦理审查程序的合理性证明。同时,建立临床实验室自建检测方法的技术规范,加强项目管理。
4.3.3 事中事后监管省级卫生行政部门和药品监督管理部门对备案名单实时予以公示,可以委托检查部门对医疗机构所开展的临床实验室自建检测方法项目进行定期监督检查、随机抽查、有因检查等,对发现的问题及时提出处理意见。医疗机构在运行临床实验室自建检测方法时有以下情形之一的,卫生行政部门和药品监督管理部门将责令其暂停项目、限期整改,并依法给予相应处理:①临床实验室自建检测方法项目开展质量管理体系不符合要求;②项目负责人不能有效履行其职责;③未履行备案手续的项目;④不及时报告发生的严重不良反应或不良事件、差错或事故等;⑤擅自修改检测方案;⑥不及时报送项目开展进展;⑦对随访中发现的问题未及时组织评估、鉴定,并给予相应的医学处理等。违反规定的处罚可参照《医疗技术临床应用管理办法》。
4.3.4 价格备案完成临床实验室自建检测方法备案的医疗机构可以向物价部门申请价格备案,价格备案可根据现有的新技术定价程序或参考同类技术收费标准开展,医疗机构可根据其项目开展的成本,结合项目开展的必要性说明、经济分析及相关证明资料(包括适用范围、操作规程、技术路径等)等内容,提出价格申请。上海市医疗保障局会同上海市卫生健康委员会等部门依照集体会议制度,定期召开会议,集体审议新项目价格标准、收费政策等,并向社会公布,提高定价的透明度。
作者声明本文无实际或潜在的利益冲突
| [1] |
GENZEN J R, MOHLMAN J S, LYNCH J L, et al. Laboratory-developed tests:a legislative and regulatory review[J]. Clin Chem, 2017, 63(10): 1575-1784. DOI:10.1373/clinchem.2017.275164 |
| [2] |
FOOD AND DRUG ADMINISTRATION, CENTER FOR DEVICES AND RADIOLOGICAL HEALTH. Framework for regulatory oversight of laboratory developed tests (LDTs). Draft Guidance for industry, Food and Drug Administration staff, and clinical laboratories[EB/OL].[2019-12-04]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/framework-regulatory-oversight-laboratory-developed-tests-ldts.
|
| [3] |
刘维薇, 郑特, 徐科, 等. 国外实验室自建项目管理带给我们的启示[J]. 中华临床实验室管理电子杂志, 2014, 2(3): 1-4. |
| [4] |
闵浩巍, 王飞, 姜召芸, 等. 罕见病基因治疗的研究进展[J]. 国际药学研究杂志, 2017, 44(2): 123-126. |
| [5] |
宋彦强, 李凤云, 李玮, 等. 生物样品中儿茶酚胺类物质分析方法的研究进展[J]. 中国卫生检验杂志, 2013, 23(5): 1339-1341. |
| [6] |
汪亮和他的团队.基因检测, 临床医生的"痛"和"通"[EB/OL].[2019-12-11]. http://www.360doc.com/content/17/0414/09/40218319_645479183.shtml.
|
| [7] |
国家卫生计生委, 国家食品药品监管总局.关于印发干细胞临床研究管理办法(试行)的通知: 国卫科教发[2015] 48号[A]. 2015.
|
| [8] |
中华人民共和国国家卫生健康委员会.医疗技术临床应用管理办法: 中华人民共和国国家卫生健康委员会令第1号[A]. 2018.
|
| [9] |
上海市医疗保障局, 上海市卫生健康委员会.关于继续做好本市新增医疗服务项目价格管理的通知: 沪医保价采[2019] 35号[A]. 2019.
|
 2020, Vol. 23
2020, Vol. 23


