近年来, 随着韩国国民健康保险体系的完善和医疗技术的不断创新, 医药费用快速增长, 政府财政负担沉重。因此, 韩国进行了医疗保险(以下简称"医保")制度改革。医保支付方式开始由按项目支付(fee-for-service, FFS)转变为基于疾病诊断相关分组(diagnosis related groups, DRGs)的预付制和按项目支付的混合支付。药品补偿目录从负目录(negative list system, NLS)调整为正目录(positive list system, PLS), 正目录中的药品医保机构予以补偿, 负目录中的药品医保机构不予补偿。此外, 韩国创新医疗技术的支付体系建设也取得了一定成果, 主要针对新药和其他创新医疗技术, 尤其是针对新药的支付流程和管理细节等值得深入探索。
1 韩国国民健康保险体系 1.1 韩国国民健康保险体系韩国国民健康保险是针对全体国民的强制性社会保险。国民健康保险公团(National Health Insurance Service, NHIS)的数据显示, 2010年全国医保参保人数4 890.7万, 占总人口的96.7%[1]。健康保险运作体系由投保人、NHIS、国民健康福祉部(Ministry of Health and Welfare, MOHW)、健康保险审查评价院(Health Insurance Review & Assessment Service, HIRA)和医疗机构(health care institutions, HCI)5大主体共同组成。
1.2 韩国医保支付体系 1.2.1 医疗服务项目医保支付方式20世纪90年代医保制度改革之前, 韩国实行FFS的传统支付制度[2]。20世纪90年代末, 韩国医保支付方式转变为以DRG和资源为基础的相对价值标准(resource-based relative value scale, RBRVS)为主。2013年, 韩国强制所有医院实行基于DRG的预付制(Korea Diagnosis Related Group-based Prospective Payment System, K-DRG/PPS), 针对7种疾病和住院护理[3]。
1.2.2 医保药品支付方式2006年, 韩国实施药品费用支出合理化计划(Drug Expenditure Rationalization Plan, DERP), 《健康保险改革法案》规定从2007年开始采用PLS, 制药商若想使新药进入报销目录, 必须递交经济学评价报告, NHIS会与有价值或必需的药品的制药商谈判, 形成报销价格[4]。
2 创新医疗技术支付政策 2.1 管理架构及组织分工韩国创新医疗技术收付费管理由多部门合作进行:MOHW负责计划和决策, 颁布法律, 制定政策以及管理和监督NHIS; 国家循证卫生保健合作机构(National Evidence-based Healthcare Collaborating Agency, NECA)负责对医疗服务项目进行卫生技术评估和健康干预; 国家食品和药品安全部(Ministry of Food and Drug Safety, MFDS)负责医疗设备和药品的准入; HIRA负责参保人员的报销, 服务包设计, 服务质量和卫生技术评估; NHIS负责管理全国健康保险计划、参保、筹资和支付[5]。韩国创新医疗技术收付费管理机制的职能分工见表 1。
| 表 1 韩国创新医疗技术收付费管理机构的职能分工 |
|
|
2000年以来, 韩国国民健康保险由独立的国家医保公司(National Health Insurance Corporation, NHIC)负责, 代替政府管理健康保险体系的运转和操作, 后更名为NHIS。NHIS是非营利性机构, 管理全国健康保险计划并提供保险服务, 包括征收保险费, 与医疗机构谈判签订合同, 支付医保费用和津贴等, 执行MOHW的政策。NHIS每年都与全国各级医院和制药商签订医疗费用合同, 对每项药品和治疗定下全国统一价格, 并实行医药分离。NHIS也负责创新医疗技术的支付。以肿瘤创新药品为例, 制药商若想使新药进入药品报销目录, 则需要向HIRA提交新药申请临床疗效报告和经济学评价报告, 分别由肿瘤审议委员会和经济评价分会审议, 由NHIS与制药商进行价格谈判, 最终由MOHW作出是否纳入药品报销目录的决策。
2.1.2 上市许可机构:MFDS2013年, 原韩国食品和药品管理局(Korea Food and Drug Administration, KFDA)更名为MFDS, 管理食品、功能性食品、药品、麻醉品、化妆品、准药品、医疗器械等相关的安全事务。MFDS下属的药品安全管理局(Pharmaceutical Safety Bureau, PSB)负责药品事务, 医疗器械安全管理局(Medical Device Safety Bureau, MDSB)负责医疗器械相关的政策、管理和安全评价相关事务, 国家食品和药物安全评估研究所(National Institute of Food and Drug Safety Evaluation, NIFDS)负责对食品、药品、化妆品和医疗器械进行审查、测试、分析、研究和风险评估。
2.1.3 技术评估机构:HIRA和NECAHIRA成立于2000年7月, 其主要职责有三:一是在MOHW的指导下审查医疗费用是否合理, 二是评估医疗服务提供行为是否恰当, 三是确保医疗服务的质量。2007年之前, 韩国的卫生技术评估工作由HIRA下设的卫生技术评估委员会承担; 2007年之后, 卫生技术安全性和有效性的评估工作由NECA负责, 卫生技术经济性的评估仍由HIRA负责[6]。
NECA成立于2007年, 隶属于MOHW。NECA下设卫生技术评估中心(Health Technology Assessment Center, HTA Center)。HTA Center通过评估创新医疗技术的安全性和有效性, 为政策制定者、卫生服务供需双方等不同利益相关方提供参考依据, 也可为临床治疗合理选择新技术提供实践依据, 进而提高卫生服务的质量, 确保医疗安全。
2.2 韩国新药支付及定价流程韩国采用PLS后, 制药商可以就经MFDS批准上市的新药进入医保目录向HIRA提出申请。申请流程为:首先由HIRA进行初步评估, 主要由HIRA药品福利计划评估委员会(Pharmaceutical Benefit Coverage Assessment Committee, PBCAC)和HIRA药品效益评估委员会(Pharmaceutical Benefit Evaluation Committee, PBEC)对提交申请的药物的价值进行审议, 评价其是否能够获得报销资格。初步评估后, 由HIRA下属药品报销评估委员会(Drug Reimbursement Evaluation Committee, DREC)审核初步评估结果, 并请相关领域的专家进行评议, 向HIRA提出积极推荐、有限推荐或不推荐列入PLS的建议。而该药能否列入PLS则由NHIS通过药品价格谈判决定。
NHIS主要通过价格用量协议与制药商进行谈判, 确定报销价格。从目前DREC的决策实践来看, 增量成本效果比(incremental cost-effectiveness ratio, ICER)是决定报销与否的关键因素。目前HIRA尚未颁布官方的ICER阈值, 而是基于决策实践, 考虑用人均国内生产总值作为ICER的参考阈值, 并根据疾病的严重性、社会负担、对生命质量的影响等因素进行灵活判断[7]。价格谈判时, 决定药品是否进入医保目录的因素有:制药商提交的经济学评价报告, 是否有类似药物, 适应证的必需性或严重性, 对医保预算的影响, 药品的专利状况, 对药品流通的影响, 药品国内研发费用以及药品在国外的价格, 在其他国家的报销状态等。此外, 当PBCAC认为药物满足医学必要的所有条件时(即没有其他可替代治疗方法; 药物用于严重危及生命的疾病; 药物用于非常罕见的疾病, 被认为是治疗这些患者的必要手段; 药物的健康益处是有证据支持的), 利益协调委员会(Benefit Coordination Committee, BCC)有权以基于双方立场的价格强制使该药物进入医保目录。HIRA和DREC审查期约为150 d, NHIS在60 d内与制药商进行价格谈判, 并制定报销价格, MOHW在30 d内作出最终决定。此外, 为了保证利益相关方的参与度和透明度, 制药商有机会参与听证程序和提出重新评审。韩国新药定价及支付流程见图 1。
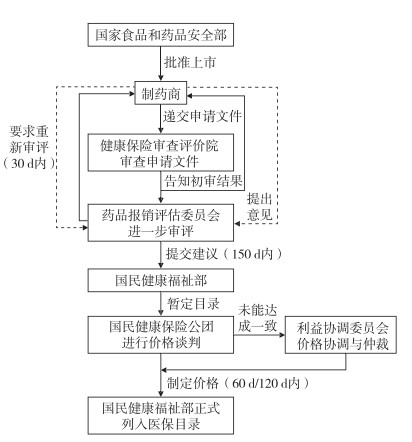
|
图 1 韩国新药定价及支付流程 |
为了控制快速增长的卫生支出, 韩国政府于1997年2月在54家医疗机构中进行5种疾病的按DRG预付制试点; 1998年试点扩大到132家医疗机构; 1999年2月-2000年l月试点进一步扩大到798家医疗机构, 按DRG支付包含了除膳食、核磁共振、超声检查、专家诊疗的额外收费以及享受私人病房的附加费用外的所有医疗费用。根据疾病严重程度和患者年龄分组, DRG针对25个编码的9类疾病, 包括眼科手术、扁桃体/腺样体切除术、阑尾切除术、剖宫产、阴道顺产、肛门造瘘、腹股沟/股疝治疗、子宫手术、普通肺炎/胸膜炎, 9类疾病的患者数约占住院患者人数的25%。试点病种的选择原则包括:医疗费用差异低于平均差异, 医生对治疗方案少有争议, 治疗结果的不确定性低, 利用率高, 所含非保险服务少以及病种模糊性升级的可能性低[8]。
韩国政府在2013年对7个特定疾病组采用了强制性按DRG支付制度。原则上, 韩国DRG由23个主要诊断类别(major diagnostic categories, MDC)和一个外科分区组成, 其中1 880个被正式识别为DRG。只有7个疾病类别中的78个DRG被用于支付费用, 而剩余其他服务仍以按服务付费的方式提供[9]。韩国按DRG预付制根据住院时间把患者分为低于下限的患者、正常病例和高于上限的患者。通过基本成本补偿和预付的混合支付, 不仅激励供方降低成本和整体医疗费用, 减少住院时间, 规范医疗行为, 也降低了报销申请和处理所产生的管理成本, 还缩小了不同医院因病种难易程度不同而造成的成本差异。而且DRG打包了部分国家医保目录未覆盖的医疗服务项目, 减轻了患者自付费用负担[4]。
3 韩国创新医疗技术支付存在的问题 3.1 创新药品支付存在的问题目前韩国的创新药品支付政策可能造成部分药品可及性变差和药品价格过低。尽管HIRA对新药进入报销目录的推荐率不低, 但是许多肿瘤药物因为价格昂贵造成经济学评价结果不具成本效果, 而无法被纳入医保药品报销目录。为了满足肿瘤患者对药品的需求, 韩国MOHW于2014年引入风险共担方案, 改善肿瘤药品及其他"半必需药品"的可及性。截至2015年, 共有5种药品被纳入风险共担方案, 且都是用于治疗转移性癌症的药品[10]。韩国实施PLS政策后, 许多制药商自愿降价以获得进入药品报销目录的资格, 这导致韩国74%的新药定价低于其他经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)国家, 所有上市新药的均价仅为OECD国家的40%[6]。总的来说, PLS政策有利于减少药品费用支出, 但药价过低无法体现创新药品的临床价值, 也难以弥补制药商研发新药的成本, 不利于医药行业的可持续发展[6]。
3.2 创新医疗技术支付存在的问题韩国在实施DRG过程中缺乏相应的细化措施, 医院为提高收入, 将医院内的治疗成本转移至入院前的护理及出院后的抗生素治疗中。韩国医生也强烈反对取消有偿服务体系, DRG无法进一步扩大覆盖面及强制执行。此外, 目前的韩国DRG(K-DRG)系统并没有解决新的医疗技术和配套服务的成本问题, 而美国和欧洲国家则在DRG支付系统内实施了激励制度, 以促进技术创新。韩国政府正在扩大创新医疗技术的可及性, 通过有选择的补偿制度加强对4个主要条件的覆盖, 但在采用创新医疗技术方面, K-DRG制度与有选择的补偿制度不一致。临床对必不可少的先进仪器设备(如外科手术等)具有很高的需求, 但DRG对先进仪器设备的补偿空间很小[11]。
4 韩国创新技术支付政策对我国的启示 4.1 引入卫生技术评估理念韩国针对创新医疗技术的收付费管理引入了卫生技术评估(health technology assessment, HTA)的理念和方法。韩国HIRA于2003年开始起草韩国药物经济学评价指南(Korean Pharmaco-economic Guideline, KPEG), 2006年发布并在2008年开始强制使用。KPEG要求评价角度是医保支付方或社会, 且以成本效果分析或成本效用分析作为首选分析方法。
4.2 建立卫生技术评估决策转换机制韩国创新医疗技术支付管理引入HTA理念, 并建立起相应的决策转换机制, 由多部门合作进行创新医疗技术的支付管理。MFDS负责医疗设备和药品的准入; HIRA负责审核制药商提交的经济学评价报告; PBCAC和PBEC对新药进行审查; DREC审核HIRA提交的评估结果, 对于是否将药品纳入医保目录提出建议; NHIS负责与制药商进行价格谈判并制定报销价格; NECA负责对医疗服务项目进行安全性和有效性评估; HIRA负责对医疗服务项目的经济性进行评估, 并最终由MOHW负责决策。
4.3 引入风险共担协议2014年起, 韩国针对没有成本效果或循证证据不够充分的药物(如罕见病用药和抗癌药、价格谈判没有成功的药物等), 引入了风险分摊机制。风险共担协议改善了罕见病用药、抗癌药等药物的可及性。对于罕见病、严重威胁生命的疾病(如肿瘤), 以及在没有治疗等效药物的情况下, 可以考虑引入风险共担协议, 保证患者的药品可及性, 并建立起风险共担协议实施效果的第三方评估机制。
作者声明本文无实际或潜在的利益冲突
| [1] |
孙菊. 全民覆盖视角下的韩国医疗保险制度研究[J]. 武汉大学学报(哲学社会科学版), 2013, 66(6): 83-89. |
| [2] |
景婉博. 韩国医药卫生体制改革及启示[J]. 财政科学, 2017, 20(8): 126-132. DOI:10.3969/j.issn.2096-1391.2017.08.015 |
| [3] |
KIM J W, SHIN D W, CHAE J J, et al. Impact of the new payment system on laparoscopic appendectomy in Korea[J]. J Sur Res, 2015, 199(2): 338-344. DOI:10.1016/j.jss.2015.04.070 |
| [4] |
常峰, 刘洪强, 席悦. 韩国药品正目录和价格谈判制度改革经验及其启示[J]. 价格理论与实践, 2015(5): 97-99. |
| [5] |
胡善联.哪些证据和过程适用于医保补偿[N].医药经济报, 2018-02-08(F03).
|
| [6] |
吴博生, 陈英耀, 耿劲松. 韩国卫生技术评估的发展应用以及对我国的启示[J]. 中国卫生质量管理, 2015, 22(1): 68-71. |
| [7] |
吴博生, 耿劲松, 黄媛, 等. 药物经济学评价在韩国医保报销决策中的应用[J]. 中国卫生资源, 2014, 17(4): 270-273, 290. |
| [8] |
马进, 徐刚, 曾武, 等. 韩国医疗服务支付方式改革对我国的启示[J]. 中国卫生经济, 2004, 23(4): 77-80. DOI:10.3969/j.issn.1003-0743.2004.04.035 |
| [9] |
ANNEAR P L, KWON S, LORENZONI L, et al. Pathways to DRG-based hospital payment systems in Japan, Korea, and Thailand[J]. Health Policy, 2018, 122(7): 707-713. DOI:10.1016/j.healthpol.2018.04.013 |
| [10] |
钱然, 马爱霞. 韩国药品补偿政策及药物经济学应用研究[J]. 卫生经济研究, 2017(2): 46-48. |
| [11] |
HWANG H, LEE S S, LEE S H. Securing patient access to new medical technology under the diagnosis-related group system in South Korea:a review of foreign policies and selective reimbursement coverage programs for 4 major conditions[J]. J Korean Med Assoc, 2017, 60(1): 63-71. DOI:10.5124/jkma.2017.60.1.63 |
 2020, Vol. 23
2020, Vol. 23


