我国医疗保障体系密切配合经济体制,随着市场经济逐渐成熟,医疗保险(以下简称“医保”)目录管理模式也由单一的行政准入向多元化的谈判准入逐步转变。2009年《中共中央国务院关于深化医药卫生体制改革的意见》提出要“积极探索建立医疗保险经办机构与药品供应商的谈判机制”。2012年起部分省市实行医保特殊药品谈判,2015年实行卫生计生委谈判,2017年实行国家医保谈判,2018年实行抗癌药专项谈判。可以说,我国已积累大量医保谈判经验。但我国药品谈判整体仍缺乏系统性,“一谈一策”的管理模式难以提供稳定保障。本研究以完善医保药品谈判机制为切入,结合典型国家专利药谈判政策的选择,分析不同协作模式的异同,以期对我国医保谈判制度发展有所启发。
1 我国医保药品谈判机制的继承与发展从谈判产生的民生效益及程序的完整性来看,2017年的国家谈判是对我国医保谈判经验的一次全面总结,即未来我国药品谈判机制将不仅局限于特定品种、固定区域,同时兼具医保准入资质。故以此为研究我国谈判机制的蓝本,进一步明确现阶段的机遇与挑战。
1.1 机遇政府高度重视,出台众多政策引导。我国一直将药费报销及支付机制改革作为深化医药卫生体制改革的重点任务,将建立药品谈判机制作为改革推进的重要抓手,并在一系列政策文件中要求相关部门给予落实。
患者用药需求刺激医保市场调整,未来谈判药品品种呈现多元化。创新药物和新疗法在抗击特殊疾病(如癌症)方面的重要性已获得学界广泛认同,患者对于这些产品的需求将推动医保目录调整,谈判渠道将成为垄断性药品进入医保的关键。
谈判机制从属于目录动态调整过程,医保部门行政权限范围广。因法律赋予的行政权,医保方作为行政主体,在行政权限范围内对行政相对人(药品企业)的准入请求给予认定。双方在谈判过程中“不对等”,医保方享有绝对的主动权。
医保方资源优势明显,医保基金筹资规模巨大,吸引厂商参与谈判。2017年我国基本医保已基本实现全民覆盖,医保基金筹资具备规模化效应。全国医保市场作为医药产品市场准入的战略高地,吸引着企业主动寻求合作。
1.2 挑战缺乏法律规范框架,谈判机制法制化进程刚刚起步。药品价格谈判尚在实践探索期,适用的具体法律规范仍以政策调整为主,我国价格谈判领域的法律规范框架尚在初步构建中。
药物经济学评价体系尚未建立,卫生技术评估基础薄弱,决策方对基于证据评估客观药品价值的认识与支持不足。医保方拥有大量信息资源,但缺乏进一步识别、整合信息的标准,亟待规范的方法进行指导。
谈判认定标准及价值表现形式单一。现阶段影响谈判决策的主要依据和判断标准为药品单价。而药品单价仅是影响药品总费用的一大要素,亟需多元化的措施以实现精确控费。
谈判准入事权与财权“分离”,中央与地方职能衔接重合。基本医保实行省级统筹管理,财权归统筹地。现阶段药品谈判机制要求省级严格接受产品及价格,仅能微调支付比例,实际上限制了统筹地对目录的调整职能。
谈判信息过于封闭,缺乏公众参与渠道。谈判全过程保密,除被邀参与谈判企业外,公众对于谈判基本信息无获取渠道。药品谈判基本信息的披露与评估程序的全程透明对确保谈判与评估的公平性十分关键,亦能便于公众监督社会事务管理。
综上,国家医保谈判机制是一种创新,既为高值救命药纳入医保目录提供了新机会,又为减轻患者的疾病负担提供了新思路。而机制整体构建尚在稳步推进,需要与国情相符的主体程序和科学的辅助过程以应对挑战。典型国家的谈判实践经验可为我国下一阶段的谈判准入改革提供参考。
2 典型国家专利药谈判机制实现路径 2.1 加拿大:区域联盟谈判模式加拿大卫生保健制度(Public Health System,PHS)是依据《加拿大卫生法案》形成的,并由加拿大13个省级行政区具体制定实施细则。PHS资金的2/3直接来自于省区政府税收,剩余1/3则通过联邦政府的“加拿大卫生转账计划”向各省区提供补充。药物福利计划作为PHS实施的重要载体,也由各省区负责制定和管理。在加拿大,药物从获得卫生部注册批准到最终进入各省区药物福利计划,需要经过国家及省级两层审查,对应流程见图 1。以下将从这两个层次的差异化定位,解读加拿大谈判准入模式。
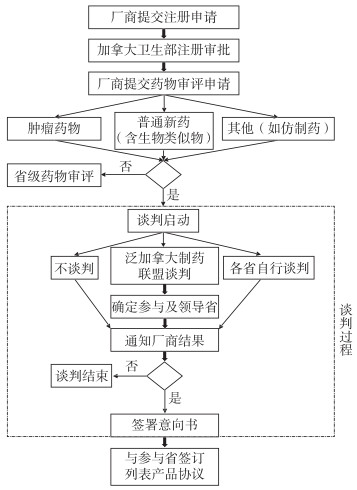
|
图 1 加拿大专利药市场-谈判准入过程 |
(1)国家药物审评。2003年9月1日起,加拿大所有准备进入省级药品福利计划的专利药必须首先通过国家药物审查程序[1]。根据专利药不同的适应证定位,药品进一步分为针对肿瘤药物的加拿大肿瘤药物共同评议组织(pan-Canadian oncology drug review,pCODR)及针对其他产品的药品统一审评(common drug review,CDR)。鉴于2种程序基本职能相似,在此仅以更具代表性的CDR作为典型进行分析。
CDR审评由加拿大卫生技术评估局(Canadian Agency for Drugs and Technologies in Health,CADTH)主导实施,CADTH本身为独立的非营利性研究机构。CADTH委任的2个专家咨询机构在整个CDR过程中发挥了关键性作用,一个为负责商议制定初步建议报告的加拿大药物专家委员会(Canadian Drug Expert Committee,CDEC),另一个为协调争议并发布建议报告的加拿大专家药物咨询委员会(Canadian Expert Drug Advisory Committee,CEDAC)[2]。
整个CDR过程为:首先,专利药厂商提交产品注册信息、临床证明研究、适应证流行病学信息、价格和流通信息、经济学研究等材料。其次,根据企业递交的材料,选择标准或模板化审评方式,由CDR团队着重开展药物临床和经济性审评。再由CDEC根据患者输入信息、厂商意见、审评等各方观点,初步形成产品建议报告。至此,如企业或省区对建议报告无异议,则形成最终报告。若存在异议,则根据不同要求,由企业重新提交材料或补充材料,由CDEC重新审评,并由CEDAC发布最终建议报告[3]。专利药最终的推荐结果分为推荐列入、推荐有条件列入、不推荐以当前提交价格列入和不推荐列入4种。该建议报告对各省区药物计划没有约束力,仅起技术建议作用。
(2)专利药最高出厂价审查。加拿大专利药物价格审查委员会(The Patented Medicine Prices Review Board,PMPRB)是根据专利法授权设立的独立机构,负责专利药的价格监管职能。PMPRB对于所有处方和非处方专利药的最高出厂价格有管辖权,但是不限制市场流通环节批发商和药师的利润空间。虽然PMPRB规定的专利药价格不考虑成本效益,但却能够帮助各省区药品福利计划在国际市场格局下选择一个合适的基准价[4]。PMPRB的监管职能可进一步细分为科学审查及价格分析。对于新专利药,PMPRB会预先进行科学审查,结合产品主要适应证、所属治疗类别和有无类似疗效对照品,将其分为突破性改善、显著改善、中等改善、轻微/无改善。其次,进行价格分析,根据不同类别选择不同价格检验方式,并制定价格上限。价格上限设置的核心思想在于,根据专利药疗效差异,选择国内类似药品参比价和12个国际市场上相同专利药经该国消费者指数换算后的中位数中的最高值进行限制。
2.1.2 省级层面:泛加拿大制药联盟专利药谈判泛加拿大制药联盟(pan-Canada Pharmaceutical Alliance,pCPA)作为加拿大卫生创新保健工作组的一部分,是一个于2010年8月由13个省区组成的联合谈判共同体。截至2018年4月,pCPA已经完成了200个专利药和60个仿制药的谈判工作[5]。
pCPA谈判流程主要可以分为4个阶段。(1)启动阶段。pCPA办公室根据CADTH发布的专利药推荐意见,主动筛选适合的谈判品种。一旦发现值得谈判的产品,便会向厂商发出确认信,告知产品已进入谈判程序[6]。(2)审议阶段。先由pCPA内部决议选出主导谈判的一个省区以及参与谈判的多个附议省区。再由pCPA办公室负责召集所有参与省区,召开对于谈判产品的集体审议会,重点讨论卫生技术评估建议、疗法空白、预算影响分析、可负担性、治疗前景、拟替代品定位、未来可选治疗方案、谈判省区需求、国际信息等内容。经过审议,pCPA办公室会向厂商发出参与信,确认谈判资格。(3)谈判阶段。一旦厂商收到参与信,便进入谈判阶段。谈判主导省区将联系厂商,要求其提交药品报价方案,与其进行一对一谈判[7]。谈判形式可以是当面讨论或者电话会议。所需谈判次数由产品特点决定,且整个谈判全程保密。(4)协议签订阶段。在谈判主导省区与厂商达成共识后,由主导省区拟定意向书(letter of intent,LOI)并发给厂商检查和执行。在签署意向书后,pCPA谈判过程即宣告结束[8]。此后,如果未参加谈判的省区希望共享谈判结果,pCPA办公室将代表该省区向厂商发通知信,与厂商修改LOI适用范围,将该省区一并纳入LOI协议中。但是LOI协议仅是各省区与厂商就产品进入药物福利计划在大框架下的初步协商,并非真正的谈判价格协议。在签订LOI协议后,厂商需要就LOI中明确的事项,与各参与省区依次协商,分别签订具有法律约束力的列表产品协议(product list agreement),至此谈判工作真正完成[9]。
综上,加拿大区域联盟谈判模式提供的启示:①谈判的开启需要以药物审评意见作为参考依据;②市场定价与医保定价互为补充,两者运行互不干预,且市场定价能为医保定价提供基础支撑;③依靠PHS的顶层设计,加拿大药品福利计划采取筹集区域管辖模式,最终形成“便宜化”的区域谈判形式;④谈判结果最终以保密协议形式予以确权,实现双方权利义务关系的对等。
2.2 澳大利亚:国家谈判模式澳大利亚形成了以医疗福利计划(Medical Benefits Scheme,MBS)及药品津贴计划(Pharmaceutical Benefits Scheme,PBS)为主导,私人保险为辅的医疗保障体系[10]。PBS依据1953年《国家卫生法案》设立,为面向全体澳大利亚公民的常规处方药保险计划。不同于MBS经费采取各洲管辖模式,PBS筹资由联邦政府全额提供并单独运行。联邦政府通过PBS补贴大部分社区和私立医院用药,以及公立医院非住院患者用药,并据此设计特定PBS目录[11]。PBS目录准入过程共需“17+18”周:以PBAC会议为分界点,前17周以药物审评为主,重点对企业所提交的材料进行疗效及经济性审核,以确定产品具有良好的性价比;后18周以价格谈判为主,重点进行基金可持续性测算,整体流程见图 2。
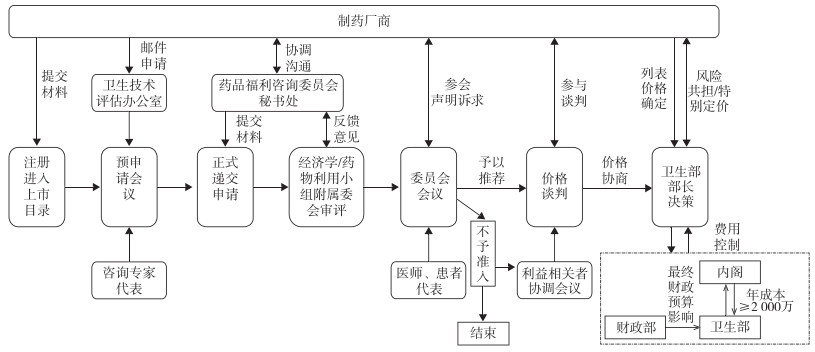
|
图 2 澳大利亚药品津贴计划的专利药准入过程 |
澳大利亚药品福利咨询委员会(Pharmaceutical Benefits Advisory Committee,PBAC)是一个由《国家卫生法案》授权设立的独立专家咨询机构。在PBS目录准入过程中,由PBAC承担药物审评、推荐以及后续价格谈判过程中的财政预算再评估工作。结合财政部确认后的成本费用,分别由卫生部、内阁行使预算金额权限内的决策权。整个程序在国家层面一次性完成。以下将从不同阶段解析澳大利亚谈判模式。
2.2.1 药品注册阶段药品需经澳大利亚国家药品管理局(Therapeutic Goods Administration,TGA)评估确认,符合安全、有效和质量可控的注册标准。药品获准在澳大利亚治疗用产品登记册(Australian Register of Therapeutic Goods,ARTG)上登记后,厂商才能向卫生部提出PBS目录准入申请。而2011年1月起专利药享有“并行程序”(parallel process)的激励政策[12]。厂商自TGA接受专利药注册申请后,即可向卫生部提出PBS准入申请。因此,注册审评与PBS审评可以并行实施,这加速了专利药的真正上市。但在并行程序下,专利药依旧要履行所有PBS准入程序,仅在PBS审评中对产品注册论证部分证明材料给予“折中协调”。除此以外,并行程序仅适用于主要申请类型,且PBS最终结论取决于注册结果。
2.2.2 申请准备阶段2016年10月,PBAC发布了《药品津贴计划目录准入程序指南》(Procedure guidance for listing medicines on the Pharmaceutical Benefits Scheme),指南对申请提交程序及材料格式给予了指导[13]。针对专利药的主要申请,厂商需要按照指南提供产品的背景材料、临床研究、经济学评价、药品使用、补充说明5个方面的证据。在正式递交申请前,厂商可以与卫生技术评估办公室(Office for Health Technology Assessment,OHTA)联系,通过邮件形式申请预申请会议。每次会议可以商议不超过2种药物,一般时间需控制在1.5 h左右。会议筹备阶段,需要由OHTA及厂商完成一份议程文件,文件中包括拟申请药物的主要概述及咨询的核心问题,如在文件中应突出申请人寻求建议的具体领域(恰当的对照品、研究的适用性、经济模型、产品使用情况、风险分担方式的选择)。OHTA会根据厂商提出的技术咨询要求,召集专家提供建议。但PBAC成员及其附属委员会并不参加本次会议,会议形成的建议对后续PBAC审评并无约束力。
2.2.3 申请审核阶段作为审核阶段的开端,厂商将主要申请涉及的材料提交至PBAC秘书处,再由秘书处分发至各附属委员会。整个评估工作主要由2个PBAC附属委员会承担,由经济学附属委员会(Economics Sub Committee,ESC)就临床疗效和成本数据进行经济性分析,由药物利用小组委员会(Drug Utilization Sub Committee,DUSC)评估厂商提交的药物使用和财务预测。在各附属委员会审评结束后,申请者会收到包含ESC及DUSC审评意见的意见书,并且可以对意见书中的审评内容作出回复。申请者共有2次进行书面回复的机会,按照时间点分别在附属委员会审评前及PBAC会议前。最终,整个PBS审核过程是以PBAC会议的形式,将前期附属委员会审核结论结合与会各利益相关主体的观点,完成对专利药的评估[14]。PBAC会议在每年的3、7、11月召开,与会人员通常包括PBAC主席或代表、企业代表、患者支持小组的提名者、临床医师、其他部门人员。
2.2.4 部门推荐阶段会议后,PBAC根据已掌握的所有信息,最终给出积极推荐、暂不推荐或拒绝推荐的结论。若药品被积极推荐,则将直接进入价格谈判环节;若药品被拒绝推荐,则不被纳入目录;若药品暂不被推荐,则需厂商说明药品数据不完整或疗效不确定等的原因,待补充材料后再次提起申请。收到“拒绝推荐”的厂商可以要求与PBAC主席会面,以了解不予推荐的原因。
收到“积极推荐”后,厂商会与卫生部定价部门就新药价格进行协商。一旦达成协商共识,申请人需向卫生部提供经签字确认的厂商预报价申请(Request for Approved Ex-Manufacturer Price,pb11a)表格,以反馈产品在PBS目录中寻求的列表价格。随后,财政部根据列表价格最终验证对财务预算的影响,并将意见反馈至卫生部。如果PBAC意见提示产品存在进一步提高性价比的可能,则由卫生部代表国家与厂商进一步谈判,形成价格协议。价格协议中真正发挥控制卫生费用支出的特殊条款分为特别定价(special pricing arrangement)及风险共担(risk sharing arrangement)[15]2种。价格协议的签署工作必须在产品拟定上市的6周前完成,整个谈判过程基于最终的财务分析,并且特殊条款内容对外保密。
综上,澳大利亚国家谈判模式提供的启示:①依靠PBS顶层设计,PBS目录准入采取国家直接管理模式;②谈判方式作为对普通准入的补充形式,减少财政对于高值药品的总费用支出;③卫生技术评估审评结果是双方得以有效协商的前提与基础;④谈判结果以保密协议形式予以确立,核心为列表价格与医保支付数额间差值的约定。
3 结论及建议通过与典型国家的比较发现:现阶段我国谈判机制的整体程序与典型国家高度吻合,也经历了从药品审核到谈判落地的过程,但以下细节和衔接程序尚待完善。
3.1 谈判机制定位现阶段谈判机制仍以政策调整为主,缺乏更为强大的法律层面的保障。应在法规层面将谈判机制已有关键内容与政策管理相衔接,使之有法可依、授权明确。在法制化进程中,明确常规准入与谈判准入的定位,谈判机制宜作为常规准入的一种补充,采用更为灵活的设计。从调整产品数量及机制运行时间来看,谈判机制还不具备与常规准入完全对等的实践经验,需要在逐步实践中积累丰富的运作经验。此外,补充定位也表现在程序层面的衔接性,谈判机制既可保持常规准入的通畅性,又可进一步发挥其遴选功能,让符合谈判特点的产品得到有效识别。
3.2 谈判目标及形式谈判机制最终的目的在于控制医疗总费用,药品单价是实现这个目标的一种有效但非唯一手段。医保药品目录的主要功能在于维护医保基金的可持续性,即通过使用目录内高性价比产品从而有效控制医疗费用。整个谈判机制的设计也应秉持这一基本理念,从医保基金整体运行规律出发,合理规划厂商与基金管理者间的博弈关系。此外,随着我国医保市场逐渐覆盖医药终端市场,也可以通过谈判定价影响厂商在国内市场中的市场价格。但考虑到市场价格的形成规律,两者不宜混淆,可以通过列表价格与医保支付价进行区分,用保密的形式维护医保市场价格的稳定性。
3.3 谈判基准的形成过程谈判博弈的关键在于双方间形成的价值共识,这往往需要一套公认的判断标准予以实现。现有国际经验表明,卫生技术评估工具可以有效协调双方利益诉求,帮助达到共赢局面。而真正使用这套工具,还需要提前建立规范的评估程序及科学的研究体系。整个过程既要构建专业化人才团队,也需要国家层面的指南标准,是一次学科发展与国家标准修订的融合。因此,未来谈判基准的形成将逐步发展为更为精准的评估过程,可以通过标准化、科学化的卫生技术评估手段,实现利益相关主体对于价格的认同。
作者声明本文无实际或潜在的利益冲突
| [1] |
周挺, 李洪超, 马爱霞, 等. 加拿大药品统一审评制度及价格管理体系简析[J]. 中国卫生经济, 2018, 37(2): 94-96. |
| [2] |
CANADIAN AGENCY FOR DRUGS AND TECHNOLOGIES IN HEALTH. Procedure and Submission Guidelines for the CADTH Common Drug Review[EB/OL].(2018-08-09)[2019-03-19]. http://www.cadth.ca/about-cadth/what-we-do/products-services/cdr/common-drug-review-submissions/guidelines-procedures-templates.
|
| [3] |
LAUPACIS A. Economic evaluations in the Canadian common drug review[J]. Pharmacoeconomics, 2006, 24(11): 1157-1162. DOI:10.2165/00019053-200624110-00011 |
| [4] |
ZHANG R, MARTIN D, NAYLOR C D. Regulator or regulatory shield? The case for reforming Canada's Patented Medicine Prices Review Board[J]. CMAJ, 2017, 189(14): E515-E516. DOI:10.1503/cmaj.161355 |
| [5] |
CANADA'S PREMIERS. The pan-Canadian Pharmaceutical Alliance[EB/OL].[2019-03-19]. http://www.canadaspremiers.ca/pan-canadian-pharmaceutical-alliance/.
|
| [6] |
SALEK S M, HOSKYN S L, JOHNS J, et al. Pan-Canadian Pharmaceutical Alliance (pCPA):timelines analysis and policy implications[J]. Front Pharmacol, 2018, 9: 1578. |
| [7] |
MILLIKEN D, VENKATESH J, YU R, et al. Comparison of drug coverage in Canada before and after the establishment of the pan-Canadian Pharmaceutical Alliance[J]. Bmj Open, 2015, 5(9): e008100. DOI:10.1136/bmjopen-2015-008100 |
| [8] |
常峰, 夏强, 崔鹏磊, 等. 药品价量协议制度的国际经验及启示[J]. 中国新药杂志, 2016, 25(2): 134-138. |
| [9] |
BOURASSA FORCIER M, NOËL F. Product Listing Agreements (PLAs):a new tool for reaching Quebec's pharmaceutical policy objectives?[J]. Health Policy, 2013, 9(1): 65-75. |
| [10] |
BABAR Z U D. Pharmaceutical prices in the 21st century[M]. Auckland: Springer International Publishing, 2015.
|
| [11] |
赵绯丽, 吴晶, 吴久鸿. 澳大利亚药物福利计划可持续措施:基于2015年新一轮改革方案[J]. 中国医疗保险, 2016(4): 67-70. |
| [12] |
伍琳, 陈永法. 澳大利亚专利药价格谈判管理经验及其对我国的启示[J]. 价格理论与实践, 2017(3): 89-92. |
| [13] |
THE PHARMACEUTICAL BENEFITS ADVISORY COMMITTEE. Guidelines for preparing submissions to the Pharmaceutical Benefits Advisory Committee (PBAC)[EB/OL]. (2016-09-01)[2019-03-19]. https://pbac.pbs.gov.au/.
|
| [14] |
周挺, 李洪超, 张籍元, 等. 药物经济学证据在澳大利亚药品福利计划准入中的应用及启示[J]. 中国卫生经济, 2018, 37(5): 54-56. |
| [15] |
AUSTRALIAN GOVERNMENT DEPARTMENT OF HEALTH. 8.4 negotiation and agreement[EB/OL].[2019-03-23]. http://www.pbs.gov.au/info/industry/listing/procedure-guidance/8-procedures-positive-recommendation-list/8-4-negotiation-and-agreement.
|
 2019, Vol. 22
2019, Vol. 22


