医疗器械不良事件是指发生在已上市的医疗器械的正常使用情况下,导致或者可能导致人体伤害的各种有害事件[1]。2018年5月,国家药品监督管理局发布了2017年医疗器械不良事件监测年度报告,是2013年以来发布的第6份报告。报告数量及质量是不良事件监测工作开展的前提和关键,高质量报告是器械不良事件分析评价的基础和核心[2]。本研究全面梳理了报告中数据,对近年来我国的医疗器械不良事件的报告数量及质量等进行分析,以期为医疗器械不良事件的监测与防范提供参考。
1 资料与方法 1.1 资料来源医疗器械不良事件数据来源于2013—2018年国家药品监督管理局官网上发布的共计6份《医疗器械不良事件监测年度报告》。包括全国医疗器械不良事件报告数的总体变化趋势,不同报告来源、事件伤害程度、医疗器械管理类别、涉及实际使用场所和涉及使用人员等。
1.2 分析方法使用Excel 2016对报告中数据进行描述性分析。运用复合年均增长率(compound annual growth rate,CAGR)和增幅对变化趋势进行描述,计算公式如下:

|
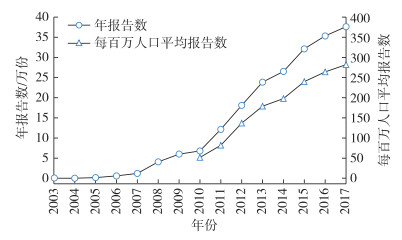
2003—2017年全国医疗器械不良事件报告数持续增长,由2003年的366例增至2017年的376 157例,复合年均增长率达64.11%,见图 1。2003年至2010年间由于报告数量基数小,年增幅波动较为明显,7年间的复合年均增长率达111.02%。相较而言,2010—2017年间增长较为平稳,复合年均增长率为27.63%。其中2010—2011年间的增幅最大,为78.32%,随后增幅呈下降趋势。
|
图 1 全国医疗器械不良事件报告数和每百万人口平均报告数 |
2010年至2017年全国每百万人口平均报告数与同年段的医疗器械不良事件报告数变化趋势类似,从2010年的每百万人口52例增至2017年的282例,7年间的复合年均增长率为27.32%,见图 1。
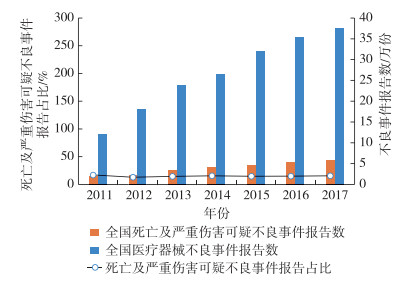
2.2 全国医疗器械死亡及严重伤害不良事件报告数医疗器械死亡及严重伤害不良事件包括死亡可疑不良事件报告和严重伤害可疑不良事件报告。其中严重伤害可疑不良事件指发生危及生命的情况,或导致机体功能的永久性伤害或者机体结构的永久性损伤;又或必须采取医疗措施才能避免上述永久性伤害或者损伤。2011—2017年死亡及严重伤害可疑不良事件总量呈上升趋势,从2011年的20 610例增至2017年的57 965例,复合年均增长率为18.81%,见图 2。但是死亡及严重伤害可疑不良事件报告占同年报告总数的比例基本维持在15%~16%左右,近年来有小幅波动。
|
[注]死亡及严重伤害可疑不良事件报告占比=全国死亡及严重伤害可疑不良事件报告数/同年全国医疗器械不良事件报告数量 图 2 2011—2017年全国医疗器械不良事件报告情况 |
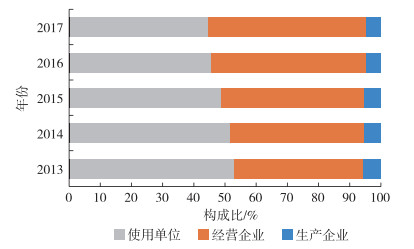
医疗器械不良事件相关信息主要通过“全国医疗器械不良事件监测系统”上报。系统注册基层用户量从2013年的148 585家增至2017年的253 250家,5年间的复合年均增长率为14.26%,见表 1。从2017年注册的基层用户构成来看,经营企业占50.79%,使用单位次之(44.51%),生产企业占比最低(4.70%),见图 3。就2013年至2017年的构成变化来看,生产企业占比较稳定,而经营企业和使用单位的占比变化明显,前者从41.40%升至50.79%,后者从52.90%降至44.51%。
| 表 1 2012—2017年全国医疗器械不良事件上报来源及构成 |
|
|
|
图 3 2013—2017年“全国医疗器械不良事件监测系统”注册基层用户情况 |
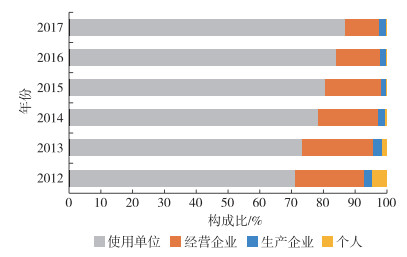
从2017年医疗器械不良事件报告来源构成来看,使用单位占比最高(86.83%),经营企业次之(10.83%),生产企业和个人占比较低(分别为2.30%和0.03%),见图 4。2012年至2017年报告来源构成未发生明显改变,使用单位占比保持主导地位,经营企业、生产企业和个人的构成比则不断压缩。从近五年的数量变化来看,使用单位上报数量近6年来持续增长;复合年均增长率为20.39%,生产企业、经营企业也有小幅的增长,复合年均增长率分别为13.91%和7.90%;个人上报不良事件的数量则在不断下降,复合年均下降率为54.35%。见表 1。
|
图 4 2012—2017年全国医疗器械不良事件报告来源 |
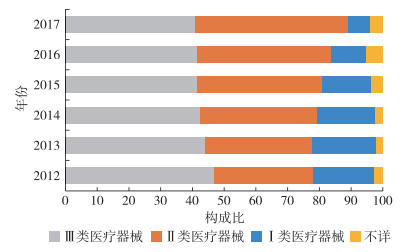
从2017年引发不良事件的医疗器械管理类别来看,Ⅱ类医疗器械和Ⅲ类医疗器械占比均较高,分别为48.16%和40.99%,Ⅰ类医疗器械和不详类别仅占6.79%和4.05%,见图 5。从2012—2017年的构成变化来看,4种类别占比均有明显变化,即2012年和2017年引发不良事件的医疗器械管理类别存在较大差异。其中,由Ⅱ类医疗器械引发的不良事件数量上升幅度最明显,复合年均增长率为26.06%,见表 1。不详类别也呈增长趋势,占比逐渐增高。Ⅲ类医疗器械在数量上有明显增长,复合年均增长率为12.73%,但在构成比上则略有下降。Ⅰ类医疗器械则在数量和构成比上均呈下降趋势。
|
图 5 2012—2017年全国引发不良事件的医疗器械管理类别 |
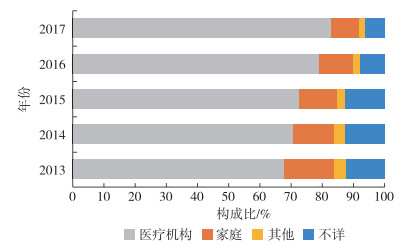
从2017年医疗器械不良事件涉及的实际使用场所来看,医疗机构占比高达82.91%,家庭、地点不详和其他地点的构成比均较低(分别为8.90%、6.38%和1.82%),见图 6。从不良事件涉及的实际使用场所的数量变化来看,2013—2017年医疗机构数量逐年递增,复合年均增长率为17.81%,见表 1。家庭、其他地点和地点不详的数量均逐年下降,复合年均下降率分别为3.04%、8.14%和4.88%。且三者总构成比不断压缩,由2013年的30.74%降至2017年的17.09%。
|
图 6 2013—2017年全国医疗器械不良事件涉及实际使用场所 |
研究结果显示,近年来全国医疗器械不良事件的年报告数和每百万人口平均报告数稳定增长。2010年,随着网络监测系统的启动,不良事件报告数呈现增长小高峰,是不良事件报告规范化、便捷化效果的良好体现[3]。2011年后,随着《食品药品监管总局关于进一步加强医疗器械不良事件监测体系建设的指导意见》[4]《医疗器械使用质量监督管理办法》[5]等政策的出台完善、监管逐渐加强、报告愈发严格的情况下,医疗器械不良事件年增幅呈波动性下降趋势,上报情况已逐步稳定。2016年2月正式实施的《医疗器械使用质量监督管理办法》填补了使用环节的质量监管空白,我国基于产品全生命周期的医疗器械管理体系初步成型[6]。死亡及严重伤害可疑不良事件的增长较为平缓,且严重事件占同年报告总数的比例无明显波动,提示总体上来看,死亡及严重伤害可疑不良事件已得到一定控制。
3.2 不同类型机构在不良事件上报中积极性各不相同研究结果显示,不同类型的医疗器械相关机构在不良事件系统注册和主动上报中表现各不相同。医疗器械不良事件报告来源中,使用单位构成比较高。使用单位作为医疗器械的直接使用主体,是医疗器械不良事件的第一发现方。使用单位报告数量的持续增长反映出使用单位对不良事件上报具有较好的主观能动性。而“全国医疗器械不良事件监测系统”注册基层用户情况的内部构成中,则是经营企业占比最高。经营企业较好的系统注册状况反映出各经营企业已经初步形成不良事件的上报意识,但不良事件上报来源中经营企业所占的比例则呈萎缩趋势。这种“矛盾”的现状可能是经营企业监管情况好转所致,也可能是存在漏报情况,仍需进一步鼓励其如实上报不良事件。而生产企业则是现行不良事件监测中“缺失”的一环,全国数据中无论是系统注册数量还是主动上报数量的构成比都是机构类型中最低的,部分省份甚至出现过生产企业零报告情况[7]。究其原因,可能是因为企业对上报不良事件的认识仍较片面,仅考虑对企业声誉可能产生的影响,而未考虑公众用械安全和行业整体的良性发展。然而依据《食品药品监管统计年报》统计结果,生产企业的生产许可总量总体持续增长[8],生产企业数量增多但总体上报数量占上报总数的比例反而下降,更反映出生产企业作为器械质量安全的第一责任人,履行职责的自觉性有待进一步提高。
3.3 Ⅱ类医疗器械引发不良事件数量多、增长快2016年1月1日起施行《医疗器械分类规则》中规定,医疗器械按照风险程度由低到高,管理类别依次分为第Ⅰ类、第Ⅱ类和第Ⅲ类[9]。研究结果显示,在引发不良事件的医疗器械管理类别中,Ⅱ类医疗器械和Ⅲ类医疗器械始终占主导地位。Ⅲ类器械风险程度最高,包括一次性输液器、一次性注射器、静脉留置针等使用频率高的医疗器械。近年来Ⅲ类器械引发不良事件数量的增幅逐渐变缓,构成比也略有下降。Ⅱ类医疗器械包含心电图机、电子血压计、玻璃体温计等中度风险的医疗器械,近年来引发不良事件数超过Ⅲ类器械,成为引发不良事件最多的医疗器械管理类别。与此同时,可生产Ⅱ类器械的企业数量在医疗器械市场上也占主导地位[8],反映出Ⅱ类器械较高的需求量和市场占有率。由于Ⅱ类器械风险程度相对较低,医务人员和患者在使用过程中就容易放低警惕,可能更容易发生不良事件。且Ⅱ类器械中电子血压计、玻璃体温计等现已成为家中常备的医疗器械,患者及家属在缺乏医务人员指导的情况下自行使用,增加了使用风险。
3.4 医疗机构为不良事件主要涉及的实际使用场所医疗机构正是医疗器械的主要使用单位,近5年来数量上翻倍增长,构成比也一直占主导地位。医疗机构上报数量的快速增长得益于医疗机构对不良事件上报的重视。医院医疗器械不良事件上报机制主要是在诊疗活动中发现不良事件的医务人员主动上报,由医疗设备科等职能科室进行收集和处理[10]。2016年2月1日开始实行的《医疗器械使用质量监督管理办法》中明确规定,医疗器械使用单位应每年对医疗器械质量管理工作进行全面自查,并按规定上报和处理不良事件[5]。但国家“十二五”规划期间,医疗器械重点监测工作也发现,部分医疗机构存在医疗器械不良事件专职人员配备缺乏的问题[11]。家庭和其他医疗器械使用单位并不是医疗器械的使用主体,医疗器械不良事件上报数量仅占上报总量的两成左右。由于医疗器械不良事件监测相比药品不良反应监测起步较晚,当前对于公众的宣传仍不足,家庭或个人对于医疗器械不良事件发现、上报的意识都不够充分。与此同时,非医疗机构的单位或个人客观存在对于不良事件的识别和判断的专业知识相对匮乏的状况。
4 政策建议 4.1 提升监测能力,加强公众宣传随着经济社会的发展、人口的增长以及统计数据的不断完善,国家药品不良反应监测中心收到《医疗器械不良事件报告表》数量逐年增长。报告数据量的上升并不代表器械风险管理的失败,而应看作是医疗器械风险管理需要加强的信号。而且不良事件上报的最终目的也并不是追责,而是从制度层面去弥补系统缺陷。报告数量良性增长的同时,不良事件的监测能力和报告质量更值得关注。就现有整体监测情况来看,家庭和个人已经越来越多地主动和被动参与到医疗器械使用、监测和上报过程中。故需要从多环节入手,着重培养医务人员、患者等医疗器械直接使用者的监测能力。尤其要着重公众宣传,不断提升公众安全使用医疗器械和主动上报不良事件的意识和能力。引发不良事件的医疗器械管理类别中,不详类别的上报数量增长正是报告质量不佳的表现。故需要追究导致类别不详的原因,是分类标准的问题导致有医疗器械无法归类,还是数据收集时类别的缺失,并提出针对性的解决措施。明确引发不良事件的医疗器械管理类别,有助于规范管理,预防不良事件的发生。优质的不良事件报告有助于改进系统流程,建立预警系统,积极推动医疗器械上市后风险的发现和控制,更好地保障公众用械安全。
4.2 基于全生命周期管理,鼓励生产、经营企业如实上报我国对医疗器械的长期管理实践中,一直处于一种“重”上市前管理、“轻”上市后管理的虎头蛇尾的管理模式[6],生产企业和经营企业未严格贯彻执行医疗器械不良事件监测、上报等法律职责。欧美国家有明确规定一切由医疗器械造成的事故由生产企业承担主体责任,而我国医疗器械责任主体尚不明确[12]。原国家食品药品监督管理总局在2017年公开的《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策(征求意见稿)》也明确提出要建立上市许可持有人为主体的不良事件报告制度,并要求从严惩处隐瞒不报或逾期报告的,医疗机构报告、患者举报而上市许可持有人未报告等行为[13]。因此,更需要鼓励生产企业和经营企业如实上报,避免隐瞒和漏报情况的发生。随着医疗器械行业发展,基于产品全生命周期管理的需要,对医疗器械的管理重心也应从上市前审批转移到上市后监测[14]。生产企业和经营企业更应该全程贯彻主体责任。医疗器械是以中小企业居多的行业[15],企业严加自律、严格上报,也能推动行业的健康发展,形成良性循环。并可以通过政企资源共享的形式鼓励企业参与到不良事件监测中,实现政府与企业的共赢。
·作者声明本文无实际或潜在的利益冲突
| [1] |
国家市场监督管理总局, 国家卫生健康委员会.医疗器械不良事件监测和再评价管理办法: 国家市场监督管理总局令第1号[EB/OL]. (2018-08-13)[2018-09-18]. http://www.nmpa.gov.cn/WS04/CL2077/330071.html.
|
| [2] |
杨飞, 钟蕾, 刘东红. 医疗器械不良事件报表质量评估抽样方案研究与探讨[J]. 中国医疗设备, 2018, 33(5): 165-169. DOI:10.3969/j.issn.1674-1633.2018.05.045 |
| [3] |
贾秀才, 汤少梁. 江西省9810例医疗器械不良事件数据统计分析[J]. 中国医疗设备, 2016, 31(5): 146-148. DOI:10.3969/j.issn.1674-1633.2016.05.044 |
| [4] |
食品药品监管总局.食品药品监管总局关于进一步加强医疗器械不良事件监测体系建设的指导意见[EB/OL]. (2013-10-08)[2018-09-22]. http://www.gov.cn/gongbao/content/2014/content_2580992.htm.
|
| [5] |
国家食品药品监督管理总局.医疗器械使用质量监督管理办法: 国家食品药品监督管理总局令第18号[EB/OL]. (2015-10-21)[2018-10-12]. http://samr.cfda.gov.cn/WS01/CL0053/132880.html.
|
| [6] |
蒋海洪, 杨悦. 我国医疗器械管理制度发展评析与展望[J]. 沈阳药科大学学报, 2018, 35(5): 419-423. |
| [7] |
戚俊. 云南省2016年度医疗器械不良事件监测信息档案收集情况及思考[J]. 云南科技管理, 2017, 30(3): 79-80. DOI:10.3969/j.issn.1004-1168.2017.03.025 |
| [8] |
国家食品药品监督管理总局. 2017年度食品药品监管统计年报[EB/OL]. (2018-04-02)[2018-10-13]. http://samr.cfda.gov.cn/WS01/CL0108/227377.html.
|
| [9] |
国家食品药品监督管理总局.医疗器械分类规则: 国家食品药品监督管理总局令第15号[EB/OL]. (2015-07-14)[2018-09-23]. http://www.nmpa.gov.cn/WS04/CL2186/300672.html.
|
| [10] |
高婧颖, 陆银春, 卫蕾. 医疗器械不良事件案例分析与管理改进探讨[J]. 医疗卫生装备, 2017, 38(1): 140-141. |
| [11] |
郑立佳, 赵燕, 董放. 中日医疗器械上市后监管研究[J]. 中国药物警戒, 2016, 13(9): 537-539. |
| [12] |
张敬. 医疗器械产业技术创新及行业政策研究[J]. 企业技术开发, 2018, 37(4): 47-49. |
| [13] |
食品药品监管总局.总局关于征求《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(征求意见稿)意见的公告(2017年第54号)[EB/OL]. (2017-05-11)[2018-09-23]. http://samr.cfda.gov.cn/WS01/CL0087/172569.html.
|
| [14] |
蒋海洪, 徐键. 政策法规变动对医疗器械产业的影响研究[J]. 医疗卫生装备, 2018, 39(1): 77-81. |
| [15] |
张骥, 史占中. 医疗器械行业的政策有效性探究:基于上市公司投资收益率的实证研究[J]. 中国科技论坛, 2014(6): 51-55. DOI:10.3969/j.issn.1002-6711.2014.06.009 |
 2019, Vol. 22
2019, Vol. 22


