2. 上海市闵行区妇幼保健院, 上海 201102
2. Shanghai Minhang District Maternal and Child Health Hospital, Shanghai 201102, China
宫颈癌是最常见的女性生殖恶性肿瘤,约有85%的新发和死亡病例均发生在卫生资源缺乏的发展中国家[1]。2014年全国肿瘤登记数据显示,宫颈癌的发病率和死亡率为15.30/10万和4.57/10万,分别位居我国女性恶性肿瘤发病率和死亡率的第6位和第8位[2]。最新流行病学研究发现,我国城市女性(25~54岁)1987— 2015年宫颈癌死亡率呈显著上升趋势,同期农村妇女则呈下降趋势[3]。2010年以来,城市年轻女性的宫颈癌死亡率、人乳头瘤病毒(human papillomavirus,HPV)感染率较年长者均有明显增长[4]。城市女性,尤其是年轻城市女性成为宫颈癌新的易感人群,应引起关注。宫颈癌不仅威胁到女性生命,还给家庭与社会造成巨大的疾病负担[5]。由于病因明确,病程较长,宫颈癌预防成为有效降低其发病与死亡风险的重要手段[6]。而评价各类预防策略的成本效果亦成为策略筛选与优先排序的重要决策支撑。而在构建宫颈癌预防策略的经济学评价模型之前,建立符合目标人群的宫颈癌自然转归模型是基石。因此,本文通过构建我国城市妇女宫颈癌自然转归Markov模型,并对其进行模型拟合优度验证,为进一步构建我国城市妇女宫颈癌筛查策略的经济学评价模型提供基础支撑。
1 对象与方法 1.1 Markov模型构建在疾病研究方面,Markov模型的原理是将某疾病按照其自然发生发展的过程,划分为几个不同的健康状态,并且确定一定时间内各状态之间的转归概率,结合各个状态的成本消耗和健康结果,通过多次循环运算,估计出该疾病发生发展的费用消耗和健康结局[7]。本研究的宫颈癌自然进程模型是在无任何组织性预防干预措施的情况下,由目标人群宫颈癌各健康状态的自然转归概率所决定的。
本研究通过构建Markov队列模型,模拟10万名初始年龄为15岁的健康女性50年内的宫颈癌不同健康状态的自然转归进程,估计在无组织性预防干预策略的情况下,队列人群的宫颈癌发病情况。
1.2 Markov模型状态的设定基于相关研究[8-10],宫颈癌的疾病进程依次经历HPV感染、低度鳞状上皮内病变、高度鳞状上皮内病变、浸润性癌症等健康状态。因此,本研究Markov模型设置了6个状态:健康、HPV感染、低度鳞状上皮内病变、高度鳞状上皮内病变、浸润性癌症、死亡(死于其他疾病),并将浸润性癌症与死亡均设定为模型的终止状态,即一旦为浸润性癌症状态就退出队列,故不存在死于宫颈癌的情况。模型运行以1年为1个周期,共运行50年。各状态归转情况见图 1。
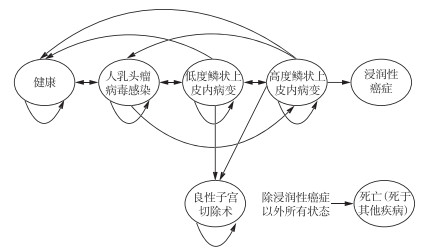
|
图 1 宫颈癌各健康状态自然转归情况 |
本研究的转归概率是指在1年之内宫颈癌的各健康状态之间相互转化的概率。由于目前尚无我国城市妇女宫颈癌前瞻性队列研究的相关数据支撑,且国内外有关宫颈癌模型研究的自然转归参数也是基于多人群、多渠道来源的[11],故本研究基于国内外宫颈癌的相关研究[8-16],拟定了Markov宫颈癌自然进程模型各健康状态间的转归概率参数(表 1)。
| 表 1 Markov宫颈癌自然进程模型各健康状态转归概率参数 |
|
|
本研究的目标人群为我国城市妇女,且模型模拟的是无任何组织性预防措施干预的情况下,宫颈癌各健康状态的转化进程情况。故本文利用我国癌症中心所报告的2009年城市妇女各年龄别宫颈癌发病率[17](实际组)与本模型预测的同年龄段发病率(预测组)作比较分析,以此来检验模型的拟合优度。之所以选择2009年,是由于2009年以后不同地区城市开始进行宫颈癌组织性筛查[18]。
本研究依据相关文献[19],采用两独立样本发病率的Log-rank检验进行模型拟合优度检验。零假设H0:两组年龄别发病率曲线没有差别;备择假设H1:两组年龄别发病率曲线有差别。
| $ \begin{align} & LR={{\left( \sum{d_{j}^{\text{A}}}-\sum{e_{j}^{\text{A}}} \right)}^{2}}/\sum{e_{j}^{\text{A}}}+{{\left( \sum{d_{j}^{\text{B}}}-\sum{e_{j}^{\text{B}}} \right)}^{2}}/\sum{e_{j}^{\text{B}}} \\ & e_{j}^{\text{A}}={{d}_{j}}\times n_{j}^{\text{A}}/{{n}_{j}},e_{j}^{\text{B}}={{d}_{j}}\times n_{j}^{\text{B}}/{{n}_{j}},{{d}_{j}}=d_{j}^{\text{A}}+d_{j}^{\text{B}},{{n}_{j}}=n_{j}^{\text{A}}+n_{j}^{\text{B}} \\ \end{align} $ |
其中,ejA、ejB分别是实际组和预测组在年龄为j时的宫颈癌发病率期望值,djA、djB分别是年龄为j时实际组和预测组的宫颈癌发病率,njA、njB分别表示年龄为j时实际组和预测组的存活人数。
1.5 统计学分析通过Treeage pro 2018建立Markov队列模型,运用Excel 2013进行数据录入和整理。检验水准α=0.05。
2 结果 2.1 模型队列的预测分析Markov队列模型模拟出10万名初始年龄为15岁的健康女性50年内的宫颈癌疾病发生发展及分布情况(表 2),并基于此计算出模型预测的各年龄段人群宫颈癌发病率。
| 表 2 10万名初始年龄为15岁的健康女性50年内的宫颈癌自然进程及分布情况 |
|
|
根据模型预测的年龄别发病率与我国癌症中心所报告的2009年城市妇女宫颈癌年龄别发病率,绘制曲线图(图 2)。实际组与预测组的宫颈癌年龄别发病率变化趋势大致相同。对两组年龄别发病率曲线进行拟合优度检验,LR=3.678,P=0.055,差异无统计学意义。可认为本模型的拟合优度适宜,即模型中所采用的各健康状态转归概率能较好地拟合目标人群的情况。
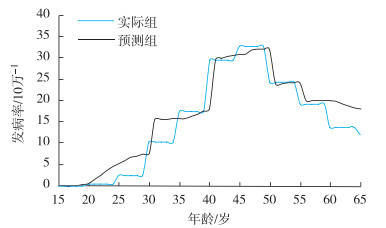
|
图 2 Markov模型预测的年龄别发病率与2009年我国城市妇女宫颈癌年龄别发病率曲线比较 |
本研究假设女性在15岁及之前不会发生性行为,即不会患有宫颈疾病,15岁之后才开始出现宫颈疾病的发生发展。模型中选取的人群初始年龄为15岁,一方面与国外近年来宫颈癌模型研究选取的初始年龄一致[20],另一方面也与我国女性对性生活(首次性生活年龄与性伴侣数量等)的态度变化[21]有关。此外,相较于20岁,人群初始年龄选为15岁可以进一步预测女性在15~20岁间宫颈癌及其癌前病变的发生发展情况,因此本研究认为将初始年龄确定为15岁较为适宜。
3.2 模型拟合的对照人群2009年我国开始实施农村妇女宫颈癌筛查项目,计划在3年内对1 000万农村妇女开展宫颈癌筛查,以降低农村地区宫颈癌的发病率[22]。而城市妇女的宫颈癌筛查未被纳入该项目范畴,例如,作为全国首批宫颈癌防治城市示范基地的深圳市在2009年才开始将宫颈癌防治纳入政府妇幼安康工程项目[23]。可见,2009年我国城市地区宫颈癌防治工程在全国范围内仍处于初始阶段。同时,本模型是在无任何组织性干预的情况下,模拟队列人群各健康状态的相互转归。因此,选取我国2009年城市妇女作为拟合的对照人群具有较好的参考价值。
3.3 模型的拟合优度检验本研究采用Log-rank检验进行模型的拟合优度检验。结果显示,模型预测组与实际组的年龄别发病率差异无统计学意义,可认为模型拟合情况较好。Log-rank检验常用于比较两组生存概率曲线的整体分布情况,其显著优势为不需要了解生存曲线的形状或生存时间的分布,适用范围较广[24]。Zhou等[19]在2013年采用Log-rank检验比较分析了Markov模型预测的胃癌发病率和死亡率与实际人口数据的一致性。因此,本研究借鉴其思路,运用Log-rank检验来比较分析模型预测组与实际组年龄别发病率曲线分布的一致性。
3.4 局限性由于缺乏我国城市妇女宫颈癌疾病自然史的实证队列研究数据,故本研究中不同年龄别城市妇女宫颈癌自然转归参数大多来源于国内外相关文献。虽然模型预测组与实际组年龄别发病率的差异无统计学意义,但仍可能与真实情况中的数据有偏差。建议在有条件的情况下,以目标人群的自然转归参数进行研究。
·作者声明本文无实际或潜在的利益冲突
| [1] |
IARC IAfRoC (2014) GLOBOCAN. Estimated incidence, mortality and prevalence worldwide in 2012(population fact sheet in more developed countries)[EB/OL]. (2014-01-19)[2019-03-19]. http://globocan.iarc.fr/Pages/fact_sheets_population.aspx
|
| [2] |
陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14. |
| [3] |
WEI M, ZHOU W, BI Y, et al. Rising mortality rate of cervical cancer in younger women in urban China[J]. J Gen Intern Med, 2018. |
| [4] |
丁贤彬, 吕晓燕, 毛德强, 等. 2010-2015年重庆市肿瘤登记地区宫颈癌发病与死亡趋势分析[J]. 中国肿瘤, 2018, 27(11): 824-829. DOI:10.11735/j.issn.1004-0242.2018.11.A002 |
| [5] |
SCHUTZBANK T E, JARVIS C, KAHMANN N, et al. Detection of high-risk papillomavirus DNA with commercial invader-technology-based analyte-specific reagents following automated extraction of DNA from cervical brushings in ThinPrep media[J]. J Clin Microbiol, 2007, 45(12): 4067-4069. DOI:10.1128/JCM.01833-07 |
| [6] |
SCHLECHT N F. Human papillomavirus infection and time to progression and regression of cervical intraepithelial neoplasia[J]. J Natl Cancer Inst, 2003, 95(17): 1336-1343. DOI:10.1093/jnci/djg037 |
| [7] |
陈蕊.利用Markov模型对宫颈癌筛查方案的卫生经济学评价研究与应用[D].广州: 华南理工大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10561-1015986832.htm
|
| [8] |
ANDRESGAMBOA O, CHICAIZA L, GARCIAMOLINA M, et al. Cost-effectiveness of conventional cytology and HPV DNA testing for cervical cancer screening in Colombia[J]. Salud Pública De Mexico, 2008, 50(4): 276-285. DOI:10.1590/S0036-36342008000400005 |
| [9] |
SANDERS G D, TAIRA A V. Cost-effectiveness of a potential vaccine for human papillomavirus[J]. Emerg Infect Dis, 2003, 9(1): 37-48. DOI:10.3201/eid0901.020168 |
| [10] |
MYERS E R, MCCRORY D C, NANDA K, et al. Mathematical model for the natural history of human papillomavirus infection and cervical carcinogenesis[J]. Am J Epidemiol, 151(12): 1158-1171. DOI:10.1093/oxfordjournals.aje.a010166 |
| [11] |
石菊芳.我国农村地区子宫颈癌筛查方案的卫生经济学评价研究[D].北京: 中国协和医科大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10023-2010041189.htm
|
| [12] |
莫秀婷.我国宫颈癌预防策略的经济学评价[D].济南: 山东大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10422-1015368524.htm
|
| [13] |
MUÑOZ N, MÉNDEZ F, POSSO H, et al. Incidence, duration, and determinants of cervical human papillomavirus infection in a cohort of Colombian women with normal cytological results[J]. J Infect Dis, 2004, 190(12): 2077-2087. DOI:10.1086/425907 |
| [14] |
MOLANO M, ADRIAAN V D B, PLUMMER M, et al. Determinants of clearance of human papillomavirus infections in Colombian women with normal cytology:a population-based, 5-year followup study[J]. Am J Epidemiol, 2003, 158(5): 486. DOI:10.1093/aje/kwg171 |
| [15] |
MOSCICKI A B, SCHIFFMAN M, BURCHELL A, et al. Updating the natural history of human papillomavirus and anogenital cancers[J]. Vaccine, 2012, 30(161). |
| [16] |
MUÑOZ N, BOSCH F X, DE SANJOSÉ S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer[J]. N Engl J Med, 2003, 348(6): 518-527. DOI:10.1056/NEJMoa021641 |
| [17] |
应倩, 夏庆民, 郑荣寿, 等. 中国2009年宫颈癌发病与死亡分析[J]. 中国肿瘤, 2013, 22(8): 612-616. |
| [18] |
薛晓玲, 党蓉芳, 张飞鸣. 巴氏细胞学在宫颈机会性筛查与组织性筛查中的应用对比[J]. 中国医药指南, 2014, 12(27): 118-119. |
| [19] |
ZHOU H J, DAN Y Y, NAIDOO N, et al. A Cost-effectiveness analysis evaluating endoscopic surveillance for gastric cancer for populations with low to intermediate risk[J]. PLoS ONE, 2013, 8(12): e83959. DOI:10.1371/journal.pone.0083959 |
| [20] |
AZIN N, RAJABALI D, MAMAK T, et al. Cost-effectiveness of different cervical screening strategies in Islamic Republic of Iran:a middle-income country with a low incidence rate of cervical cancer[J]. PLoS ONE, 2016, 11(6): e0156705. DOI:10.1371/journal.pone.0156705 |
| [21] |
袁帅, 杨银梅, 谭畅, 等. 武汉市在校大学生性开放程度及相关因素[J]. 中国艾滋病性病, 2017, 23(11): 1016-1018. |
| [22] |
THE LANCET. Women's health in rural China[J]. Lancet, 2009, 374(9687): 358-358. |
| [23] |
李纪宾, 乔友林. 城市宫颈癌防治经验探索:深圳宫颈癌防治10年[J]. 中国肿瘤, 2015, 24(12): 971-972. DOI:10.11735/j.issn.1004-0242.2015.12.A001 |
| [24] |
BLAND J M, ALTMAN D G. The logrank test[J]. BMJ (online), 2004, 328(7447): 1073. |
 2019, Vol. 22
2019, Vol. 22


