文章信息
- 张旭辉, 张红楠, 李勇, 汪文强.
- ZHANG Xu-hui, ZHANG Hong-nan, LI Yong, WANG Wen-qiang.
- 抑制西瓜蔓枯病菌的生防真菌筛选、鉴定及发酵条件优化
- Screening and Identification of Biocontrol Fungi against Didymella bryoniae and Optimization of Fermentation Conditions
- 中国生物工程杂志, 2017, 37(5): 76-86
- China Biotechnology, 2017, 37(5): 76-86
- http://dx.doi.org/DOI:10.13523/j.cb.20170510
-
文章历史
- 收稿日期: 2016-11-24
- 修回日期: 2017-02-18
2. 西南大学园艺园林学院 重庆 400715
2. College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China
由蔓枯病菌(Didymella bryoniae)引起的西瓜蔓枯病是一种最重要的世界性真菌病害之一,可对至少12属23种的瓜类植物造成严重危害[1-3]。据统计,西瓜蔓枯病发病株率一般为15%~25%,严重时高达60%~80%,病害流行时可使瓜田出现大量死藤,减产30%以上,严重影响作物的产量和品质[4]。近来日光温室和塑料大棚等保护设施的应用,为病原菌传播和繁殖提供了良好的环境,致使各种植区西瓜蔓枯病菌反复侵染,造成持续危害[5-6],严重制约了农业经济的进一步发展。
目前并无理想的商品化抗病品种[7],因此主要的防治方法为化学防治。但是长期大量使用杀菌剂,很容易产生抗药性,同时引起的药物残留和环境污染等问题已经不符合农业健康可持续发展的要求[8]。轮作和土壤消毒等农艺措施虽有一定防治效果,但其生产成本和劳动力要求较大,难以适应中国集约化农业种植模式的要求[9]。生物防治因低成本、环境友好和无药物残留等特点已成为当前国内外防治植物土传病害的研究热点[10-12],将逐步取代传统的化学防治手段。目前对蔓枯病菌的生防研究不断深入,Sudisha等[13]发现生防细菌P.fluorescens能明显降低蔓枯病发生率。Kaewkham等[14]通过枯草芽孢杆菌处理黄瓜种子后减少了黄瓜蔓枯病菌的发病率,叶面喷施也能明显降低病害程度。也有发现链霉菌发酵液能够明显抑制Didymella bryoniae[15-16]。Martínez等[17]研究表明,哈茨木霉和棘孢木霉也能够显著抑制蔓枯病菌,具有田间应用价值。然而,对西瓜蔓枯病菌研究和应用较多的生防真菌主要是木霉菌,但是温度、pH、金属离子和抑制性细菌等环境因子会严重影响其防治效果[18-19],因此,挖掘具有高效和稳定抑菌效果的生防真菌将成为西瓜蔓枯病生物防治的一个方向。
烟管菌(Bjerkandera adusta)为木腐真菌,多生于伐桩、枯木、倒木上及枯枝落叶区域,分布地区非常广泛[20]。很多大型真菌的子实体从来不被昆虫所侵袭[21],而且受伤后的子实体能产生大量具有杀虫、抗细菌和抗真菌等活性的次生代谢产物[22],因此可作为生物防治病害的重要资源。Domański[23]在美国红栎和夏栎树皮上分离到抑制密粘褶菌的烟管菌菌株,有效地防治褐腐病在栎树上发生。国内关于烟管菌的研究主要集中在其漆酶和纤维素酶的代谢方面,而以生防菌防治植物病害的研究鲜有报道,仅有汪华等[24]公开了烟管菌对根腐病菌、黄萎病菌、青枯病菌等具有很好的防治效果。目前利用该菌防治西瓜蔓枯病菌的研究尚未报道,并且该菌的寄生机制、营养需求,以及产抑菌活性物质的代谢条件也未有研究。本实验室首次筛选到一株对西瓜蔓枯病菌具有拮抗作用的生防真菌,经鉴定为烟管菌,通过扫描电镜观察其对西瓜蔓枯病菌的寄生作用,优化其发酵条件,并通过温室盆栽实验检测防病效果,以期为利用烟管菌防治西瓜蔓枯病提供理论依据。
1 材料与方法 1.1 菌株生防真菌:筛选自重庆北碚“国家紫色土肥力与肥料效益监测基地”果园、菜地、稻田土壤(E106°24′33″;N29°48′36″);靶标菌:西瓜蔓枯病菌(Didymella bryoniae),由西南大学植物生态病理研究所惠赠。
1.2 培养基PDA培养基(去皮马铃薯200g,葡萄糖20g,琼脂15~20g,蒸馏水1 000ml,pH自然);PD培养液(去皮马铃薯200g,葡萄糖20g,蒸馏水1 000ml,pH自然);真菌分离培养基(葡萄糖2%,琼脂1.5%~2%,KH2PO4 0.1%,MgSO4·7H2O 0.1%,链霉素30μg/ml,金霉素2μg/ml,pH自然);基础发酵培养基(葡萄糖2%,NH4Cl 1%,MgSO4·7H2O 0.1%,CaCl2 0.1%,KH2PO4 0.2%,pH自然);基础培养基(葡萄糖2%,NH4Cl 1%,MgSO4·7H2O 0.1%,CaCl2 0.1%,KH2PO4 0.2%,琼脂1.5%~2%,pH自然)。
1.3 其他材料黄瓜种子品种为春夏秋王,购于山东省宁阳县阳光种子有限公司,50%多菌灵可湿粉剂和70%甲基托布津可湿粉剂购于重庆市北碚区农贸市场,栽培土壤为西南大学二号试验田紫色土,过筛后高压蒸汽灭菌2h。盆栽实验在西南大学1号温室进行。温度在28~40℃,相对湿度在45%~70%。
1.4 生防真菌分离、筛选与鉴定 1.4.1 样品采集及及生防真菌分离在重庆市北碚区“国家紫色土肥力与肥料效益监测基地”果园、菜地、稻田土壤,五点取样法[25]采集5~10cm处土样,混匀后置于自封袋中并于4℃保存。采用系列稀释划线法在真菌分离培养基上分离纯化生防菌株,获得备选菌株后于-80℃保存备用。
1.4.2 生防真菌筛选采用平板对峙培养法[26]初筛,28℃培养48h,测量培养中病原真菌菌落相对方向菌落的半径,以只接种病原真菌的平板为对照,每组3个重复。再采用摇瓶培养抑菌试验[27]复筛,取生防真菌菌饼5块接种在装有100ml无菌基础发酵培养基的三角瓶中,28℃、150r/min摇床震荡培养培养5d,吸取代谢液并用0.22μm无菌滤器过滤至无菌离心管中,移取3ml此无菌滤液与15ml熔化并冷却至60℃左右的基础培养基混匀,制成混合培养基,冷却彻底后再将植物病原菌依次接种至此培养基上,以基础发酵培养基的无菌滤液为对照组,每个组合3次重复。28℃培养48h,测量病原菌菌落半径和各自对照平板上菌落的半径,计算生防真菌抑菌率[28]。
菌落生长抑制率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100
1.4.3 生防真菌鉴定形态学鉴定:观察菌株培养特征、菌落形态,扫描电子显微镜观察菌丝及孢子形态特征。参照《真菌鉴定手册》[29]进行形态学鉴定。
分子生物学鉴定:提取目的菌株基因组DNA,以通用引物进行PCR扩增。引物序列为ITS1:TCCGTAGGTGAACCTGCGC;ITS4:TCCTCCGCTTATTGATATGC;PCR反应条件为:95℃ 5min;95℃ 30s,55℃ 30s,72℃ 40s,35个循环;72℃ 10min。扩增产物进行1.0%琼脂糖凝胶电泳分离、检测,切胶纯化后送至美吉生物医药科技有限公司测序,所得18S rDNA基因序列在GenBank里进行序列比对,下载GenBank中同源性较高序列,并利用MEGA5.0软件的Neighbor-Joining法构建系统发育树。
1.5 生防真菌寄生作用在基础培养基的两端分别接种活化的M1菌株和西瓜蔓枯病菌,构成两点对峙,在菌株之间平铺一小块无菌锡箔纸,28℃暗培养直到两者菌丝在锡箔纸上接触后使用HITACHIS-3000N扫描电子显微镜观察菌丝作用效果。
1.6 发酵条件选择采用单因素试验依次对菌株M1发酵液抑菌条件进行选择。以葡萄糖、乳糖、蔗糖、麦芽糖和可溶性淀粉为其发酵提供碳源;在其他培养条件一致的情况下,以NH4Cl、KNO3、NH4NO3、蛋白胨、牛肉膏、酵母膏和尿素为其发酵提供氮源,以无氮源的基础发酵培养基为对照;在其他培养条件一致的情况下,调节基础发酵培养基C/N为1.2:1、3.6:1、4.8:1、6:1、7.2:1、8.4:1、12:1、18:1,确定最适C/N;在其它培养条件一致的情况下,以5g/L、10g/L、15g/L、20g/L、25g/L的用量添加碳源,确定最适碳源用量;在其他培养条件一致的情况下,调节基础发酵培养基初始pH为3.0、5.0、7.0、9.0确定菌株发酵最适pH;在其他培养条件一致的情况下,设置发酵温度为20℃、25℃、30℃、35℃和40℃,150r/min摇床培养5d;在其他培养条件一致的情况下,在250ml三角瓶中按照15%、30%、45%、50%、60%和75%装瓶量配制培养基,接种后于最适温度下150r/min振荡培养5d;在其他培养条件一致的条件下,将培养基在100r/min、140r/min、180r/min和220r/min条件下振荡培养5d;在其他培养条件一致的条件下,摇床培养5d、10d、15d、20d、25d、30d后检测抑菌效果,其他操作按1.4.2中摇瓶培养抑菌试验的方法进行。在固定前一个因素最佳水平的条件下进行下一个因素的试验,每组处理均设3次重复,计算抑菌率,确定最佳发酵碳源、氮源、C/N、碳源用量、pH、温度、装瓶量、转速和发酵时间。
1.7 发酵条件优化在单因素试验的基础上,根据响应曲面设计原理及方法[30]进行6因素3水平的响应面分析试验,每个因素取高、中、低3个水平,分别记做+1、0和-1,对某个因素高低水平的差值不能过大,以防掩盖其他因素的重要性,本试验中设定高水平为低水平的1.4~1.8倍。以试验因子为自变量,发酵液对病原真菌抑菌率为响应值,研究各因素对抑菌率的影响,确定发酵条件最佳组合。
1.8 温室盆栽实验将长至两片子叶的黄瓜幼苗移栽至装有2kg无菌土的花盆(19cm×13cm)中,缓苗20d。以牙签接菌法[31]在黄瓜植株第3、4片老叶及距根20cm处的茎部分别进行处理,以40ml无菌水为CK水,以20ml无菌水+20ml病原菌菌液为CK病,以20ml病原菌菌液+20ml M1菌株发酵液液、20ml病原菌菌液+20ml多菌灵(喷施)为处理组,每组15株,3次重复。2周后根据Smith等[32]的分级标准及计算方法统计病情指数及防病效果。收获植株后测定每株叶片数、株高、根长、茎围、湿重和干重。
0级:植株健康,茎叶处无病斑,或发病叶小于1%;1级:茎叶有小块病斑,发病叶为1%~25%;2级:茎叶有大块病斑,发病叶为26%-50%;3级:茎叶有大量病斑,枯萎卷曲,发病叶为51%~75%;4级:植株有大量病斑,发病叶片为76%~90%;5级:发病叶片占到90%以上或全株病死。
病情指数=∑(各级病株数×相应级数)/(调查植株总数×最高级数)×100
防病效果(%)=(CK病病情指数-处理组病情指数)/CK病病情指数×100
1.9 数据处理与分析采用IBM SPSS Statistics 21.0统计软件进行数据统计分析,采用Design Expert 8.0.6进行响应曲面优化和分析。
2 结果与分析 2.1 生防真菌分离、筛选与鉴定 2.1.1 样品采集及生防真菌分离采用平板划线法,从所采土样中共分离获得34株真菌菌株,分别编号并于-80℃保存。
2.1.2 生防真菌筛选初筛和复筛结果显示(表 1),有9株菌对西瓜蔓枯病菌具有拮抗作用,而其中编号M1的菌株效果最佳,抑菌率分别为59.56%和49.56%。平板对峙试验中生防真菌通过与西瓜蔓枯病菌竞争营养物质实现抑制作用;而摇瓶培养抑菌试验中是通过产生代谢活性产物抑制或杀死病原菌,不论是菌体还是其去除菌体的发酵液,对西瓜蔓枯病菌均有明显抑制效果。
| Treatment | The dual culture assay | The shaking flask culture experiment |
| M1 | 59.56±0.54e | 49.56±1.19f |
| M3 | 12.20±2.66a | 23.57±6.43bc |
| M6 | 32.30±3.22bc | 19.13±4.63b |
| MW | 58.20±0.73e | 32.94±1.96cd |
| MK | 48.00±6.75de | 19.13±4.63b |
| 2A2 | 49.03±1.98e | 41.75±3.29f |
| 3A2 | 51.38±0.69e | 21.51±2.65bc |
| 4B2 | 35.77±6.11cd | 46.97±5.16ef |
| 5B2 | 53.24±2.62e | 43.09±2.13de |
| Carbendazim | 22.09±9.42ab | 11.27±6.13ab |
| Thiophanatemethyl | 28.29±0.80bc | -0.16±3.98a |
| Note: Mean ±standard error (n=3). Different lowercase letters in table 1 represent of different strains in the same experiment was significantly different (P﹤0.05), 0.4mg/ml carbendazim and thiophanatemethyl were as control group, the same below | ||
2.1.3 生防真菌鉴定
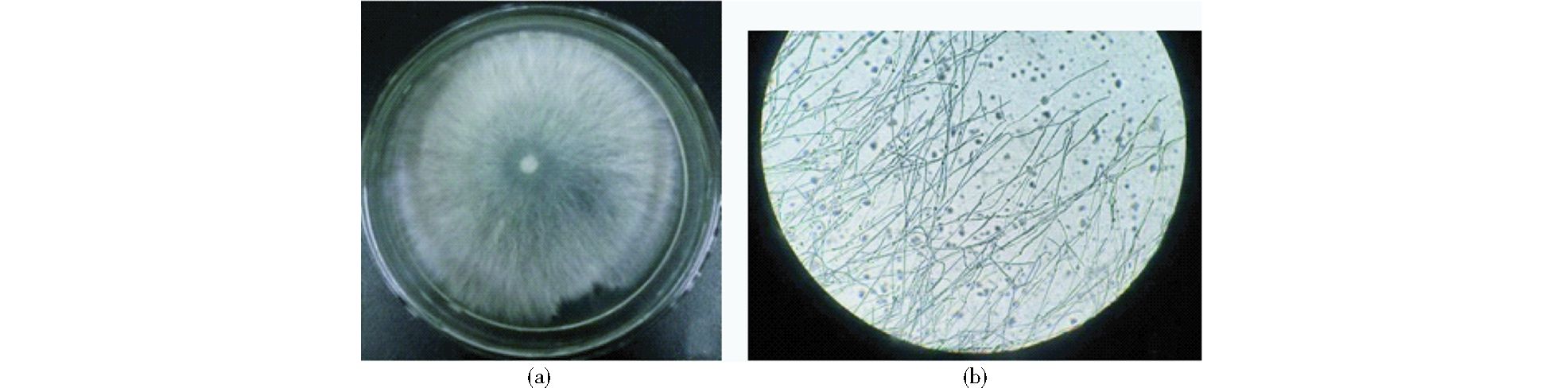
形态学鉴定:在PDA培养基上28℃暗培养,5d后菌落长满整个平板,菌株M1的生长速率为0.85mm/h;菌落边缘整齐圆滑,质地疏松,干燥平整;菌丝发达,均匀辐射生长,平铺在培养基表面,呈白色绒毛状(图 1),菌丝系统一体型,显微镜下呈树枝状;菌丝薄壁,具横隔和锁状联合,具担孢子,无色,孢子圆形、短圆柱形或椭圆形,部分孢子基部稍有尖突(图 2)。
|
| 图 1 M1菌株形态特征 Figure 1 Strain M1 morphological characteristics (a) The colony characteristics on PDA for 5 days (b) Characteristics of hyphae and spores of M1 10×10 |

|
| 图 2 扫描电子显微镜下菌株M1菌丝及孢子形态 Figure 2 The mycelium and spores of M1 strain under the scanning electron microscope (a) ×350 (b) ×600 (c) ×2 500 (d) ×3 000 |
分子生物学鉴定:以M1菌株的基因组DNA为模板,用通用引物ITS1/ITS4进行18S rDNA序列扩增,得到长度606bp的片段,将其序列相关信息提交到GenBank,获得登录号KX377676。将M1菌株18S rDNA扩增序列在NCBI数据库进行BLAST比对,并利用MEGA5.0软件的Neighbor-Joining法构建系统发育树。结果显示:菌株M1与烟管菌18S rDNA序列完全一致,与烟管菌聚到一支(图 3)。因此将M1菌株鉴定为担子菌纲(Basidiomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceae)黑管菌属(Bjerkandera)烟管菌(Bjerkandera adusta)。

|
| 图 3 基于18S rDNA序列构建M1菌株的系统发育树 Figure 3 Phylogenetic tree of strains M1 and other related strains downloaded from GenBank |
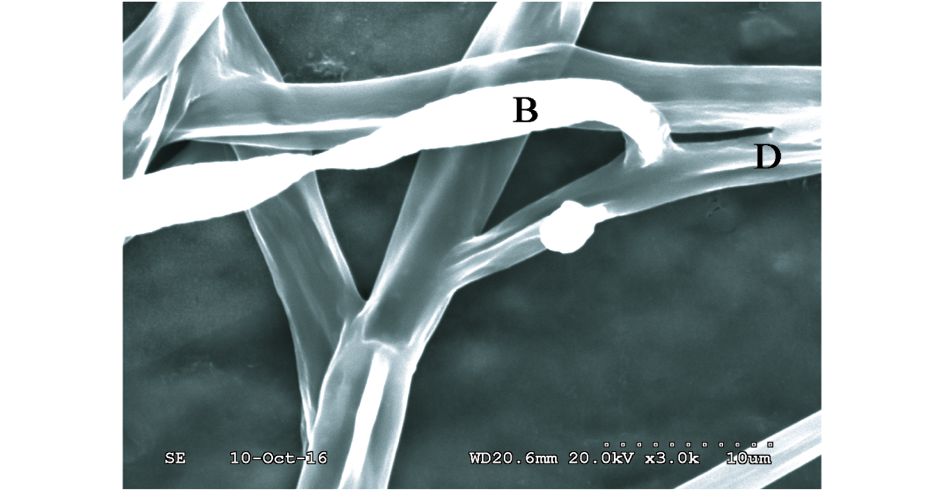
由图 4可以清晰地看到烟管菌菌丝顶端膨大部位有类似锁状联合的结构穿入西瓜蔓枯病菌菌丝,使其变形并裂解,从而抑制并杀死病原真菌,实现对西瓜蔓枯病菌的寄生作用。
|
| 图 4 扫描电子显微镜下烟管菌对西瓜蔓枯病菌的寄生作用 Figure 4 The parasitic effect of Bjerkandera adusta against Didymella bryoniae by scanning electron microscope B:Bjerkandera adusta; D:Didymella bryoniae |
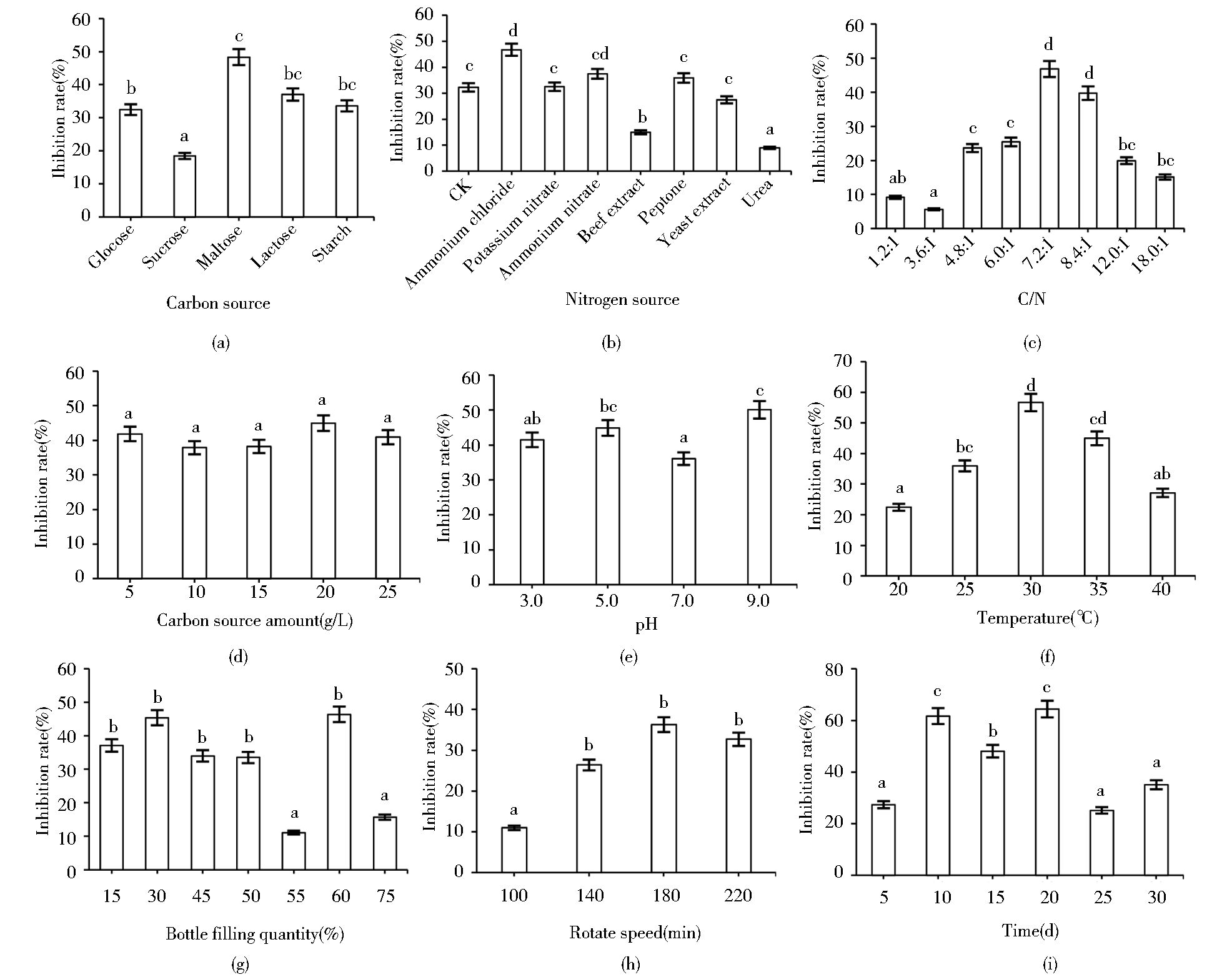
通过单因素试验选择最适发酵条件,如图 5所示,不同条件对发酵液抑菌率具有不同的影响。烟管菌最适发酵碳源为麦芽糖[图 5(a)],最适氮源为氯化铵[图 5(b)],对西瓜蔓枯病菌的抑菌率在50%左右,明显高于其他处理。随着C/N升高,抑菌率先升高后降低,C/N为7.2:1时抑菌率达到最大[图 5(c)]。不同碳源用量之间均未达到显著差异(P>0.05),但在20g/L时抑菌率最高,可确定其为最佳用量[图 5(d)]。培养液酸碱性对发酵液抑菌率有较大影响,碱性环境下抑菌率要高于酸性和中性,在pH为9.0时抑菌率最高[图 4(e)]。发酵温度对抑菌率的影响与C/N中的变化规律一致,在30℃时抑菌率最高,低于或高于该温度时抑菌率均有下降[图 5(f)],由此可确定30℃为最适发酵温度。装瓶量为30%和60%的发酵液抑菌率几乎相当,均高于其他处理[图 5(g)],综合考虑,确定30%为最佳装瓶量。转速在180r/min[图 5(h)]、发酵培养20d[图 4(i)]时均达到最大抑菌率,转速太慢,溶氧量不足,而转速太快会造成菌丝断裂,影响生长和代谢;培养时间太短菌株处于生长阶段,发酵液积累较少,培养时间太长菌株生长停滞,甚至会产生不利的代谢产物。
|
| 图 5 不同发酵条件对烟管菌发酵液抑菌率的影响 Figure 5 Effect of different fermentation conditions on the inhibition rate of fermentation broth |
根据单因素水平试验,进行Box-Behnken试验设计。对西瓜蔓枯病菌抑菌率的Box-Behnken试验设计因子与响应值及回归方程的方差分析见表 2和表 3。
| Name | Factor | Unit | Code value | ||
| -1 | 0 | +1 | |||
| A | C/N | 6.0 | 7.2 | 8.4 | |
| B | pH | 5.0 | 7.0 | 9.0 | |
| C | 装瓶量 | % | 30 | 40 | 50 |
| D | 时间 | d | 15 | 20 | 25 |
| E | 转速 | r/min | 140 | 180 | 220 |
| F | 温度 | ℃ | 25 | 30 | 35 |
| Source | Sum of squares | df | Mean square | F value | P-value Prob > F | |
| Model | 6 988.54 | 27 | 258.83 | 3.76 | 0.000 6 | Significant |
| A-C/N | 0.31 | 1 | 0.31 | 4.484E-003 | 0.947 1 | |
| B-pH | 9.63 | 1 | 9.63 | 0.14 | 0.711 3 | |
| C-装瓶量 | 116.51 | 1 | 116.51 | 1.69 | 0.204 4 | |
| D-时间 | 54.06 | 1 | 54.06 | 0.79 | 0.383 3 | |
| E-转速 | 13.01 | 1 | 13.01 | 0.19 | 0.667 1 | |
| F-温度 | 152.81 | 1 | 152.81 | 2.22 | 0.148 0 | |
| AB | 21.45 | 1 | 21.45 | 0.31 | 0.581 2 | |
| AC | 37.54 | 1 | 37.54 | 0.55 | 0.466 5 | |
| AD | 210.32 | 1 | 210.32 | 3.06 | 0.092 1 | |
| AE | 3.66 | 1 | 3.66 | 0.053 | 0.819 4 | |
| AF | 13.29 | 1 | 13.29 | 0.19 | 0.663 8 | |
| BC | 321.31 | 1 | 321.31 | 4.67 | 0.040 0 | |
| BD | 167.26 | 1 | 167.26 | 2.43 | 0.130 9 | |
| BE | 69.31 | 1 | 69.31 | 1.01 | 0.324 6 | |
| BF | 40.50 | 1 | 40.50 | 0.59 | 0.449 7 | |
| CD | 260.95 | 1 | 260.95 | 3.80 | 0.062 3 | |
| CE | 10.90 | 1 | 10.90 | 0.16 | 0.693 7 | |
| CF | 105.78 | 1 | 105.78 | 1.54 | 0.225 9 | |
| DE | 2.17 | 1 | 2.17 | 0.032 | 0.860 2 | |
| DF | 166.62 | 1 | 166.62 | 2.42 | 0.131 6 | |
| EF | 213.00 | 1 | 213.00 | 3.10 | 0.090 1 | |
| A2 | 978.04 | 1 | 978.04 | 14.23 | 0.000 8 | |
| B2 | 182.09 | 1 | 182.09 | 2.65 | 0.115 7 | |
| C2 | 471.95 | 1 | 471.95 | 6.86 | 0.014 5 | |
| D2 | 732.91 | 1 | 732.91 | 10.66 | 0.003 1 | |
| E2 | 2 416.84 | 1 | 2416.84 | 35.15 | <0.000 1 | |
| F2 | 1 633.28 | 1 | 1633.28 | 23.76 | <0.000 1 | |
| Residual | 1 787.45 | 26 | 68.75 | |||
| Lack of fit | 1 787.45 | 21 | 85.12 | 1.135E+005 | <0.000 1 | Significant |
| Pure error | 3.750E-003 | 5 | 7.500E-004 | |||
| Cor total | 8 775.99 | 53 |
借助Design Expert 8.0.6软件对以上数据进行二次多元回归拟合,得到抑菌率Y对编码自变量的二次回归多项方程为:Y=+51.75+0.11*A+0.63*B+2.20*C-1.50*D+0.74*E-2.52*F+1.64*A*B-2.17*A*C+3.63*A*D+0.68*A*E+1.29*A*F+6.34*B*C+4.57*B*D+2.08*B*E+2.25*B*F-5.71*C*D+1.17*C*E-2.57*C* F-0.52*D*E+4.56*D*F+5.16*E*F-9.75*A2-4.21*B2-6.77*C2-8.44*D2-15.33*E2-12.60*F2。
以F-检验判断各项变量对响应值的显著性(表 3)可知,拟合的二阶模型的F值为3.76,概率P(Prob>F)为0.000 6,小于0.01,说明模拟达到显著水平。回归模型的失拟项显著性检验P<0.000 1,这说明模型在α=0.01的水平上拟合效果显著。方差分析发现其二次项对抑菌率的影响有显著差异,说明各试验因子对响应值的影响不是简单的线性关系。因此可以用该模型对发酵液抑菌率进行分析和预测,利用该回归方程确定最适发酵条件。
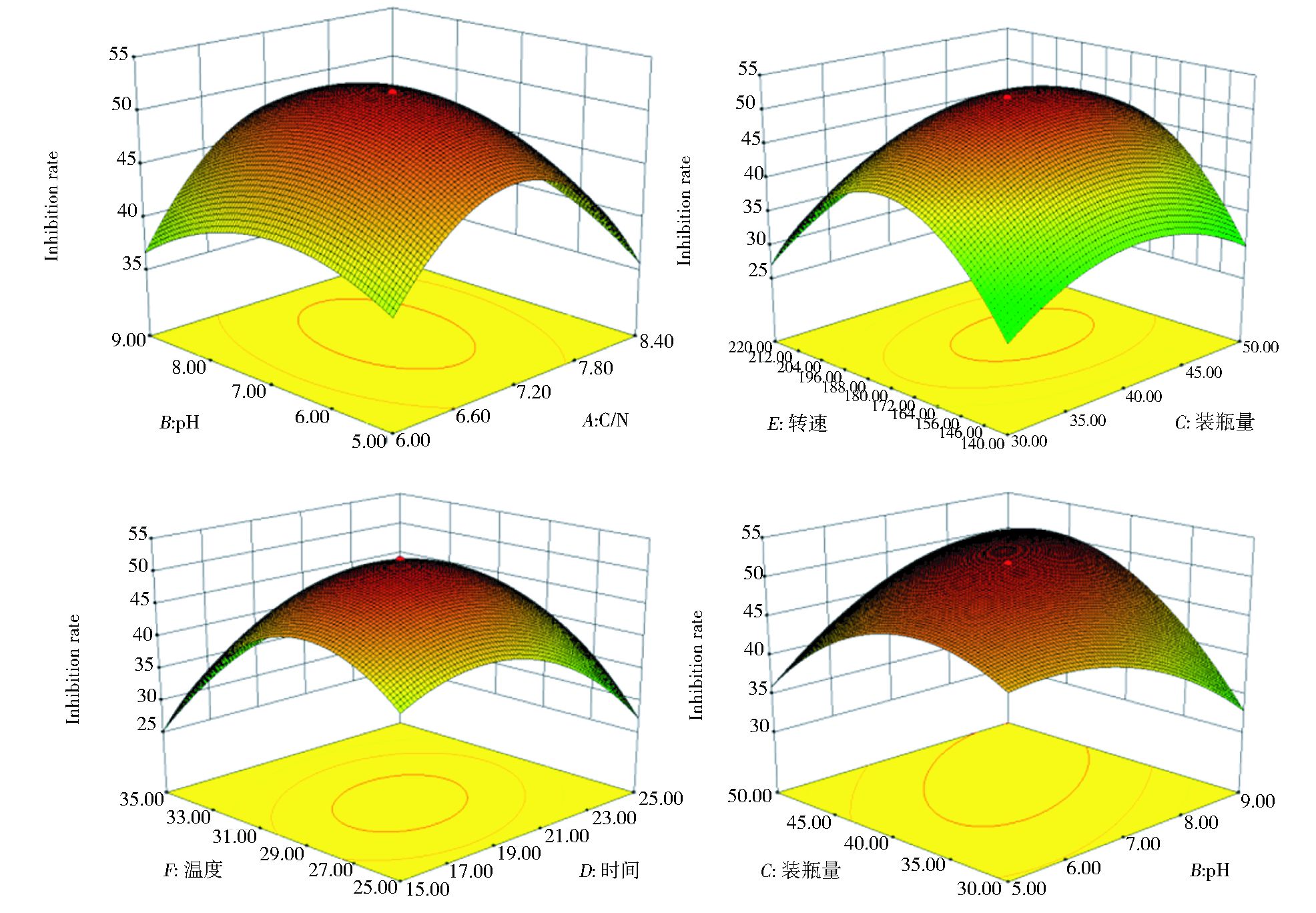
根据回归方程得出不同因子的曲面响应分析图,如图 6所示,固定其中4个因子而另2个变量因子可以三维模型展现其与响应值(抑菌率)的关系,响应面开口向下,存在最大值。由Design-Expert 8.0.6软件预测出最大值点Y=52.64%,此时对应的最佳条件为:C/N为7.11,pH为7.40,装瓶量为43.97%,时间为18.85d,转速为181.08r/min,温度为29.19℃。但考虑到实际操作,可确定烟管菌对西瓜蔓枯病菌抑制效果最好的发酵条件为:C/N为7.1,pH为7.4,装瓶量为44%,时间为19d,转速为180r/min,温度为29℃。
|
| 图 6 曲面响应中pH与C/N、转速与装瓶量、温度与时间以及装瓶量与pH对响应值的影响 Figure 6 Response surface plot of pH-C/N, rotation rate-bottle filling quantity, cultural temperature-time and bottle filling quantity-pH to response value (inhibitory rate) |
由表 4可见,各处理对黄瓜植株生长情况有不同变化,CK水除叶片数外其他指标均显著高于其他处理组,而叶片数与烟管菌M1之间无差异,与CK病和多菌灵处理均有显著差异(P<0.05)。烟管菌处理的株高、茎围与CK病和多菌灵处理均有显著差异(P<0.05),而根长、湿重、干重均无差异(P>0.05)。对西瓜蔓枯病菌的病情指数和防病效果进行调查后发现,烟管菌M1菌液病情指数显著低于CK病和多菌灵(P<0.05),而防病效果达到74.3%,明显高于多菌灵处理,对西瓜蔓枯病菌具有明显的防病效果。
| Treatment | Number of leaves | Plant height (cm) | Root length(cm) | Stem girth(mm) | Wet weight(g) | Dry weight(g) | Disease index | Biocontrol efficacy(%) |
| CK水 | 10c | 121.8d | 35.7b | 32. 7c | 103.1b | 32.1b | - | - |
| CK病 | 8a | 66.3a | 16.0a | 16. 7a | 34.3a | 6.1a | 32.7c | - |
| Bjerkandera adusta | 10c | 100.4c | 22.0a | 24.0b | 46.0a | 9.5a | 8.4a | 74.3 |
| Carbendazim | 9ab | 82.9b | 19.3a | 17.3a | 45.2a | 8.7a | 11.2b | 65.7 |
3 讨论
本研究分离到一株对西瓜蔓枯病菌具有防治效果的菌株M1,鉴定为烟管菌(Bjerkandera adusta)。在扫描电子显微镜下观察到其菌丝直接穿透西瓜蔓枯病菌菌丝,并通过单因素和曲面响应法对其发酵条件优化后确定了最佳条件组合:C/N为7.1,pH为7.4,装瓶量为44%,时间为19d,转速为180r/min,温度为29℃。温室盆栽中对西瓜蔓枯病菌的防病效果达到74.3%,高于多菌灵处理。这将为利用烟管菌防治蔓枯病的实际应用奠定基础。
生防菌寄生病原真菌的过程是通过产生吸器或者类似吸器的结构直接穿透靶标菌丝[33],或者是通过分泌溶解性及次级代谢产物来识别、接触并溶解病原真菌菌丝[34]。例如,Mala等[35]研究发现绿木霉能够识别和接触水稻纹枯病菌,并对其紧密缠绕进而裂解菌丝,抑制水稻纹枯病菌生长。Ohberg等[36]发现盾壳霉能够寄生核盘菌的菌丝和菌核,从而控制由核盘菌引起的作物菌核病。但是烟管菌作为生防菌的寄生作用研究至今未见报道。本研究发现烟管菌菌丝顶端膨大部位有类似锁状联合的结构能够直接穿透西瓜蔓枯病菌菌丝,实现抑制或杀死病原菌的寄生作用,但并未观察到菌丝缠绕等特点,具体的寄生机制仍需进一步研究。去除菌体的发酵液对西瓜蔓枯病菌具有较高的抑菌率,发酵是获得大量抑菌活性物质的基础,微生物代谢产物的类型和产量与其培养条件密切相关。响应曲面法优化可以在合理范围内减少试验次数,考察不同变量及其之间的交互作用对相应值的影响,已经广泛应用于生物工程的条件优化中。吴胜等[37]采用响应曲面法优化祼脚菇属菌株产抗菌活性物的基础液体培养条件,提升了对柑橘青绿霉菌的抑菌率。本研究采用单因素试验和曲面响应法对烟管菌菌株发酵条件进行优化,获得了最优的培养基配方和培养条件,优化后发酵液的抑菌活性有所提高,为实践生产提供了有力依据。
生防菌菌体和其胞外分泌产物均可对病原真菌起到抑制作用,因此能够很好地防治病害。Nga等[38]筛选出内生菌Pseudomonas aeruginosa能在温室和大田中有效防治蔓枯病。祝新德等[39]发现,荧光假单胞菌株M18在离体条件下能有效抑制甜瓜蔓枯病菌,在大田试验中可以达到80%的防治效果。本研究通过温室盆栽试验检测烟管菌发酵液对西瓜蔓枯病菌的防治效果达到74.3%,但是环境等外在因素可能会对病原真菌的发病情况和植株的生长状况等产生一定影响。此外,烟管菌作为生防真菌与生防细菌和生防放线菌所产生的抑菌活性物质可能有所差异,致使防病效果略有不同。总之,植株-病原真菌-生防菌构成的生物体系在病害发生与防治的复杂过程中发挥的作用机制有待进一步深入研究。
| [1] | Keinath A P. From native plants in central Europe to cultivated crops worldwide:the emergence of Didymella bryoniae as a cucurbit pathogen. Hort Science, 2011, 46(4) : 532–535. |
| [2] |
李英. 瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选. 南京: 南京农业大学, 园艺学院, 2007. Li Y. Study on Biology Characteristics of Didymella bryoniae and Screening of Resistance Germplasm of Cucumber. Nanjing:Nanjing Agricultural University, College of Horticulture, 2007. |
| [3] | Kothera R I, Keinath A P, Dean R A, et al. AFLP analysis of a worldwide collection of Didymella bryoniae. Mycological Reserch, 2003, 107(2) : 297–304. |
| [4] |
李雨, 王少秋, 谭蕊, 等.
西瓜蔓枯病有效药剂筛选及药效评价. 农药, 2016, 55(6) : 460–462.
Li Y, Wang S Q, Tan R, et al. Evaluation of fungicides for control of gummy stem blight caused by Didymella bryoniae. Agrochemicals, 2016, 55(6) : 460–462. |
| [5] | Keinath A P. Survival of Didymella bryoniae in buried watermelon vines in South Carolina. Plant Disease, 2002, 86(1) : 32–38. DOI:10.1094/PDIS.2002.86.1.32 |
| [6] | Sudisha J, Niranjana S R, Umesha S, et al. Transmission of seed-borne infection of muskmelon by Didymella bryoniae and effect of seed treatments on disease incidence and fruit yield. Biological Control, 2006, 37(2) : 196–205. DOI:10.1016/j.biocontrol.2005.11.018 |
| [7] | Lou L N, Wang H Y, Qian C T, et al. Genetic mapping of gummy stem blight (Didymella bryoniae) resistance genes in Cucumis sativus-hystrix introgression lines. Euphytica, 2013, 192(3) : 359–369. DOI:10.1007/s10681-013-0860-z |
| [8] | Heydari A, Misaghi I J. The role of rhizosphere bacteria in herbicide-mediated increase in Rhizoctonia solani-induced cotton seedling damping-off. Plant and Soil, 2003, 257(2) : 391–396. DOI:10.1023/A:1027330215553 |
| [9] | Njoroge S M, Kabir Z, Martin F N, et al. Comparison of crop rotation for Verticillium wilt management and effect on Pythium species in conventional and organic strawberry production. Plant Disease, 2009, 93(5) : 519–527. DOI:10.1094/PDIS-93-5-0519 |
| [10] | Mancini V, Romanazzi G. Seed treatments to control seedborne fungal pathogens of vegetable crops. Pest Management Science, 2014, 70(6) : 860–868. DOI:10.1002/ps.2014.70.issue-6 |
| [11] | Botelho, Gloria R, Mendon H, et al. Fluorescent Pseudomonads associated with the rhizosphere of crops-an overview. Brazilian Journal of Microbiology, 2006, 37(4) : 401–416. DOI:10.1590/S1517-83822006000400001 |
| [12] | Abo-elyousr K A, Hashem M, Ali E H. Integrated control of cotton root disease by mixing fungal biocontrol agents and resistance inducers. Crop Protection, 2009, 28(4) : 295–301. DOI:10.1016/j.cropro.2008.11.004 |
| [13] | Sudisha J, Niranjana S R, Umesha S, et al. Transmission of seed-borne infection of muskmelon by Didymella bryoniae and effect of seed treatments on disease incidence and fruit yield. Biological Control, 2006, 37(2) : 196–205. DOI:10.1016/j.biocontrol.2005.11.018 |
| [14] | Kaewkham T, Hynes R K, Siri B. The effect of accelerated seed ageing on cucumber germination following seed treatment with fungicides and microbial biocontrol agents for managing gummy stem blight by Didymella bryoniae. Biocontrol Science and Technology, 2016, 26(8) : 1048–1061. DOI:10.1080/09583157.2016.1183189 |
| [15] | Seok K K, Seu Y B. Isolation of polyene antifungal antibiotics against gummy stem light caused by Didymella bryoniae. Korean Journal of Microbiology and Biotechnology, 2004, 32(3) : 238–242. |
| [16] | Zhao J, Xue Q H, Shen G H, et al. Evaluation of Streptomyces spp. for biocontrol of gummy stem blight (Didymella bryoniae) and growth promotion of Cucumis melo L.. Biocontrol Science and Technology, 2012, 22(1) : 23–37. DOI:10.1080/09583157.2011.636481 |
| [17] | Martínez B, Pérez J, Infante D, et al. Antagonism of Trichoderma spp. isolates against Didymella bryoniae (Fuckel) Rehm. Artículo Original, 2013, 28(3) : 192–198. |
| [18] | Jackson A M, Whipps J M, Llynch J M. Nutritional studies of four fungi with disease biocontrol potential. Enzyme and Microbial Technology, 1991, 13(91) : 456–461. |
| [19] | Kredics L, Antal Z, Manczinger L, et al. Influence of environmental parameters on Trichoderma strains with biocontrol potential. Food Technology and Biotechnology, 2003, 41(7-8) : 37–42. |
| [20] |
褚衍亮, 王娜, 余晗.
一株桑枝纤维降解菌株的鉴定及纤维素降解能力测定. 蚕业科学, 2015, 41(1) : 127–133.
Chu Y L, Wang N, Yu H. Identification of a Mulberry branch fiber degrading fungal strain and determination of its cellulose degrading activity. Science of Sericulture, 2015, 41(1) : 127–133. |
| [21] | Mier N, Canete S, Klaebe A, et al. Insecticidal properties of mushroom and toadstool carpophores. Phytochemistry, 1996, 41(5) : 1293–1299. DOI:10.1016/0031-9422(95)00773-3 |
| [22] | Stadler M, Sterner O. Production of bioactive secondary metabolites in the fruit bodies of macro fungi as a response to injury. Phytochemistry, 1998, 49(4) : 1013–1019. DOI:10.1016/S0031-9422(97)00800-5 |
| [23] | Domański S. Bjerkandera adusta on young Quercus rubra and Quercus robur injured by late spring frosts in the upper Silesia industrial district of Poland. European Journal of Forest Pathology, 1982, 12(6) : 406–413. DOI:10.1111/efp.1982.12.issue-6 |
| [24] |
汪华, 喻大昭, 郭坚. 一株多孔烟管菌菌株高氏15号的鉴定及抑菌活性研究//陈万权, 病虫害绿色防控与农产品质量安全--中国植物保护学会2015年学术年会论文集, 中国植物保护学会2015年学术年会, 长春, 2015, 北京: 中国农业科学技术出版社, 2015: 590. Wang H, Yu D Z, Guo J. Identification of Bjerkandera adusta 15 Strain and Study of Antimicrobial Activity//Chen W Q, Academic Annual Conference of the China Society for the Protection of Plants in 2015, Academic Annual Conference of the China Society for the Protection of Plants, Changchun, 2015, Beijing:China Agricultural Science and Technology Press, 2015:590. |
| [25] |
方中达.
植病研究法. 第3版 北京: 中国农业出版社, 2007: 43-97.
Fang Z D. Plant Pathology Research Methods. 3rd ed Beijing: China Agriculture Press, 2007: 43-97. |
| [26] |
梁银, 张谷月, 王辰, 等.
一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究. 土壤学报, 2013, 50(4) : 810–817.
Liang Y, Zhang G Y, Wang C, et al. Identification and biocontrol effect of a strain of actinomycete antagonistic to wilt disease of cucumber. Acta Pedologica Sinica, 2013, 50(4) : 810–817. |
| [27] |
崔西苓. 耐盐碱木霉菌株的筛选鉴定、抗病促生及耐盐机理研究. 北京: 中国农业科学院, 2014. Cui X L. Screening and Identification of Saline-Alkali Tolerant Trichoderma Strains and the Study on Disease Resistance, Growth Promotion and Salt-tolerant Mechanism. Beijing:Chinese Academy of Agricultural Sciences, 2014. |
| [28] | Campanile G, Ruscellia, Luisi N. Antagonistic activity of endophytic fungi towards diplodia corticola assessed by in vitro and in planta tests. European Journal of Plant Pathology, 2007, 11(7) : 237–246. |
| [29] |
魏景超.
真菌鉴定手册. 上海: 上海科学技术出版社, 1979: 367-378.
Wei J C. Handbook of Fungal Identification. Shanghai: Shanghai Scientific and Technology Publishers, 1979: 367-378. |
| [30] | He Z, Wang J, Oh J, et al. Robust optimization for multiple responses using response surface methodology. Applied Stochastic Models in Business and Industry, 2010, 26(2) : 157–171. DOI:10.1002/asmb.v26:2 |
| [31] |
王新艳. 大丽轮枝菌致病相关突变体的筛选及致病基因VdCYP1功能初步研究. 北京: 中国农业科学院, 2015. Wang Y X. Screening of Verticillium dahliae Pathogenicity-related Mutants and Functional Analysis of the Pathogenic Gene VdCYP1. Beijing:Chinese Academy of Agricultural Sciences, 2015. |
| [32] | Smith V L, Wilcox W F, Harman G E. Potential for biological control of Phytophthora root and crown rots of apple by Trichoderma and Gliocladium spp.. Phytopathology, 1990, 80(9) : 880–885. DOI:10.1094/Phyto-80-880 |
| [33] |
陈志敏, 顾钢, 陈顺辉, 等.
木霉菌对烟草疫霉的拮抗作用. 福建农林大学学报(自然科学版), 2009, 38(3) : 234–237.
Chen Z M, Gu G, Chen S H, et al. Antagonism of Trichoderma spp. to Phytophthora parasitica var. nicotianae. Journal of Fujian Agricultural and Forestry University (Natural Science Edition), 2009, 38(3) : 234–237. |
| [34] | Eziashi E, Uma N, Adekunle A, et al. Biological control of Ceratocystis paradoxa causing black seed rot in oil palm sprouted seeds by Trichoderma species. Pakistan Journal of Biological Science, 2006, 9(10) : 1987–1990. DOI:10.3923/pjbs.2006.1987.1990 |
| [35] | Mala M P, Mukherjee B A, Horwitz C. Trichoderma-plant-pathogen interactions:advances in genetics of biological control. Indian Journal of Microbiology, 2012, 52(4) : 522–529. DOI:10.1007/s12088-012-0308-5 |
| [36] | Ohberg H, Bang U. Biological control of clover rot on red clover by Coniothrium minitans under natural and controlled climatic conditions. Biocontrol Science and Technology, 2010, 20(1) : 25–36. DOI:10.1080/09583150903337805 |
| [37] |
吴胜, 霍光华, 韩启灿, 等.
一株祼脚菇属菌株产抗菌活性物的基础液体培养碳、氮源等优化及其对柑橘青绿霉菌的作用. 中国生物工程杂志, 2016, 36(2) : 51–61.
Wu S, Huo G H, Han Q C, et al. Optimization of carbon and nitrogen source of basic liquid culture of Gymnopus sp. producing anti-fungal activity substance and its effect on green and blue mold of citrus. China Biotechnology, 2016, 36(2) : 51–61. |
| [38] | Nga N T, Giau N T, Long N T, et al. Rhizobacterially induced protection of watermelon against Didymella bryoniae. Journal of Applied Microbiology, 2010, 109(2) : 567–582. |
| [39] |
祝新德, 冯镇泰, 许煜泉, 等.
荧光假单胞菌株M18防治甜瓜蔓枯病害. 上海交通大学学报, 2001, 35(7) : 1062–1065.
Zhu X D, Feng Z T, Xu Y Q, et al. Biocontroling of Melon Gummy Stem Blight (Mycosphaeralla melonis) using Pseudomonas fluorecens M18. Journal of Shanghai Jiao Tong University, 2001, 35(7) : 1062–1065. |
 2017, Vol. 37
2017, Vol. 37




