文章信息
- 吴懿, 张丽影, 权春善, 钟美玲, 王路路, 王冠天.
- WU Yi, ZHANG Li-ying, QUAN Chun-shan, ZHONG Mei-ling, WANG Lu-lu, WANG Guan-tian.
- 解淀粉芽孢杆菌Q-426群体感应系统ComX信息素前体肽的合成研究
- Synthesis of the ComX Pheromone Precursor Peptide in Bacillus amyloliquefaciens Q-426 Quorum Sensing System
- 中国生物工程杂志, 2017, 37(5): 38-44
- China Biotechnology, 2017, 37(5): 38-44
- http://dx.doi.org/DOI:10.13523/j.cb.20170505
-
文章历史
- 收稿日期: 2016-11-11
- 修回日期: 2017-02-10
2. 大连理工大学化工与环境生命学部 大连 116024
2. School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China
解淀粉芽孢杆菌是一种与枯草芽孢杆菌亲缘性很高的细菌,在其自身生长过程中可产生包括脂肽类、肽类、聚酮类等一系列具有抗菌活性的代谢产物[1-3]。其中,脂肽类化合物Iturin家族不仅表现出强烈的抗真菌活性[4],同时也对引起常见皮肤浅部疾病的红色毛癣菌具有较强的抑制作用[5]。近年来,随着抗生素的泛滥使用,新的耐药致病菌不断出现,脂肽类抗生素因具有高效、低毒、不易产生耐药性的优异特性,在临床上表现出良好的应用前景。
研究表明,解淀粉芽孢杆菌中的ComP/ComA双组分调控系统对其脂肽类代谢产物的分泌具有重要的调节作用[6]。该系统属于典型的群体感应系统(quorum sensing system,QS)(图 1),ComX信号分子的前体Pre-ComX经ComQ蛋白作用异戊烯基化后,形成成熟的ComX分子并被分泌到细胞外;当其浓度累积到一定阈值时,即可与细胞膜上的受体组氨酸激酶蛋白ComP结合,使其发生自磷酸化;磷酸化的ComP将磷酸基团转移至转录调控因子ComA,被磷酸化的ComA与srfA操纵子的启动子结合,进一步激活该操纵子的转录[7]。ComX信息素的前体物质是整个信号通路的基础,该物质为5~15个氨基酸残基组成的多肽分子[8]。如能在微生物体外采用化学合成的方法大量得到ComX信息素的前体肽,则有望实现人工调控解淀粉芽孢杆菌脂肽类代谢产物的产量。

|
| 图 1 ComP/ComA双组分群体感应系统示意图 Figure 1 Quorum sensing pathway |
目前针对ComX信息素前体肽的研究主要集中于枯草芽孢杆菌[9-13],而针对解淀粉芽孢杆菌ComX信息素前体肽的合成条件及生物活性的研究鲜有报道。本文从Fmoc-Tyr(tBu)-2-CTC树脂出发,采用Fomc法合成ComX信息素前体五肽,并采用反向半制备色谱(RP-HPLC)和液质联用(LC-MS)仪对合成的五肽进行了分离纯化。建立了多肽固相合成中检测游离氨基的新方法,并考察了树脂的溶胀过程及反应温度等条件对树脂上肽链连接效率的影响,为今后合成多种不同长度的ComX信息素前体肽进行了实验探索。此外,对合成的ComX信息素前体五肽进行了初步的生物活性研究。
1 材料与方法 1.1 仪器和药品LIBROP电子天平AEG-220(日本),SANYO CX1.5微型离心机(日本),LABCONCO台式冷冻干燥机(美国),CS136XT多肽合成仪(美国),RX台式高速冷冻离心机(日本),制备型高效液相色谱1260(美国),LCMS-2010液质联用仪(日本),MILLIPOREB P.307超纯水装置(法国)。
茚三酮(生化试剂)购自英国OXOID;m-Cresol、EDT购自上海晶纯生化科技;TFA(分析纯)、N, N-二甲基甲酰胺(DMF,分析纯)、二氯甲烷(DCM,高纯)购自上海生工;其余各种氨基酸及保护氨基酸、HBTU、HOBT、DIEA均购自北京博迈杰生化试剂;Fmoc-Tyr(tBu)-2-Chlorotrityl Resin购自吉尔生化(上海)有限公司。
1.2 ComX前体肽的合成 1.2.1 合成方法采用标准Fmoc法,从C端向N端合成的顺序,合成(NH2-G-D-W-K-Y-COOH)。称取取代度0.802mmol/g的Fmoc-Tyr(tBu)-2-Chlorotrityl树脂0.1mmol置于反应釜中,用DCM溶液溶胀1h后,滤除DCM。再用DMF溶液溶胀1h,滤除DMF。分别添加0.2mmol的HBTU/HOBT/DIEA和待连接氨基酸,加入15ml DMF,35℃反应1h。随后分别用DMF、DCM和甲醇交替冲洗两次,以除去残留的氨基酸及反应试剂。连接结束后,用20%哌啶/DMF溶液脱除Fmoc基团,再次用NNA试剂检测,树脂呈现蓝紫色后再次用DMF、DCM和甲醇交替冲洗。重复上述操作直至肽链连接完成为止。连接好的树脂用冰乙醚冲洗,真空低温干燥。
1.2.2 游离氨基的检测采用以下两种试剂分别进行游离氨基的检测。
Kaiser试剂[14]检测游离氨基:准确称取20种氨基受保护与相应氨基游离的氨基酸各0.5mg,转移到预先做有标记的0.2ml PCR用离心管,通过离心使氨基酸沉于离心管管底。向装有氨基酸的离心管中分别加入A/B/C液(A液:5%茚三酮的乙醇溶液;B液:80%苯酚的乙醇溶液;C液:2% 0.001mol/L KCN的吡啶溶液)各20μl,漩涡振荡后离心处理。将各个离心管放入水浴锅中,100℃水浴加热5min,进行显色反应。5min后取出离心管并观察溶液颜色变化。
NNA试剂(茚三酮+正丁醇+乙酸溶液)检测游离氨基:将1.5g茚三酮溶于100ml正丁醇溶液,搅拌促溶,向溶液中加入3.0ml乙酸溶液,均匀混合后密封避光保存备用。准确称取20种氨基受保护与相应氨基游离的氨基酸各0.5mg,转移到预先做有标记的0.2ml PCR用离心管,离心处理。向各个离心管中滴加NAA溶液60μl,漩涡振荡后离心处理。将各个离心管放入水浴锅中,同样条件下水浴加热5min,进行显色反应。5min后,取出离心管并观察溶液颜色变化。
1.2.3 树脂中肽链取代度的测定准确称取35.34mg(0.1mmol)Fmoc-Leu-OH,转入25ml圆底烧瓶,向烧瓶中加入5ml新配制的25%哌啶DMF溶液,电磁搅拌反应25min。反应后的溶液进行过滤处理,残留物用DMF洗涤4次。将滤出液和每一次的洗涤液合并于50ml容量瓶中,用DMF准确定容至50ml刻度线,该溶液即为储备液,其浓度为2mmol/L[15]。
使用2倍稀释法,将储备液进行等梯度8次稀释得到不同浓度的样品溶液。分别以同等浓度的哌啶/DMF溶液作为参比,测定各个梯度样品溶液在300.5nm处的紫外吸收值。每一梯度样品溶液进行三次重复测量,取三次测量结果的均值。
称取一定量的连接实验中的没有进行脱保护的树脂,用DMF、DCM、甲醇交替冲洗两次以上后,用无水乙醚冲洗,抽真空干燥,用25%的哌啶/DMF溶液进行20~30min脱保护试验。检测其吸光值,带入到标准曲线中,最终转化成mmol/g。得到树脂上肽链的取代度。
| $ 链接效率{=}{{\mathit{D}}_{\mathit{n}}}\rm{/}{{\mathit{D}}_{\rm{1}}} $ |
Dn为第n个氨基酸连接后树脂中肽链的取代度; D1为树脂的初始取代度。
1.3 多肽链与树脂的分离取带有0.1mmol的ComX前体五肽树脂于圆底烧瓶,添加10倍体积经冷冻的(TFA-EDT-m-Cresol,95:4:1) 裂解液,反应0.5h后,逐渐升至室温,于室温下继续反应3h。经粗过滤后将母液倾入60mL无水冰乙醚中,析出白色沉淀,6 000r/min离心5min,弃去上清液,重复3次,将实验制得的粗肽用50%(乙腈/水)溶液悬浮溶解,-80℃冰箱冷冻后置于冷冻干燥机中冷冻干燥。
1.4 多肽的液相分析取1mg的ComX前体五肽粗品溶解在50%乙腈水溶液中,稀释1 000倍,过0.22μm有机膜后进行液质联用检测。通过全波长扫描确定最适波长,从B相0.1% TFA/乙腈(10%~90%)摸索最适检测梯度范围确定条件后,运用反相半制备色谱进行分离纯化,最终对纯化后的五肽进行质谱检测和高效液相检测。
1.5 ComX信息素前体五肽的生物活性模拟细菌生长环境将合成的前体五肽与解淀粉芽孢杆菌中提取的ComQ蛋白相互作用,转变成ComX信息素[16]。培养300ml Q-426解淀粉芽孢杆菌,待其生长至对数生长期中期时分装至3个锥形瓶中,分别添加200μl含有ComX前体五肽与ComQ作用的反应液记为A,不含有ComX前体五肽参加反应的反应液记为B,相同体积的溶剂记为C,37℃、180转培养72h,提取环脂肽粗品[17]。
2 结果与讨论 2.1 多肽连接反应过程中游离氨基的检测在多肽的固相合成过程中,通常采用检测反应体系中的游离氨基以判断氨基酸的连接情况。
Kaiser试剂是最为常用的一种方法,其由三种试剂组成,分别为6%的茚三酮乙醇溶液、80%的苯酚乙醇溶液以及2% 0.001mol/L KCN的吡啶溶液[14]。因该试剂中含有毒性较强的KCN和苯酚,给实验室的日常使用带来不便。因此,本实验采用NNA试剂(茚三酮+正丁醇+乙酸溶液)替代Kaiser试剂对多种保护氨基酸和未保护氨基酸进行了游离氨基的检测,以验证该试剂能否替代Kaiser试剂用于游离氨基的检测。检测结果列于表 1。
| AA | 显色结果 | |
| Kaiser试剂 | NNA试剂 | |
| Asp/Fmoc-Asp(OtBu) | 蓝紫 | 蓝紫 |
| Cys/Fmoc-Cys(Trt) | 蓝紫 | 蓝紫 |
| Gln/Fmoc-Gln(Trt) | 蓝紫 | 蓝紫 |
| Glu/Fmoc-Glu(OtBu) | 蓝紫 | 蓝紫 |
| Gly/Fmoc-Gly | 蓝紫 | 蓝紫 |
| His/Fmoc-His(Trt) | 紫红 | 蓝紫 |
| His/Fmoc-His(Trt) | 蓝紫 | 蓝紫 |
| Leu/Fmoc-Leu | 蓝紫 | 蓝紫 |
| Lys/Fmoc-Lys(Boc) | 蓝紫 | 蓝紫 |
| Met/Fmoc-Met | 蓝紫 | 蓝紫 |
| Phe/Fmoc-Phe | 蓝紫 | 蓝紫 |
| Pro/Fmoc-Pro | 橘黄 | 橘黄 |
| Ser/Fmoc-Ser(tBu) | 紫红 | 蓝紫 |
| Thr/Fmoc-Thr(tBu) | 蓝紫 | 蓝紫 |
| Trp/Fmoc-Trp(Boc) | 蓝紫 | 蓝紫 |
| Tyr/Fmoc-Tyr(tBu) | 蓝紫 | 蓝紫 |
| Val/Fmoc-Val | 蓝紫 | 蓝紫 |
将NNA试剂与Kaiser试剂的显色结果对比可见,NNA试剂除与脯氨酸反应生成黄色产物,与组氨酸和丝氨酸出现紫红色产物外,其余均同Kaiser试剂出现相同的蓝紫色产物。此外,两种试剂与保护氨基酸在供热条件下均不发生显色反应。茚三酮与α-氨基通过缩合反应形成有色物质,这种缩合反应在弱酸条件下更容易进行,且能减少其它基团对反应的干扰,生成的有色缩合物也较为稳定;但酸性不宜过强,因为在强酸性环境中,茚三酮或1, 3-茚二酮羟基的反应能力虽被增强,但氨基活性却明显降低,使缩合产物难以形成,因此在NNA试剂中选择乙酸提供酸性环境。正丁醇表现出优良的树脂溶胀性,可使树脂上的氨基暴露在外,有利于缩合反应的进行。以上实验证实,NNA试剂可替代Kaiser试剂用于多肽固相合成中游离氨基的检测反应。
2.2 合成条件的影响 2.2.1 溶胀试剂的选择在合成过程中,溶胀试剂的选择对树脂的延展性具有重要影响。固相载体只有进行充分溶胀,才更有利于反应试剂分子和可溶的构件分子进行自由运动,提高反应效率。本实验尝试了两种溶胀试剂DCM、DMF分别进行单一溶胀和交替溶胀,其结果列于表 2。
| D1(mmol/g) | 溶胀试剂 | D5(mmol/g) | 连接效率 | 误差 |
| 0.806 | DCM | 0.318 | 39.40% | ±3% |
| 0.806 | DMF | 0.23 | 28.50% | ±3% |
| 0.806 | DCM-DMF | 0.646 | 80.10% | ±3% |
从表 2中可见,使用DCM-DMF先后溶胀树脂1h后进行氨基酸连接,最终树脂的取代度和连接效率明显高于其它两组。这是因为,随着树脂上肽链的延长,氨基酸残基数目逐渐增多,树脂的极性增大。因此,其在非极性溶剂中的溶胀程度逐渐减小,而在极性溶剂中的溶胀程度逐渐增大。先选用极性小的DCM溶胀,随后选用极性大的DMF溶胀,能使树脂处于最佳的伸展状态,更有利于保护氨基酸的进攻,因此树脂上肽链的连接效率最高。
2.2.2 最适溶胀时间氨基酸的连接过程需要一定的时间,但反应时间不宜过长,否则会导致副产物增多。为此,本实验考察了不同溶胀时间对树脂上连接第二个氨基酸后的取代度D2及连接效率的影响,结果列于表 3。
| D1(mmol/g) | 时间(h) | 溶胀试剂 | D2(mmol/g) | D5(mmol/g) | 连接效率(%) | 误差(%) |
| 0.806 | 1 | DCM-DMF | 0.801 | 0.402 | 50.19 | ±3 |
| 0.806 | 2 | DCM-DMF | 0.795 | 0.623 | 78.36 | ±3 |
| 0.806 | 3 | DCM-DMF | 0.775 | 0.306 | 39.48 | ±3 |
2-CTC树脂属于交联的高分子结构,本身具有一定的延展性,只有在溶剂中充分溶胀,脱保护后游离的氨基才能充分裸露在外以利于下一个保护氨基酸的进攻;但溶胀有一定的限度,当超过某一临界值树脂会产生局部破裂,使已连接上的肽链数量下降。研究发现,随着溶胀时间的延长,Dn逐渐下降,但D5却先增大后减小,在溶胀2h时肽链的链接效率最高。这是由于溶胀程度的增大会导致树枝上已连接的氨基酸发生部分脱落,因此在连接第二个氨基酸的时候连接效率逐渐降低。但观察溶胀1h和溶胀2h的树脂颗粒发现,溶胀1h后树脂的颗粒并不均匀,树脂并未实现完全溶胀。随着肽链的延长,反应体系的空间位阻增大,只能树脂充分溶胀才能使其内部空间增大已减小空间位阻,因此树脂溶胀2h后的D5最大,链接效率最高。溶胀3h虽树脂内部空间更大,但肽链从树脂脱落的数量增多,导致D5显著下降。因此,本实验中树脂的溶胀时间确定为2h。
2.2.3 最适反应温度实验过程中发现,不同反应温度下肽链的连接效率不同。随着温度的升高,取代度明显提高,如表 4所示。温度升高,参与反应的物质活性增大,反应速率提高。在合成过程中,模拟解淀粉芽孢杆菌的培养温度将合成温度设置为35℃时,肽链的链接效率最大。反应温度不宜过高,否则会引起合成的肽类物质空间结构发生变化进而失去活性。
| D1 (mmol/g) |
溶胀试剂 | 温度(℃) | D5 (mmol/g) |
连接效率 (%) |
误差 (%) |
| 0.806 | DCM-DMF | 19 | 0.218 | 27.00 | ±3 |
| 0.806 | DCM-DMF | 25 | 0.249 | 30.80 | ±3 |
| 0.806 | DCM-DMF | 35 | 0.646 | 80.14 | ±3 |
2.3 分离条件 2.3.1 冷冻干燥对实验的影响
为防止多肽在干燥的过程中失活,制备多肽的过程中常采用冷冻干燥的方法以获得多肽固体。本实验考察了冷冻干燥过程对合成产物的影响。图 2为ComX信息素前体五肽一次冻干[图 2(a)]和两次冻干[图 2(b)]后的质谱对比图。结果发现,两次产物质谱图中的最大质荷比相差33。这可能是因为,在肽链从树脂上切割下来的过程中,需要用到乙二硫醇,切割后有部分巯基(-SH)连接到了肽链末端。二次冷冻干燥将-SH去除。因此,可选择适当延长冷冻干燥时间或进行二次冷冻干燥消除这部分的影响。
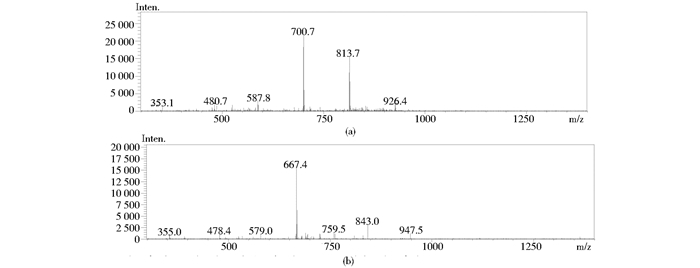
|
| 图 2 干燥结果对比图 Figure 2 Comparison of drying results (a)Primary drying results (b) Secondary drying results |
通过液质联用仪确定实验条件,流速为0.8ml/min,220nm为最适检测波长。以B相(20%~60%)梯度洗脱,柱温为35℃。为减轻出峰拖尾现象,在B相中添加0.1%TFA改变峰形。以进样量10mg/ml通过高效相液相色谱分析积分显示结果主要物质占积分总面积比58.3%,半制备型高效液相纯化后,纯度达99%。其液相结果如图 3所示。
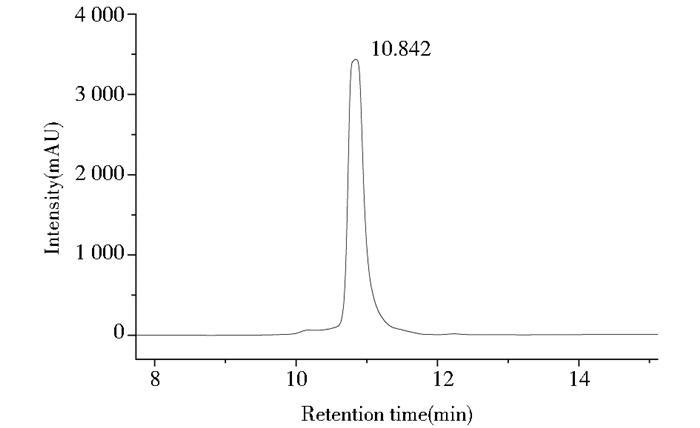
|
| 图 3 纯化后ComX信息素前体五肽高效液相色谱图 Figure 3 High performance liquid chromatogram of the purified precursor pentapeptide of ComX pheromone |
通过液质联用仪确定在10.842min前后为主要物质,其出峰时间如图 3所示,运用半制备色谱纯化分离后,进行单一质谱检测发现检测结果和理论计算结果667.7一致(图 4)。
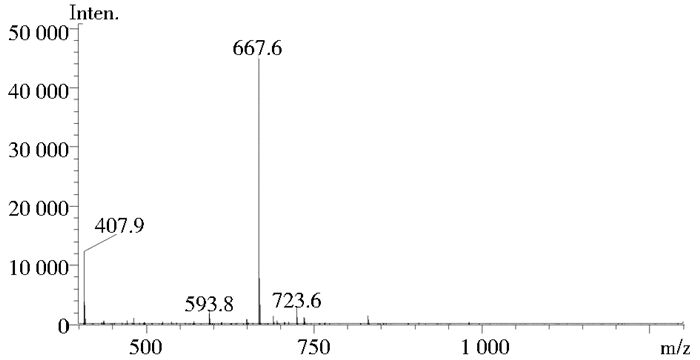
|
| 图 4 纯化后ComX信息素前体五肽质谱图 Figure 4 Mass spectrum of the purified precursor pentapeptide of ComX pheromone |
图 5为解淀粉芽孢杆菌Q-426环脂肽粗提物对金黄色葡萄球菌的抑菌活性图。A组添加了五肽与ComQ作用后的产物与Q-426共培养后提取的环脂肽粗提物;B组添加了五肽与Q-426共培养后提取的环脂肽粗提物;C组为空白对照组。从图中可见,B组和C组无明显抑菌圈,而A组出现了较为明显的抑菌圈,其直径为11.48mm。解淀粉芽孢杆菌Q-426可产生具有抑菌活性的环脂肽类代谢产物,B组和C组中因抗菌活性物质的量较少,因此没有出现明显的抑菌圈。而在A组中,五肽与ComQ作用后形成的ComX信息素分子使Q-426菌体感受到的信号增强,经一系列反应,使A组菌体产生的抗菌活性物质增多,因此出现较为明显的抑菌圈。此结果也同时证明了ComX信息素前体五肽具有生物活性。
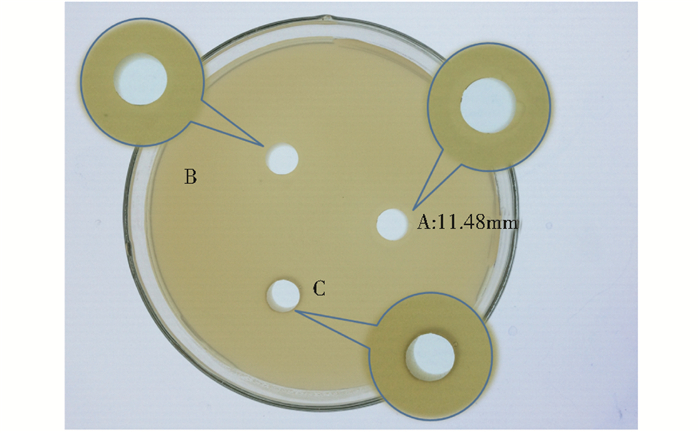
|
| 图 5 环脂肽粗提物的抑菌活性 Figure 5 Antimicrobial activity of the lipopeptide crude extract A:Pentapeptide and ComQ treated products were co cultured with Q 426 to extract the lipopeptide crude extract; B:Pentapeptide was co cultured with Q 426 to extract the lipopeptide crude extract; C:Blank control |
本实验采用固相Fmoc合成法合成了芽孢杆菌的QS系统中ComX信息素的前体五肽。在合成过程中,建立了检测多肽固相合成中游离氨基的新方法;考察了溶胀试剂、溶胀时间和反应温度等条件对树脂取代度的影响。结果表明,35℃下,使用DCM、DMF对树脂交替溶胀2h后,树脂的取代度最高。合成的ComX信息素前体五肽粗品产率为98%,纯度为58.60%;通过液质联用仪确定目标产物ComX信息素前体五肽在10.842min左右出峰,经半制备型高效液相纯化后,纯度达99%。经质谱检测产物与目标产物(NH2-G-D-W-K-Y-COOH,Mr=667.7) 分子质量一致。抑菌实验表明,ComX信息素前体五肽与ComQ蛋白作用后的产物有效促进了解淀粉芽孢杆菌Q-426环脂肽类代谢产物的表达,其作用机制还在进一步研究中。
| [1] |
陶思美, 郑维, 赵朋超, 等.
bmy基因敲除对解淀粉芽孢杆菌Q-426溶血性及抗菌活性的影响. 中国生物工程杂志, 2014, 34(3) : 56–60.
Tao S M, Zheng W, Zhao P C, et al. Effects of bmy gene knockout on hemolytic and antimicrobial activity of Bacillus amyloliquefaciens Q-426. Chinese Journal of Biotechnology, 2014, 34(3) : 56–60. |
| [2] | Zheng G, Slavik M F. Isolation, partial purification and characterization of a bacteriocin produced by a newly isolated Bacillus subtilis strain. Lett ApplMicrobiol, 1999, 28(5) : 363–367. |
| [3] | Chen X H, Koumoutsi A, ScholzR, et al. Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens. Journal of Biotechnology, 2008, 140(1-2) : 27–37. |
| [4] | Cotta SR, da Mota F F, Tupinambá G, et al. Antimicrobial activity of PaenibacilluskribbensisPOC 115 against the dermatophyte Trichophyton rubrum. World J MicrobiolBiotechnol, 2012, 28(3) : 953–962. DOI:10.1007/s11274-011-0893-1 |
| [5] | Jennings M B, Weinberg J M, Koestenblatt E K, et al. Study of clinically suspected onychomycosis in a podiatric population. J Am Podiatr Med Assoc, 2002, 92(6) : 327–330. DOI:10.7547/87507315-92-6-327 |
| [6] |
赵鹏超, 王建华, 权春善, 等.
枯草芽孢杆菌抗菌肽生物合成的研究进展. 中国生物工程杂志, 2010, 30(10) : 108–113.
Zhao P C, Wang J H, Quan C S, et al. Research Progress of Antibacterial Peptide Biosynthesis of Bacillus subtilis. Chinese Journal of Biotechnology, 2010, 30(10) : 108–113. |
| [7] | Okada M, Yamaguchi H, Sato I, et al. Chemicalstructure of posttranslational modification with a farnesyl group on tryptophan. Biosci Biotechnol Biochem, 2008, 72(3) : 914–918. DOI:10.1271/bbb.80006 |
| [8] |
周伟. 解淀粉芽孢杆菌Q-426环脂肽生物合成及调控基因的研究. 大连: 大连民族大学, 生命科学学院, 2015: 40-41. Zhou W. Study on the Synthesis and Regulation Gene of Cyclic Lipopeptide from Bacillus and amyloliquefaciens Q-426.Dalian:Dalian Minzu University, College of Life Sciences, 2015:40-41. |
| [9] | Tortosa P, Logsdon L, Kraigher B, et al. Specificity and Genetic Polymorphism of the Bacillus competence quorum-sensing system. Journal of Bacteriology, 2001, 183(2) : 451–460. DOI:10.1128/JB.183.2.451-460.2001 |
| [10] | Okada M, Yamaguchi H, Sato I, et al. Structure-activity relationship studies on quorum sensing ComX(RO-E-2) pheromone. Bioorganic & Medicinal Chemistry Letters, 2007, 17(6) : 1705–1707. |
| [11] | Okada M, Sato I, Cho S J, et al. Chemical synthesis of ComX pheromone and related peptides containing isoprenoidal tryptophan residues. ChemInform, 2006, 62(50) : 8907–8918. |
| [12] | Tsuji F, Kobayashi K, Okada M, et al. The geranyl-modified tryptophan residue is crucial for ComXRO-E-2 pheromone biological activity. Bioorganic & Medicinal Chemistry Letters, 2011, 21(13) : 4041–4044. |
| [13] | Tsuji F, Ishihara A, Nakagawa A, et al. Lack of the consensus sequence necessary for tryptophan prenylation in the ComX pheromone precursor. Agricultural and Biological Chemistry, 2012, 76(8) : 1492–1496. |
| [14] | Coin i I, Beyermann M, Bienert M. Solid-phase peptide synthesis:from standard procedures to the synthesis of difficult sequences. Nat Protoc, 2007, 2(12) : 3247–3256. DOI:10.1038/nprot.2007.454 |
| [15] |
陈向明, 陈河如.
芴烯-哌啶加合物的紫外光谱研究及其应用. 中山大学学报(自然科学版), 2005, 44(6) : 61–63.
Chen X M, Chen H M. Study on the ultraviolet spectrum of fluorene-piperidine adduct and its application. Journal of Sun Yat-Sen University (Natural Science Edition), 2005, 44(6) : 61–63. |
| [16] | Tsuji F, Ishihara A, Kurata K, et al. Geranyl modification on the tryptophan residue of ComX RO-E-2, pheromone by a cell-free system. FEBS Letters, 2012, 586(2) : 174–179. DOI:10.1016/j.febslet.2011.12.012 |
| [17] |
刘静. 解淀粉芽孢杆菌Q-426环脂肽的分离纯化及其生物活性的研究. 大连: 大连民族大学, 生命科学学院, 2016: 13-14. Liu J. Study on Isolation, Purification and Bioactivities of Cyclic Lipopeptides from Bacillus amyloliquefaciens Q-426.Dalian:Dalian Minzu University, College of Life Sciences, 2016:13-14. |
 2017, Vol. 37
2017, Vol. 37




