文章信息
- 姚长洪, 吴佩春, 曹旭鹏, 刘娇, 姜君鹏, 薛松.
- YAO Chang-hong, WU Pei-chun, CAO Xu-peng, LIU Jiao, JIANG Jun-peng, XUE Song.
- 两株筛自大规模生产跑道池的节旋藻性能比较研究
- Comparative Characterization of Two Arthrospira Strains Isolated from Full-scale Raceway Pond
- 中国生物工程杂志, 2017, 37(5): 28-37
- China Biotechnology, 2017, 37(5): 28-37
- http://dx.doi.org/DOI:10.13523/j.cb.20170504
-
文章历史
- 收稿日期: 2016-12-22
- 修回日期: 2017-01-16
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
节旋藻(通常称螺旋藻)是一种原核多细胞丝状蓝藻,属蓝藻门(Cyanophyta)蓝藻纲(Cyanophyceae)颤藻目(Oscillatoriales)颤藻科(Osciallatoriaceae)节旋藻属(Arthrospira),因其含有丰富的蛋白质、不饱和脂肪酸、色素、多糖、维生素和微量元素等营养物质,已经被广泛应用于食品、保健品、化妆品、医药、饲料等行业[1-2]。此外,在营养胁迫下(如缺氮、缺磷等)节旋藻能够积累占细胞干重50%以上的碳水化合物,使其在发酵制备生物质燃料(如乙醇、沼气等)领域也具有广泛的应用前景[3-4]。
内蒙古鄂尔多斯地区是我国节旋藻产业的重要基地之一,其年产量占到我国总产量的1/3以上[5]。然而其单位面积平均产率仅为5~9g/(m2·d),与国外目前达到10~14g/(m2·d)的水平尚有差距[6-7]。影响鄂尔多斯地区节旋藻产率的重要因素在于温度的限制。节旋藻生长适宜的温度通常在25~35℃,而鄂尔多斯地区春、秋季平均气温不超过15℃,夏季光照时间长、强度高,紫外线强烈,节旋藻培养大棚中藻液的温度可以达到38℃甚至40℃以上,因此养殖时间局限在5月~10月初,且产率受环境变化的影响而不稳定[6, 8-10]。因此,筛选耐受低、高温胁迫的优良藻株对提高节旋藻产量具有重要意义。
国内外目前普遍采用驯化分离、物理化学诱变等方法进行节旋藻高产耐温优良藻种的筛选,取得一定的成果[11-12]。然而在实际生产中,长期处于高光强、高紫外辐射、温差变化剧烈的气候环境,原始藻种很容易发生突变而引起藻种退化,影响生物质产率和生物质的品质[9, 13]。另外,原始藻种也可能通过这样的自然诱变获得更加适应这些环境的优良藻株。此外,在实际生产过程中藻种在不同企业间不断传递使用,很容易造成藻种的混杂[13]。因此有必要对生产藻株进行分离纯化。作为仅有报道的例子,李正娟等[13]对鄂托克旗螺旋藻园区内的生产藻种钝顶节旋藻(Arthrospira platensis S2) 进行分离纯化,选育了2株高产优质藻株,然而对其温度的耐受性等关键因素并未涉及。本文对生产规模跑道池中的藻株进行分离纯化,并对其生物质积累性能和对低温、高温胁迫的耐受能力进行了评估,以期筛选出高产和耐受环境胁迫的优良生产藻株。
1 材料与方法 1.1 实验材料用于藻种分离纯化的节旋藻培养液取自2013年8月内蒙古鄂尔多斯市绿蚨源生物科技有限公司节旋藻培养跑道池。用于藻种评估的液体培养基为修改的Zarrouk培养基(MZ),以去离子水配制,每升水体含:NaHCO3 16.8g,K2HPO4 0.5g,NaNO3 2.5g,K2SO4 1g,NaCl 1g,MgSO4·7H2O 0.2g,CaCl2·2H2O 0.04g,FeSO4·7H2O 0.01g,H3BO3 2.86mg,MnCl2·4H2O 1.86mg,ZnSO4·7H2O 0.22mg,Na2MoO4·2H2O 0.39mg,CuSO4·5H2O 0.08mg。N缺乏(-N)条件下将MZ培养基中的NaNO3替换成相同物质的量浓度的NaCl(1.72g/L),其余成分相同(MZ-N培养基)。用于藻种纯化的固体平板培养基为添加1.5%琼脂的上述MZ培养基,配制时先将NaHCO3、K2HPO4、NaNO3、K2SO4、NaCl和MgSO4·7H2O配成2倍浓度的母液(母液1),同时用去离子水配制3.0%的琼脂母液(母液2),121℃高压灭菌20min,将母液1和母液2等比例混合,冷却至60℃后按上述MZ培养基的组成加入灭菌后的CaCl2·2H2O母液(1:1 000)、FeSO4·7H2O母液(1:100) 和其余微量元素母液(1:1 000),冷却凝固后备用。
1.2 实验方法 1.2.1 藻种的纯化将原始藻液用MZ培养基稀释至OD560为0.30±0.05,取0.2ml涂布于MZ平板上,置于(25±2)℃下光照培养,光照强度(35±2)μmol/(m2·s),光暗比14h:10h,约10天后长出藻落,其中包括非迁移性点状和迁移性丝状两类藻落。分别用接种环挑取点状单藻落的中心藻丝和丝状藻落的外围藻丝进行划线分离纯化。反复划线分离5次后,显微镜下观察平板上两类藻落分离完全。
1.2.2 藻种的16S rRNA基因序列鉴定从固体培养基上挑取直径0.1~3mm的待测藻落,加入装有10μl无菌超纯水的PCR管中,用10μl枪头反复吹打直至藻落散开成均匀体系,99℃加热20min,冷却至4℃,用10μl枪头再次反复吹打,至藻细胞彻底破碎,释放节旋藻基因组DNA,用于16S rRNA基因扩增。引物序列为:8F:5′-GAG AGT TTG ATC CTG GCT CAG-3′;1492R:5′-CGG CTA CCT TGT TAC GAC-3′。PCR反应体系(50μl):10×La PCR Buffer Ⅱ (Mg2+ Plus) 5μl,TaKaRa La Taq (5U/μl) 0.5μl,dNTPs Mixture(各2.5mmoL/L)8μl,DNA模板1μl,8F和1492R引物各0.5μl,去离子水34.5μl。PCR反应条件为:95℃ 3min;94℃ 30s,58℃ 30s,70℃ 2min,共30个循环;72℃ 6min后维持在4℃结束反应。PCR产物送上海立菲生物技术有限公司测序。测序结果与GenBank中的已知序列进行同源性比对,下载部分节旋藻和其他蓝藻的16S rRNA基因序列,用MEGA 7软件中的ClustalW程序进行序列的多重比对,空位或缺失位点均作删除处理,并以Kimura-2-parameter模型,采用邻接法(Neighbor-Joining, NJ)构建系统进化树,构树方法用自展检验估计系统树分支节点的置信度,自展数据集为1 000。
1.2.3 藻种的评估固体平板上的藻株接入液体MZ培养基中,于(25±2)℃,光照强度(35±2)μmol/(m2·s)、光暗比14h:10h的条件下,经过2ml、20ml、250ml、1 000ml逐级放大培养后作为活化的藻种进行生物质积累性能和耐温性能评估。
培养至对数生长期的藻种于300目滤布过滤除去液体培养基,用100ml新鲜MZ培养基洗涤1次后接入装有200ml新鲜MZ培养基的500ml三角瓶,调整初始接种密度OD560为0.50±0.05,置于光照培养箱中培养,光照强度(35±2)μmol/(m2·s),光暗比14h:10h,温度分别设为28℃、15℃和41℃进行富氮(+N)条件下的生物质积累性能和耐温性能评估。对于缺氮(-N)条件下的生物质积累性能评估,则将以上过程中的MZ培养基换成MZ-N培养基,同时将温度设为28℃。每天手工摇动3次。每个培养条件分别设置3个生物学平行。
1.2.4 分析方法(1) 藻丝形态:由光学显微镜(Nikon ECLIPSE Ni-U)观察并照相,随机选取12根藻丝统计其形态参数。
(2) 节旋藻生物量:用Jasco-V530紫外可见分光光度计测定OD560代表节旋藻的生长情况。
(3) 细胞干重和生物质产率测定:取提前烘干并称重(m1, mg)的Whatman GF/C(直径47mm)滤膜,过滤10ml藻液(体积V,ml),并用4ml蒸馏水洗涤滤饼一次,60℃烘干至恒重,称过滤烘干后的滤膜重(m2, mg)。细胞干重(DW, g/L)按照下式计算:
| $ {\rm{DW = (}}{\mathit{m}_{\rm{2}}}{\rm{ - }}{\mathit{m}_{\rm{1}}}{\rm{)/}}\mathit{V} $ |
生物质产率[Pb, mg/(L·d)]按照下式计算:
| $ {\mathit{P}_{\rm{b}}}{\rm{ = (D}}{{\rm{W}}_\mathit{t}}{\rm{ - D}}{{\rm{W}}_{\rm{0}}}{\rm{)/}}\mathit{t} \times {\rm{1}}\;{\rm{000}} $ |
式中,DWt和DW0分别为培养t时刻和初始时刻的细胞干重。
(4) 生物质成分测定:碳水化合物含量以硫酸-蒽酮法测定[14]。蛋白质按照Yao等[15]的方法提取,其含量以BCA法[16]测定。叶绿素、类胡萝卜素含量参照Yao等[17]方法,以乙醇提取后利用分光光度法测定。藻蓝蛋白利用0.1mol/L磷酸盐缓冲液(pH 7.0) 提取后利用分光光度法测定[18]。脂肪酸组成按照Liu等[19]方法利用气相色谱测定,脂肪酸含量利用C16:0甲酯作为外标定量。
(5) 叶绿素荧光动力学参数:用Water-PAM叶绿素荧光仪(Walz, Germany)测定光合系统Ⅱ(Photosystem Ⅱ,PS Ⅱ)实际光化学量子产量ΔF/Fm′。测量前将微藻样品暗适应10min,启动“光响应曲线”模式,细胞在光化光[AL, 481μmol/(m2·s)]下照射4min达到稳态后,测量稳态荧光F′,再用强饱和脉冲光[SP, 0.6s, 1416μmol/(m2·s)]激发,测量光适应条件下的最大荧光Fm′,按下式计算出PS Ⅱ的实际光化学量子产量[14, 20]:
| $ \Delta F{\rm{/}}{F_m}' = ({F_m}' - F')/{F_m}' $ |
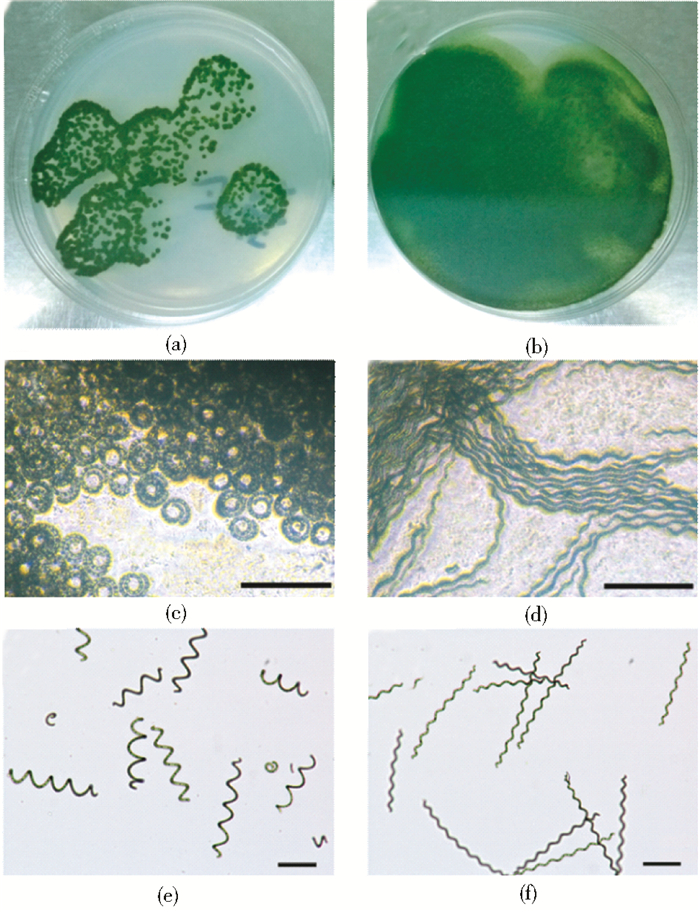
经过固体平板稀释涂布和划线纯化,分离到两株形态差异较大的藻株,如图 1所示。其中一株藻落在固体平板上以点状(dot)形式存在[图 1(a)],藻落主要延垂直方向生长,命名为DICP-D(以下简称藻株D)。显微镜下观察,该藻株的藻丝在固体平板上呈现类似于弹簧的螺旋[图 1(c)],螺旋直径为15~20μm,螺旋之间排列紧密,藻丝逐渐向上盘旋延伸,形成单藻落(非迁移性),这与肉眼观察的藻落形态吻合。另一株藻落与之完全不同,在固体平板上呈现放射状,类似于具有菌丝的霉菌,随着生长时间的延长而逐渐布满整个平板[迁移性,如图 1(b)]。显微镜下观察,该藻株的藻丝在固体平板上呈现波浪形的丝状(filament),沿着固体培养基的表面伸展[图 1(d)],命名为DICP-F(以下简称藻株F)。
|
| 图 1 节旋藻藻株D(a、c和e)和F(b、d和f)在肉眼下的固体琼脂平板(a和b)、显微镜下的固体琼脂平板(c和d)以及显微镜下的液体培养基(e和f)中的形态 Figure 1 Morphology of Arthrospira species DICP-D(a, c and e)and DICP-F(b, d and f)cultivated in solid agar plates under naked eye fields (a and b), microscope fields (c and d), and in liquid cultures under microscope fields (e and f) Scale bar represented 50μm |
在Zarrouk液体培养基中培养至对数生长期,藻株D和藻株F也具有不同的形态特征[图 1(e)、(f),表 1]。藻株D的单藻丝通常由3~5个螺旋组成,而藻株F的螺旋数(No. of helix)是藻株D的2~3倍,通常可以达到9个以上。藻株D的螺距(spiral pitch)和螺旋直径(spiral diameter)较大,平均分别为59.0μm和38.3μm,而藻株F的螺距和螺旋直径均较短,平均分别为38.6μm和14.5μm。藻株D的总体藻丝长度(filament length)比藻株F小近一半,而藻株D的藻丝直径(filament diameter)略大于藻株F。
| Strain | No. of helix | Spiral pitch (μm) |
Spiral diameter (μm) |
Filament length (μm) |
Filament diameter (μm) |
| DICP-D | 3.5±0.8 | 59.0±5.7 | 38.3±5.1 | 188.8±49.8 | 7.6±0.9 |
| DICP-F | 9.3±1.5 | 38.6±2.0 | 14.5±1.3 | 310.8±47.3 | 6.0±0.7 |
利用16S rRNA基因序列比对分析此两株藻的种属位置和亲缘关系。结果显示,藻株D和F均与多条已知节旋藻属的藻株[如Arthrospira platensis UTEX 2340和SAG 86.79,Spirulina (Arthrospira) maxima UTEX 2342,Arthrospira indica PD2002/ana和Arthrospira fusiformis AB2002/01]序列的相似度达到96%以上,尤其是藻株-F,其相似度达到99%。基于16S rRNA基因序列的系统进化树分析(图 2)表明,藻株D和藻株F均属于节旋藻属(Arthrospira),且均与Arthrospira platensis UTEX 2340聚为同一簇(支持率75%),表明它们与Arthrospira platensis UTEX 2340有更近的亲缘关系。Arthrospira platensis UTEX 2340来源于非洲Chad地区的碱湖[21],这与目前鄂托克旗螺旋藻园区普遍采用的生产藻株初始来源一致[6, 13],因此推测藻株D和藻株F可能是由原始生产藻株进化而来。从进化距离上看,藻株F更接近于Arthrospira platensis UTEX 2340,而藻株D的变异程度更大,进化距离相对较远。藻株D和藻株F在进化距离上的差异与其在生物质产率和对胁迫的耐受能力上的不同相吻合,具体将在2.2节和2.3节讨论。综上,藻株D和藻株F是节旋藻属(Arthrospira)下亲缘关系很近而形态差异较大的两株藻,目前还不能确定其种(species),分别命名为Arthrospira sp. DICP-D和Arthrospira sp. DICP-F,其16S rRNA基因部分序列的GenBank登陆号分别为KY363515和KY363516。

|
| 图 2 基于16S rRNA基因部分序列(1 313bp)用邻接法构建的分子系统树,内部节点上显示重复1 000次计算的自展支持率(小于50%的未显示) Figure 2 Molecular phylogenetic tree on the basis of 16S rRNA partial gene sequences (1 313bp) using Neighbor-joining method. Bootstrap values are shown at the internal nodes (not displayed if the value was less than 50%) |
生物质积累性能包括生物质生产效率和生物质品质,是节旋藻生产过程重要的指标,因此考察了两株节旋藻的生物质产率和生化成分的异同。
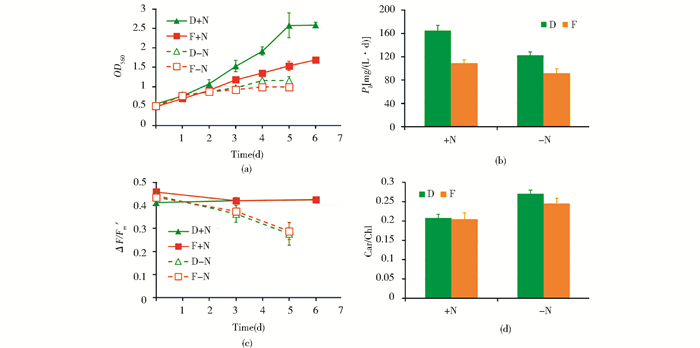
在正常温度(28℃)且富N(+N)的条件下,主要考察藻株的蛋白质和色素的生产性能。如图 3a所示,+N条件下藻株D的生长速率明显高于藻株F,到第5天达到稳定期,生物量增加到接种时的5倍,而藻株F则缓慢生长到第6天,生物量仅为藻株D的65%。与之对应,藻株D的生物质产率[图 3(b)]达到165mg/(L·d),比藻株F高51%。光合系统Ⅱ(PS Ⅱ)叶绿素荧光动力学参数ΔF/Fm′代表PS Ⅱ的实际光量子转化效率,其值的大小反映PS Ⅱ活性的高低,是光合生物重要的生理参数[20]。图 3(c)显示藻株D和藻株F的ΔF/Fm′均处于较高水平(0.42左右),表明它们的PS Ⅱ活性相当,因此藻株D和藻株F在生长速率和生物质产率上的差异并不是由于PS Ⅱ效率差异所引起的。
|
| 图 3 28℃培养下藻株D(D)和藻株F(F)在富N(+N)和缺氮(-N)条件下的生长(a)、生物质产率(b)、光合系统Ⅱ活性(c)及类胡萝卜素/叶绿素值(d) Figure 3 Growth (a), biomass productivity (b), photosystem Ⅱ performance (c), and carotenoid/chlorophyll ratio (d) in DICP-D (D) and DICP-F (F) under N repletion (+N) and N deprivation (-N) conditions cultivated under 28℃ |
生物质成分分析(表 2)表明,藻株D和藻株F的蛋白质、脂肪酸、藻蓝蛋白、叶绿素和类胡萝卜素等含量均没有显著差异,分别约占干重的46%、5%、5%、0.69%和0.14%。此外,藻株D和藻株F的主要脂肪酸成分(表 3)没有显著差异,均为C16:0、C18:2n6和C18:3n6,分别占总脂肪酸的43%、18%和25%。这些结果表明正常条件下藻株D和藻株F的生物质品质大体相同,但由于藻株D的生物质产率更高而使其更具有优势。
| Strain | DICP-D | DICP-F | ||
| N availability | +N | -N | +N | -N |
| Carbohydrate (%DW) |
22.1±1.1 | 73.4±1.5 | 39.0±3.6 | 73.1±1.9 |
| Protein(%DW) | 48.5±6.9 | 22.8±2.4 | 44.1±5.3 | 23.4±1.5 |
| FA(%DW) | 5.2±0.6 | 3.1±0.1 | 4.9±0.6 | 3.4±0.3 |
| PC(%DW) | 5.2±1.2 | 0.5±0.1 | 4.8±0.7 | 0.5±0.0 |
| Chl(mg/gDW) | 6.2±2.0 | 4.4±0.1 | 7.5±2.6 | 4.2±0.5 |
| Car(mg/gDW) | 1.3±0.4 | 1.2±0.1 | 1.5±0.5 | 1.0±0.2 |
| Strain | DICP-D | DICP-F | ||
| N availability | +N | -N | +N | -N |
| C16:0 | 43.6±0.3 | 44.8±0.4 | 43.4±0.2 | 43.6±0.2 |
| C16:1n7 | 3.8±0.0 | 3.9±0.7 | 4.1±0.1 | 4.0±0.8 |
| C18:0 | 1.2±0.1 | 1.4±0.0 | 1.0±0.1 | 2.5±0.4 |
| C18:1 | 2.1±0.0 | 4.1±0.3 | 3.3±0.1 | 9.1±1.3 |
| C18:2n6 | 18.1±0.2 | 16.1±0.3 | 18.9±0.6 | 15.7±0.3 |
| C18:3n6 | 25.7±0.2 | 26.3±0.7 | 24.2±0.5 | 23.3±1.0 |
| Unknown | 5.5±0.0 | 3.3±0.3 | 5.1±0.7 | 1.8±0.6 |
为了进一步考察两株藻的碳水化合物生产能力,在正常温度(28℃)下将藻株转入缺N(-N)培养基中培养5天,诱导碳水化合物积累。图 3a显示藻株D和藻株F的生物量在5天内分别增加了1.3倍和1.0倍。相应的,藻株D的生物质产率[图 3(b)]仍然比藻株F高33%。-N导致细胞的PS Ⅱ活性显著下降[图 3(c)],藻株D和藻株F的ΔF/Fm′到第5天均下降到初始值的64%左右,且没有显著差别,与+N条件下的结果一致,进一步说明藻株D和藻株F的差异并不表现在光合作用上。-N能诱导藻株D和藻株F的细胞内积累大量碳水化合物,其含量均高达干重的73%(表 2),说明藻株D和藻株F在碳水化合物积累能力上没有差别。然而,由于藻株D在生物质积累上的优势,使得藻株D的碳水化合物产率比藻株F高30%,达到123mg/(L·d)。
-N导致藻株D和藻株F的叶绿素含量下降,但类胡萝卜素变化不明显,因此类胡萝卜素/叶绿素值(Car/Chl)与+N下相比均显著提高,且在藻株D和藻株F中分别提高了30%和20%[图 3(d)]。叶绿素是光合作用吸收光能的分子,它与捕光色素蛋白复合物和反应中心结合,将捕获的光能转换成化学能驱动光合电子传递。在胁迫条件(如-N)下,藻细胞通过减少叶绿素合成,使细胞减少光能接收,以减轻过剩的光合电子所带来的氧化胁迫[22]。而类胡萝卜中的叶黄素被认为与过剩光能的热耗散密切相关,同样也是保护细胞免受光氧化的重要途径[23-24]。因此Car/Chl的升高可以看作是藻类细胞的光保护机制。本研究中,-N下藻株D的Car/Chl升高程度大于藻株F,表明藻株D的光保护能力强于藻株F。
与+N相比,-N导致藻株D和藻株F的C18:1含量均明显上升,而C18:2n6显著下降(表 3),但是藻株D的变化程度明显低于藻株F:-N后藻株D的C18:1增加了1.0倍,C18:2n6下降了11%,而藻株F则分别增加了1.8倍和17%。微藻在胁迫条件下的脂肪酸成分变化是其适应胁迫环境的重要机制之一,因此其变化程度与微藻受到的胁迫程度密切相关[25-26]。由此可以推测,藻株D所受到的N胁迫程度可能低于藻株F,这可能与藻株D较藻株F有更好的光保护能力有关。
2.3 藻株耐温性能评价将藻株在+N条件下分别培养于15℃和41℃,以考察两株藻对低温和高温胁迫的耐受能力。如图 4(a)所示,尽管与正常温度(28℃)下相比[图 3(a)]藻株D和藻株F的细胞生长均受到影响,但藻株D达到的生物量仍然比藻株F高34%~58%。生物质产率也呈现同样的趋势[图 4(b)],藻株D的生物质产率在15℃和41℃分别比藻株F高57%和2.3倍。值得注意的是,与28℃下相比,藻株D在41℃下的生物质产率降低了27%,明显低于藻株F的降低程度(66%),而在15℃下藻株D和藻株F的生物质产率均降低了40%左右,表明藻株D比藻株F更耐受41℃的高温胁迫,而它们对15℃的低温胁迫耐受能力相当。藻株D和藻株F的ΔF/Fm′[图 4(c)]在41℃的高温下缓慢降低,到第6天仍然均保持在初始值的81%左右,而在15℃下ΔF/Fm′迅速下降并维持到初始值的50%左右,表明PS Ⅱ活性更易受到低温胁迫的影响。

|
| 图 4 藻株D(D)和藻株F(F)在低温(15℃)和高温(41℃)下的生长(a)、生物质产率(b)、光合系统Ⅱ活性(c)及类胡萝卜素/叶绿素值(d) Figure 4 Growth (a), biomass productivity (b), photosystem Ⅱ performance (c), and carotenoid/chlorophyll ratio (d) in DICP-D (D) and DICP-F (F) under low (15℃) and high (14℃) temperatures |
低温胁迫引起藻株D和藻株F的生物质成分变化趋势类似于-N胁迫的情况,即碳水化合物升高而蛋白质、脂肪酸、藻蓝蛋白和叶绿素降低,类胡萝卜素基本不变(表 4)。然而,高温胁迫下藻株D和藻株F的生物质成分变化表现出各自显著的特点。藻株F在高温胁迫下碳水化合物降低了41%,而蛋白质则升高了18%,与其在低温胁迫下和藻株D在高温胁迫下的响应相反。微藻在胁迫条件下积累碳水化合物被认为是其适应胁迫环境的重要机制之一;微藻通过在胁迫条件下(如营养盐缺乏、盐胁迫、氧化胁迫等)积累碳水化合物维持碳源和能源在细胞中的相对平衡,同时调节光合作用活性以减少光损伤[27-28]。藻株F在高温胁迫下碳水化合物积累能力下降可能导致细胞对胁迫环境的适应能力下降。另外,藻株D在高温胁迫下的类胡萝卜素含量升高了34%,而藻株F则下降了29%,由此导致了藻株D的Car/Chl升高到正常温度时的2倍,而藻株F则几乎没有变化[图 4(d)]。这进一步表明藻株D在高温胁迫下可以启动保护机制,从而维持生物质产率处于相对较高(正常的73%)的水平,而藻株F则由于保护机制的减弱导致生物质产率大幅度降低(仅为正常的34%)。Vonshak和Novoplansky[29]证明了光保护机制较强的钝顶节旋藻株在低温胁迫下拥有更高的比生长速率,而本研究进一步表明,较强的光保护机制对高温胁迫下的节旋藻生物质产率同样更有利。另外,藻株D和藻株F在低温胁迫下能够积累大量碳水化合物,其含量占干重的55%以上(表 4)。因此在低温季节培养的节旋藻可以作为制备生物燃料的原料。由于藻株D的生物质产率更有优势,使得其碳水化合物产率也比藻株F高55%。
| Strain | DICP-D | DICP-F | ||
| Temperature(℃) | 15 | 41 | 15 | 41 |
| Carbohydrate(%DW) | 58.3±7.0(+164) | 33.9±2.2(+54) | 56.3±6.5(+44) | 23.2±5.2(-41) |
| Protein(%DW) | 26.8±3.4(-45) | 45.6±5.6(-6) | 34.9±0.4(-21) | 51.9±2.8(+18) |
| FA(%DW) | 3.1±0.3(-40) | 4.2±0.6(-19) | 3.4±0.5(-30) | 3.7±0.5(-24) |
| PC(%DW) | 1.3±0.4(-75) | 3.5±0.5(-33) | 2.4±1.3(-51) | 2.2±0.3(-55) |
| Chl(mg/gDW) | 4.3±0.4(-30) | 4.0±0.2(-36) | 6.5±0.6(-14) | 4.6±0.3(-39) |
| Car(mg/gDW) | 1.2±0.1(-5) | 1.7±0.1(+34) | 1.5±0.2(-1) | 1.1±0.0(-29) |
| Note: Numbers in parentheses are percentages of the increased (+) or decreased (-) value relative to those obtained under 28℃ | ||||
藻株D和藻株F在低温和高温胁迫下的脂肪酸成分变化呈现相似的趋势(表 5):在低温胁迫下,饱和脂肪酸(C16:0、C18:0) 和C18:1含量下降,而不饱和脂肪酸(C16:1n7、C18:3n6) 含量上升;高温胁迫呈现相反的趋势。总体上,低温胁迫增加脂肪酸的不饱和度,而高温胁迫增加脂肪酸的饱和度。这与在钝顶节旋藻和其他一些节旋藻株中的结果一致[30-31]。这是微藻适应温度变化的普遍机制,通过改变脂肪酸的饱和度,维持生物膜在低温和高温下的流动性和稳定性[25]。值得注意的是,藻株D和藻株F在低温胁迫下的饱和脂肪酸(SFA)和多不饱和脂肪酸(PUFA)变化程度几乎相同,而在高温胁迫下藻株F比藻株D的变化程度更高:高温胁迫下藻株F的SFA上升了14.9%,PUFA下降了18.7%,而藻株D则只分别上升和下降了9.1%和8.8%。这进一步表明藻株D和藻株F对低温胁迫有相似的耐受能力,而藻株D比藻株F更加耐受高温胁迫。
| Strain | DICP-D | DICP-F | ||
| Temperature(℃) | 15 | 41 | 15 | 41 |
| C16:0 | 39.6±0.5(-9) | 45.2±0.5(+4) | 40.0±0.4(-7) | 45.8±0.3(+5) |
| C16:1n7 | 7.0±0.1(+82) | 2.6±0.1(-33) | 6.3±0.1(+55) | 2.4±0.0(-41) |
| C18:0 | 0.0±0.0(-100) | 3.7±0.6(+217) | 0.0±0.0(-100) | 5.3±1.4(+416) |
| C18:1 | 1.5±0.0(-28) | 5.1±0.2(+147) | 2.6±0.1(-21) | 7.9±1.1(+140) |
| C18:2n6 | 20.2±0.2(+12) | 19.8±0.2(+9) | 20.2±0.3(+7) | 23.3±1.8(+23) |
| C18:3n6 | 27.6±0.3(+8) | 20.2±0.4(-21) | 26.9±0.1(+11) | 11.7±0.8(-52) |
| Unknown | 4.1±0.7(-26) | 3.6±0.5(-35) | 3.9±0.1(-23) | 3.6±0.4(-29) |
| SFA | 39.6±0.5(-11.5) | 48.8±0.6(+9.1) | 40.0±0.4(-9.9) | 51.1±1.1(+14.9) |
| PUFA | 47.8±0.5(+9.2) | 39.9±0.4(-8.8) | 47.1±0.3(+9.4) | 35.0±2.6(-18.7) |
| Note: Numbers in parentheses are percentages of the increased (+) or decreased (-) value relative to those obtained under 28℃ | ||||
本研究从实际生产规模的跑道池中筛选出具有优良生物质产率和胁迫耐受能力的藻株Arthrospira sp. DICP-D,与报道的具有较好耐温性的来源于鄂尔多斯高原当地碱湖的节旋藻种(Arthrospira innermongoliansis S1)[8]相比,其对低温和高温的耐受能力均更强,尤其是对低温的耐受性,其生长维持水平是S1的1.7倍(表 6)。这在扩大节旋藻生产季节、提高设备利用率、增加年产量等方面具有潜在优势。因此在节旋藻大规模培养中对藻种不断进行分离纯化,淘汰退化藻种,筛选优良藻种,是提高节旋藻环境胁迫耐受性和生物质产量的重要途径之一。
| Strain | Temperature(stress/normal, ℃) | Relative growth(% of normal) | Reference |
| Arthrospira innermongoliansis S1 | 15/30 | 25 | [8] |
| 40/30 | 45 | ||
| Arthrospira platensis S2 | 15/25 | 6 | [8] |
| 38/25 | 0 | ||
| Arthrospira maxima S3 | 15/30 | 19 | [8] |
| 40/30 | 38 | ||
| Arthrospira sp. DICP-D | 15/28 | 42 | This study |
| 41/28 | 56 | ||
| Arthrospira sp. DICP-F | 15/28 | 38 | This study |
| 41/28 | 43 |
3 结论
本研究从节旋藻大规模培养跑道池中分离到亲缘关系很近的两株节旋藻Arthrospira sp. DICP-D(D)和Arthrospira sp. DICP-F(F),它们在正常条件下拥有相似的生物质组成,N胁迫和低温胁迫下拥有相同的碳水化合物积累能力,但是藻株D的生物质产率在正常条件、N胁迫、低温和高温胁迫下均显著高于藻株F。藻株D比藻株F更耐受41℃的高温胁迫。藻株D比藻株F拥有更有效的光保护机制,使其能够更好地适应胁迫环境,从而比F维持更高的生物质产率。藻株D在生物质产率和胁迫耐受能力上的优良性状使其在户外大规模培养中具有良好的应用前景。
| [1] | Sili C, Torzillo G, Vonshak A. Ecology of Cyanobacteria Ⅱ:Their Diversity in Space and Time. 1st ed Dordrecht: Springer Netherlands, 2012: 677-705. |
| [2] | Belay A. Biology and Industrial Production of Arthrospira (Spirulina), Handbook of Microalgal Culture. 2nd ed New York: John Wiley & Sons, Ltd, 2013: 339-358. |
| [3] | Aikawa S, Izumi Y, Matsuda F, et al. Synergistic enhancement of glycogen production in Arthrospira platensis by optimization of light intensity and nitrate supply. Bioresource Technology, 2012, 108 : 211–215. DOI:10.1016/j.biortech.2012.01.004 |
| [4] | Möllers K B, Cannella D, Jørgensen H, et al. Cyanobacterial biomass as carbohydrate and nutrient feedstock for bioethanol production by yeast fermentation. Biotechnology for Biofuels, 2014, 7(1) : 64. DOI:10.1186/1754-6834-7-64 |
| [5] | Chen J, Wang Y, Benemann J R, et al. Microalgal industry in China:challenges and prospects. Journal of Applied Phycology, 2016, 28(2) : 1–11. |
| [6] | Lu Y M, Xiang W Z, Wen Y H. Spirulina (Arthrospira) industry in Inner Mongolia of China:current status and prospects. Journal of Applied Phycology, 2011, 23(2) : 265–269. DOI:10.1007/s10811-010-9552-4 |
| [7] |
曾文炉, 丛威, 蔡昭铃, 等.
螺旋藻的营养方式及光合作用影响因素. 植物学报, 2002, 19(1) : 70–77.
Zeng W L, Cong W, Cai Z L, et al. Reviews on the trophic modes and factors affecting photosynthesis of Spirulina. Chinese Bulletin of Botany, 2002, 19(1) : 70–77. |
| [8] |
杨学文, 李博生, 王志忠, 等.
温度对3种产业化螺旋藻生长及蛋白质含量影响的研究. 内蒙古农业大学学报(自然科学版), 2006, 27(2) : 60–64.
Yang X W, Li B S, Wang Z Z, et al. Effect of temperatues on growth and protein content of three species of Spirulina (Arthrospira). Journal of Inner Mongolia Agricultural University(Natural Science Edition), 2006, 27(2) : 60–64. |
| [9] |
张学成, 薛命雄.
我国螺旋藻产业的现状和发展潜力. 生物产业技术, 2012, 3(2) : 47–53.
Zhang X C, Xue M X. The current status and developmental potential of Arthrospira industry in China. Biotechnology & Business, 2012, 3(2) : 47–53. |
| [10] |
巩东辉. 鄂尔多斯高原碱湖钝顶螺旋藻对低温、强光的响应. 呼和浩特: 内蒙古农业大学, 农学院, 2013. Gong D H. The Response of Spirulina platensis to Low Temperature and High Light in an Alkali Lake of the Erdos Plateau. Hohbot:Inner Mongolia Agricultural University, Agricultural College, 2013. |
| [11] |
王妮, 王素英, 师德强.
耐低温螺旋藻新品系的诱变选育. 安徽农业科学, 2008, 36(29) : 12552–12553.
Wang N, Wang S Y, Shi D Q. Mutant screening of low temperature tolerence strain of Spirulina. Journal of Anhui Agricultural Sciences, 2008, 36(29) : 12552–12553. DOI:10.3969/j.issn.0517-6611.2008.29.006 |
| [12] |
殷春涛, 胡鸿钧, 李夜光, 等.
中温螺旋藻新品系的选育研究. 植物科学学报, 1997(3) : 250–254.
Yin C T, Hu H J, Li Y G, et al. Studies on middle temperature strains selection of Spirulina platensis. Journal of Wuhan Botanical Research, 1997(3) : 250–254. |
| [13] |
李正娟, 常蓉, 石光波, 等.
螺旋藻规模生产优良藻株的选育. 食品工业科技, 2016(14) : 210–218.
Li Z J, Chang R, Shi G B, et al. Selection and breeding of fine Spirulina strains of large-scale production. Science and Technology of Food Industry, 2016(14) : 210–218. |
| [14] | Yao C, Pan Y, Lu H, et al. Utilization of recovered nitrogen from hydrothermal carbonization process by Arthrospira platensis. Bioresource Technology, 2016, 212 : 26–34. DOI:10.1016/j.biortech.2016.03.166 |
| [15] | Yao C, Ai J, Cao X, et al. Enhancing starch production of a marine green microalga Tetraselmis subcordiformis through nutrient limitation. Bioresource Technology, 2012, 118(8) : 438–444. |
| [16] | Smith P K, Krohn R I, Hermanson G T, et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry, 1985, 150(1) : 76–85. DOI:10.1016/0003-2697(85)90442-7 |
| [17] | Yao C H, Ai J N, Cao X P, et al. Characterization of cell growth and starch production in the marine green microalga Tetraselmis subcordiformis under extracellular phosphorus-deprived and sequentially phosphorus-replete conditions. Applied Microbiology and Biotechnology, 2013, 97(13) : 6099–6110. DOI:10.1007/s00253-013-4983-x |
| [18] | Chen C Y, Kao P C, Tsai C J, et al. Engineering strategies for simultaneous enhancement of C-phycocyanin production and CO2 fixation with Spirulina platensis. Bioresource Technology, 2013, 145(4) : 307–312. |
| [19] | Liu J, Liu Y, Wang H, et al. Direct transesterification of fresh microalgal cells. Bioresource Technology, 2015, 176 : 284–287. DOI:10.1016/j.biortech.2014.10.094 |
| [20] | Murchie E H, Lawson T. Chlorophyll fluorescence analysis:a guide to good practice and understanding some new applications. Journal of Experimental Botany, 2013, 64(13) : 3983–3998. DOI:10.1093/jxb/ert208 |
| [21] | Scheldeman P, Baurain D, Bouhy R, et al. Arthrospira ('Spirulina') strains from four continents are resolved into only two clusters, based on amplified ribosomal DNA restriction analysis of the internally transcribed spacer. FEMS Microbiology Letters, 1999, 172(2) : 213–222. DOI:10.1111/fml.1999.172.issue-2 |
| [22] | Cirulis J T, Scott J A, Ross G M. Management of oxidative stress by microalgae. Canadian Journal of Physiology & Pharmacology, 2013, 91(1) : 15–21. |
| [23] | Minhas A K, Peter H, Barrow C J, et al. A Review on the Assessment of stress conditions for simultaneous production of microalgal lipids and carotenoids. Frontiers in Microbiology, 2016, 7 : 546. |
| [24] | Couso I, Vila M, Vigara J, et al. Synthesis of carotenoids and regulation of the carotenoid biosynthesis pathway in response to high light stress in the unicellular microalga Chlamydomonas reinhardtii. European Journal of Phycology, 2012, 47(3) : 223–232. DOI:10.1080/09670262.2012.692816 |
| [25] | Singh S C, Sinha R P, Häder D P. Role of lipids and fatty acids in stress tolerance in Cyanobacteria. Acta Protozoologica, 2002, 41(4) : 297–308. |
| [26] | Wang H T, Yao C H, Liu Y N, et al. Identification of fatty acid biomarkers for quantification of neutral lipids in marine microalgae Isochrysis zhangjiangensis. Journal of Applied Phycology, 2015, 27(1) : 249–255. DOI:10.1007/s10811-014-0300-z |
| [27] | Suzuki E, Ohkawa H, Moriya K, et al. Carbohydrate metabolism in mutants of the cyanobacterium Synechococcus elongatus PCC 7942 defective in glycogen synthesis. Applied & Environmental Microbiology, 2010, 76(10) : 3153–3159. |
| [28] | Gründel M, Scheunemann R, Lockau W, et al. Impaired glycogen synthesis causes metabolic overflow reactions and affects stress responses in the cyanobacterium Synechocystis sp.PCC 6803. Microbiology, 2012, 158(12) : 3032–3043. |
| [29] | Vonshak A, Novoplansky N. Acclimation to low temperature of two Arthrospira platensis (cyanobacteria) strains involves down-regulation of PSⅡ and improved resistance to photoinhibition. Journal of Phycology, 2008, 44(4) : 1071–1079. DOI:10.1111/jpy.2008.44.issue-4 |
| [30] | Maclde O, Mpc M, Robbs P G, et al. Growth and chemical composition of Spirulina maxima and Spirulina platensis biomass at different temperatures. Aquaculture International, 1999, 7(4) : 261–275. DOI:10.1023/A:1009233230706 |
| [31] | Cohen Z, Vonshak A, Richmond A. Fatty acid composition of Spirulina strains grown under various environmental conditions. Phytochemistry, 1987, 26(8) : 2255–2258. DOI:10.1016/S0031-9422(00)84694-4 |
 2017, Vol. 37
2017, Vol. 37




