文章信息
- 王佃亮.
- WANG Dian-liang.
- 细胞药物存在的问题、解决对策及发展前景——细胞药物连载之六
- The Problems, Solutions and Prospects of Cell Drug
- 中国生物工程杂志, 2017, 37(2): 127-132
- China Biotechnology, 2017, 37(2): 127-132
- http://dx.doi.org/DOI:10.13523/j.cb.20170218
-
文章历史
- 收稿日期: 2016-02-18
人类胚胎干细胞 (human embryonic stem cell, hESC) 是当今细胞药物研发的热点之一[1-3]。它具有分化成人体200多种细胞类型,形成机体任何细胞、组织和器官的潜能。在人工条件下,可定向分化为所需的细胞、组织乃至器官,用来治疗目前还难以或无法治愈的帕金森病、早老性痴呆、白血病、糖尿病、痛风、类风湿性关节炎、系统性红斑狼疮等疾病,解决十分紧缺的组织器官移植的来源。并且,与克隆技术相结合,运用体细胞核移植技术获得hESC,还能解决细胞治疗以及组织器官移植的免疫排斥难题。
然而,hESC研究也引发了激烈而敏感的伦理之争[4-6]。hESC涉及的伦理问题主要包括两个方面:一是,如何看待胚胎。胚胎是不是生命?是不是人?研究hESC是不是“毁灭生命”和“杀人”?这些问题很自然地成为争论的焦点。二是,是否必然滑向生殖性克隆。治疗性克隆是hESC研究的主要目的,但放开治疗性克隆研究,是否会导致研究生殖性克隆,这是有争议的。
hESC来源不同,涉及的具体伦理问题也不同[7-8]。目前hESC主要有五个来源:(1) 选择性流产的人类胚胎组织;(2) 不孕症治疗后的剩余胚胎组织;(3) 以研究为目的的捐献配子人工受精创造的胚胎;(4) 嵌合体胚胎;(5) 体细胞核移植技术产生的克隆性胚胎。不管哪一个来源,提取hESC都会损毁胚胎,都有伦理争议。
1.2 细胞药物的安全性问题 1.2.1 传统体细胞传统体细胞治疗在临床上具有较高的安全性,但存在禁忌症[9]。肝细胞移植的禁忌症主要包括严重败血症、不可逆的神经症状、有临床症状的心脏病和其他严重先天性畸形、肺 (血管) 分流、或肝外恶性肿瘤 (有治愈可能的除外)。另外血管异常、家庭或环境差、精神异常者属于相对禁忌症。移植肝细胞只有具有竞争性生长优势才能整合到宿主肝脏组织,存活、增殖,形成再生结节,否则易被宿主免疫系统排斥,逐渐凋亡,影响其临床应用的疗效,所以肝细胞移植要注意控制排异反应。患有不可根治的肿瘤和精神病是胰岛细胞移植的禁忌症,任何急性病无论与糖尿病是否有关,都应在移植前治疗和处理,特别要注意治疗感染性疾病,受者的年龄上限一般不超过60岁。但随着适应证的拓宽,其禁忌症也在不断改变,如受体年龄的限制等。
1.2.2 免疫细胞免疫细胞治疗肿瘤在临床上是安全可靠的。该方法的禁忌症包括:高度过敏体质或者有严重过敏史者;休克或全身衰竭生命体征不正常及不配合检查者;全身感染或局部严重感染需抗感染康复后;合并心、肺、肝、肾等重要脏器的功能障碍;凝血功能障碍如血友病、血清学检查阳性者如艾滋病、乙肝、梅毒等;染色体或基因缺陷;怀孕或哺乳期妇女;脏器移植者;严重自身免疫性疾病患者;对本治疗中所用生物制剂过敏者;T细胞淋巴瘤等[9]。
1.2.3 干细胞大量临床研究和治疗病例表明[9-11],干细胞移植治疗除极少数患者有轻微发热、头痛外,无其他严重不良反应,其临床应用是安全的,但有一些病人暂时还不宜进行干细胞治疗,包括休克或全身衰竭生命体征不正常及不配合检查者、晚期恶性肿瘤尤其是脑肿瘤患者、全身感染或局部严重感染抗感染康复前、合并心、肺、肝、肾等重要脏器功能障碍者、凝血功能障碍、血清学检查 (如艾滋病、乙肝、梅毒等) 阳性、非神经系统疾患或尚未明确诊断者、高度过敏体质或有严重过敏史者等。这些人群很可能会在手术中发生各种各样的突发问题,无法保证移植手术的顺利进行,需要特别注意。
2 细胞药物的发展策略 2.1 细胞药物伦理问题的解决策略细胞药物中hESC涉及到伦理问题,不同hESC来源涉及具体伦理问题的解决策略不同[7, 12]。(1) 针对选择性流产的人类胚胎组织,可考虑:从自愿捐献的人工流产胚胎组织中分离和培养胚胎生殖细胞,用于研究或临床治疗,妇女决定流产应先于捐献,流产是已发生的,与干细胞研究无关;研究者确保不是引诱妇女为金钱或为他人设计的干细胞研究目的而流产,研究者不可以提供经济补偿给妇女;禁止为使用胚胎和胎儿组织对流产时间或过程进行人为的操纵,确保供者和受者之间的自由和知情同意。(2) 针对不孕症治疗后的剩余胚胎组织,可考虑:捐献者自主决定是否继续存贮或捐献给另外的不孕夫妇;不许在预先设计下获得胚胎;不能买卖胚胎及胎儿组织;应以最少量的胚胎用于最重要的研究;研究者不得在治疗不孕症时有目的地增加植入胚胎的数量和增加配子;从国外进口的胚胎要符合国内的管理规定;捐献必须强调知情同意,使胚胎捐献者确知如何处置自己的胚胎,以避免被强迫或引诱;研究者应当用通俗易懂的科学语言向捐献者说明捐献的目的、意义、可能出现的问题及预防措施,在签署知情同意书后方可执行。(3) 针对用以研究为目的捐献配子创造的胚胎获取hESC,应考虑:在当前流产胎儿和即将废弃胎儿这两种hESC来源比较丰富的情况下,在尚无干细胞研究必须在这样的特定来源下才能进行的情况下,没有理由必须有意地为研究目的而捐献配子产生胚胎。只有当将来有足够的科学证据和社会赞同力,有足够的伦理理由可为研究或治疗的目的而产生胚胎辩护时,这种直接的捐献和主动创造才可以重新讨论;即使将来干细胞某些重要研究必须用以研究为目的捐献配子创造的胚胎才能进行,研究中也必须随时接受科技部门和卫生部门的监督和检查。(4) 针对应用嵌合体胚胎产生hESC,可考虑:尽量利用嵌合体胚胎分化培养的干细胞系进行研究;用于hESC研究的嵌合体胚胎不得超过14天;嵌合体胚胎不得放入子宫;用嵌合体胚胎研究分化培养的研究单位准入要严格把关;从事hESC研究的单位必须在人员、技术设备、管理和伦理方面具备一定的条件等。(5) 针对用体细胞核移植技术产生hESC,可考虑在严格限制条件下,按照国家相关法律规定进行,因为除了人们对胚胎道德地位的伤害和工具性处理的反对,还有对无性生殖和基因工程的安全性的质疑,最令人担忧的是胚胎一旦放入子宫可能发育出克隆人,而克隆人是反人性、反自然、反社会的,有违无伤、有利、自主、和谐及尊重生命的尊严的伦理学原则,许多国家都坚决反对克隆人。
我国科技部和卫生部于2003年12月联合发布的《人胚胎干细胞研究的伦理指导原则》也规定hESC研究不能超过14天。日本等国基本接受这一立场,许多科学家、伦理学家和法学家,甚至天主教哲学家如麦克柯米克也表示赞同和支持。
为什么14天前的胚胎 (前胚胎) 可作为研究对象呢?根据胚胎学的大量研究,14天是形成双胞胎的最后界限;14天前主要形成胚胎外部组织 (外胚层)。特别重要的是,“原胚条”尚未出现。原胚条的出现意味着胚胎细胞开始向各个组织和器官发育分化,表现出各自的特殊性。比如,可以发育为脊椎骨和神经系统等。由此看来,14天前后的胚胎有明显的不同。一般认为,14天前的胚胎还是既无感觉又无知觉的细胞团,尚不构成道德主体,对其进行研究并不侵犯人的尊严。即便如此,也必须遵循严格的伦理规范,经过严格的伦理程序。
2.2 细胞药物安全问题的解决策略国内外大量临床研究表明,细胞药物是安全的,对许多疑难疾病的治疗是有效的,但在临床应用前,需要详细了解每位患者的病情,熟悉每种细胞药物的适应证和禁忌证,做到对症用药,对患有禁忌证的病人不轻易用药[9, 13-15]。在细胞治疗过程中,需要对细胞产品、细胞剂量、移植方法、移植时机等移植环节进行标准化和优化,注意观察控制药物不良反应,建立相应对策。譬如,为减少对移植肝细胞的免疫排斥反应,有以下几方面的对策:免疫抑制药物如类固醇激素、环孢霉素、他克莫司等有助于移植肝细胞的存活,缺点是同时抑制了移植细胞的增殖和分化;纯化和深低温保存同种肝细胞,可降低肝细胞的免疫原性,并维持移植细胞的长期存活;采用免疫隔离技术,肝细胞微囊化处理可延迟细胞免疫的发生时间。
3 细胞药物的发展前景细胞治疗产业发展具有非同寻常的社会意义和不可估量的经济效益[16-18]。基于美国FDA批准相关产品的实际销售额,研究人员估算了2008到2014年临床级细胞治疗产业的市场情况,发现在不到10年的时间里,临床级细胞治疗产业从几百万美元的年收入发展到今天已经超过10亿美元。保守预计到2014年,有望获得更大的增长,达到51亿美元。可以看到,细胞治疗技术的广泛应用已经不可避免,细胞治疗产业正在急剧扩张。目前相关临床试验正在展开并得到众多患者的强烈支持,细胞治疗的时代已经到来。随着大量成体细胞药物治疗疾病种类的不断增多,临床上得到显著改善的病例不断增加,为各种难治性疾病的治疗带来了希望,但同时细胞获取来源、体外操作质量、标准给药途径、安全性及疗效评估、体内示踪及技术成熟程度等环节仍然缺乏相应的详细规定,同时,细胞治疗还面临安全发展和监管等方面的问题,还需要对该领域的基础理论和机制进行广泛而深入的探索。
我国细胞药物的研究发展现状是研究起步较早,在基础研究领域和临床试验方面均取得了很好的成绩,多项细胞治疗方案已经试验性应用于临床疾病治疗,部分细胞产品也按照国家新药的申报规程进行了临床试验,也逐渐趋于产业化。目前我国加大了对细胞治疗与再生医学的科研经费投入,集中优势资源,重点支持,兼顾研发与应用基地和项目的关系,建立以区域性研发平台为中心,我国多家医院参与到细胞治疗的临床研究中,这也逐渐完善和加快了细胞治疗技术的规范化和产业化进程,积极推广细胞治疗产品的临床应用。其次我国积极参与细胞治疗研究领域的国际交流和合作,除技术研发的合作外,还高度关注法规伦理标准等方面的国际合作,鼓励细胞治疗相关的医院和科研机构积极参与国际研究和临床应用,积极与国际上有影响力的研究机构建立广泛的合作,推动科研与国际接轨。
近年来,干细胞研究的进程和产业化速度迅速加快。在临床应用方面,科学家们已成功地在体外将人的胚胎干细胞分化为肝细胞、内皮细胞、心肌细胞、胰腺β细胞、造血细胞和神经元,甚至具有功能的多巴胺神经元及少突胶质细胞和星状胶质细胞等等。在组织干细胞方面,科学家们能成功地从皮肤、骨、骨髓、脂肪等组织器官中分离培养出干细胞,并尝试把这些细胞用于疾病的治疗。胚胎干细胞在细胞替代治疗和药物开发等方面,均具有较大的应用价值。在临床应用上具有非常广阔的前景,将有可能为解决人类面临的许多医学难题,如意外损伤、放射损伤等患者的植皮,神经的修复,肌肉、骨及软骨缺损的修补,髋、膝关节的置换,血管疾病或损伤后的血管替代,糖尿病患者的胰岛植入,癌症患者手术后大剂量化疗后的造血和免疫重建,切除组织或器官的替代,部分遗传缺陷疾病的治疗等。所以仍然应该广泛开展ES细胞研究,更深入地了解ES细胞多能性以及自我更新的机制、ES细胞定向分化等问题,并尽快形成人类ES细胞的产业化。成体干细胞是开展研究较早较深入的领域,由于ES细胞的来源受限,而iPS处于研究的起始阶段,也是目前最有希望应用于临床的干细胞。HSC的应用已经提供了良好的基础,且MSC根据分化成为心肌细胞、造血细胞、成骨细胞、脂肪细胞、神经细胞等多种细胞类型,能在多种疾病的临床治疗方面发挥重要的作用。其中,对于MSC在骨骼疾病以及心血管疾病的治疗中发挥的作用研究相对较多。随着细胞治疗应用研究的深入,目前国内外已开展了多种成体细胞治疗的临床试验,比如利用神经细胞治疗帕金森病、阿尔茨海默病等,用胰岛细胞治疗糖尿病,用心肌细胞修复坏死的心肌等,并且国外已经出现了相关的干细胞产品,临床应用前景看好。
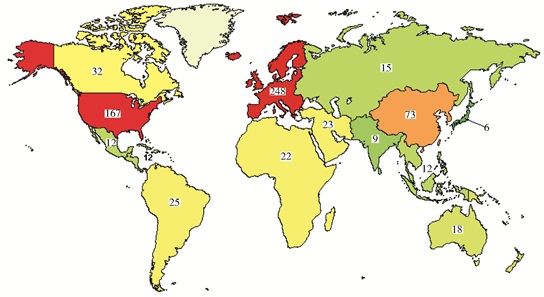
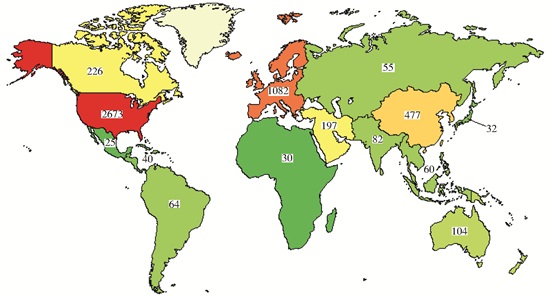
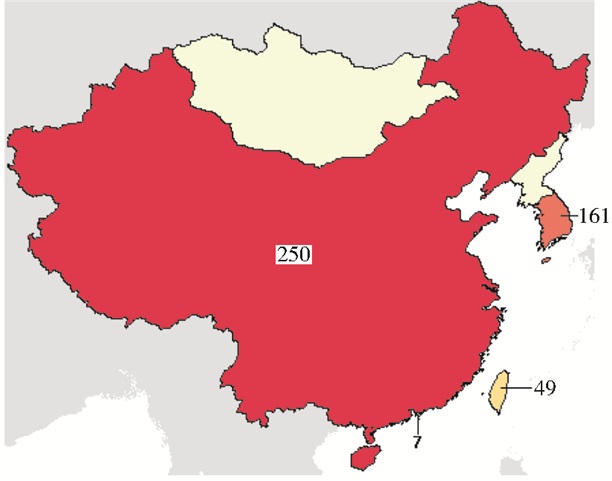
截止2016年月1日26日,经查询在clinicaltrial.gov上注册的,正在进行中的细胞治疗临床试验共有31 428项,其中Ⅱ、Ⅲ期临床试验共18 710项。IV期临床实验1 245项,已完成590项 (图 1)。干细胞治疗临床研究4 796项 (图 2)。中国干细胞临床研究共计306项 (其中大陆、香港、台湾分别为250项、7项、49项)(图 3),其中中国大陆Ⅰ、Ⅱ、Ⅲ期197项,Ⅳ期18项。2014年7月1日以前,clinicaltrial.gov上注册的细胞治疗临床试验共有7 002项,其中Ⅱ、Ⅲ期临床试验共3 883项。这表明,细胞治疗临床研究增长迅速。
|
| 图 1 截止2016年1月26日世界各大洲细胞治疗Ⅳ期临床实验完成情况 Figure 1 Phase Ⅳ clinical trials of cell therapy in the world by January 26, 2016 (from: clinicaltrial.gov) |
|
| 图 2 截止2016年1月26日世界各大洲干细胞治疗临床实验情况 Figure 2 Clinical trials of stem cell therapy in the world by January 26, 2016 (from: clinicaltrial.gov) |
|
| 图 3 截止2016年1月26日东亚干细胞治疗临床实验情况 Figure 3 Clinical trials of stem cell therapy in East Asia by January 26, 2016 (from: clinicaltrial.gov) |
预计,全球干细胞医疗近两年的潜在市场规模大约在80万美元,未来20年内,干细胞医疗市场的全球规模将迅速增长。干细胞疗法因应用前景广阔且研究与开发日益深入,其总市场预期到2016年将扩展至89亿美元 (年复合增长率为10.6%),受到世界各国的高度重视。美国、欧盟、日本、韩国和中国在干细胞领域投入重金支持产业研究,大力推动干细胞产业化发展。近年来研制和生产供临床治疗和科研所需的干细胞治疗再生医学产品的公司,在欧美、日韩等国家迅速发展起来。美国FDA 2009年12月31日以前共批准2 980项干细胞治疗项目;2010年7月30日,美国Geron公司获准世界上第一例胚胎干细胞临床使用,这是医学史上的一个里程碑;2010年10月,英国首例干细胞人体试验获得批准;最近两年,韩国已批准3例干细胞药物。韩国政府大力投资干细胞研究,计划到2015年,干细胞研究年度经费将从3 300万美元提高到9 800万美元,建立至少5个世界级研究团队。“以干细胞治疗为核心的再生医学,将成为继药物治疗、手术治疗后的另一种疾病治疗途径,从而成为新医学革命的核心。”我国科技部2012年4月发布的《干细胞研究国家重大科学研究计划“十二五”专项规划 (公示稿)》对干细胞治疗的地位作了上述评估,这代表了中国政府对干细胞治疗的基本认识。干细胞研究因此已提升到战略高度,国家对干细胞临床医学抱以极大的期望。为抢占未来干细胞研究和产业发展的制高点,我国还应该不断加强干细胞研究的创新能力、发展模式,重视配套法律、法规建设,大力推进干细胞产业发展。在科研的推动下,我国的干细胞产业已初步形成规模,如协和干细胞基因工程有限公司、深圳北科生物科技有限公司等。还有很多干细胞机构建立了工程研究中心,如科技部国家干细胞工程技术研究中心、国家发展和改革委员会细胞产品国家工程研究中心和人类胚胎干细胞国家工程研究中心。此外许多医院和机构开展了干细胞的临床试验研究。
虽然近年来在干细胞研究和产业化方面我国取得了较大进展,但是与美国等发达国家比较,我国的干细胞研究与产业化水平还存在较大差距,主要体现在以下方面:(1) 虽然我国科研成果不断涌现,但干细胞基础和临床研究发展水平与国外仍存在较大差距,需要继续进行干细胞相关基础与应用的研究,尚需解决的问题比如干细胞在再生医学中的作用机制,降低干细胞治疗中的致瘤性,明确各种疾病应用的适应证和禁忌证,干细胞产品标准化,干细胞的移植频率,移植细胞数量,移植时机和移植途径等。(2) 我国干细胞产业发展尚处于初级发展阶段,根据国际干细胞组织年报数据,在全球干细胞产品市场份额中,美国约占50%,欧洲约占40%.其余地区共计10%,中国所占比重很小。目前,我国绝大部分干细胞企业还处于起步阶段。缺乏核心技术、人才和资金,针对中国的巨大市场,随着干细胞产业的进一步发展,国外拥有强大研发和技术实力的干细胞企业势必加速进入中国市场,未来对我国的干细胞企业发展将带来更大的冲击和挑战。③细胞制品与其他生物制品有共性也有不同之处,干细胞研究和产品制备等相关法律、法规和配套机制尚未完善,导致干细胞临床研究和治疗的管理和监督不规范。部分国内医疗机构利用这种漏洞,在没有充分实验证据的前体下,即开展干细胞移植治疗,我国一些单位进行过度的、不科学的商业炒作,造成负面影响。干细胞治疗及其产品的安全性和有效性需要高水平的专业人员采用综合方法来评价。④控制干细胞产品质量,干细胞是人体细胞,本身对人体是无害的,但是由于供者可能患有疾病,干细胞采集、分离提取、培养扩增和保存期间都可能受到病原菌和其他有害物质的污染。因此,无论是用于个体化治疗的细胞制品或者是通用型干细胞制品,必须严格制备工艺和质量管理,确保产品的安全性、同一性、纯度和有效性。
目前大部分细胞药物仍处在临床前和临床研究阶段[19-21]。随着细胞生物学及临床应用研究的深入,将来细胞药物将会像基因药物一样,成为基础研究和临床防治的重要组成。细胞药物的研发将成为创新药物研发的新热点,并最终会作为一类治疗及预防药物,服务于患者,造福于人类。
| [1] | Yap M S, Tang Y Q, Yeo Y, et al. Pluripotent human embryonic stem cell derived neural lineages for in vitro modelling of enterovirus 71 infection and therapy. Virol J, 2016, 13(1) : 5. DOI:10.1186/s12985-015-0454-6 |
| [2] | Peng Y. The patentability of human embryonic stem cell technology in China. Nat Biotechnol, 2016, 34(1) : 37–39. DOI:10.1038/nbt.3417 |
| [3] | Plaza Reyes A, Petrus-Reurer S, Antonsson L, et al. Xeno-free and defined human embryonic stem cell-derived retinal pigment epithelial cells functionally integrate in a large-eyed preclinical model. Stem Cell Reports, 2016, 6(1) : 9–17. DOI:10.1016/j.stemcr.2015.11.008 |
| [4] | Espinoza N, Peterson M. How to depolarise the ethical debate over human embryonic stem cell research (and other ethical debates too!). J Med Ethics, 2012, 38(8) : 496–500. DOI:10.1136/medethics-2011-100099 |
| [5] | Ehrich K, Williams C, Farsides B. Consenting futures:professional views on social, clinical and ethical aspects of information feedback to embryo donors in human embryonic stem cell research. Clin Ethics, 2010, 5(2) : 77–85. DOI:10.1258/ce.2009.009038 |
| [6] | Haimes E, Taylor K. The contributions of empirical evidence to socio-ethical debates on fresh embryo donation for human embryonic stem cell research. Bioethics, 2011, 25(6) : 334–341. DOI:10.1111/j.1467-8519.2009.01792.x |
| [7] | 康亚妮, 刘皓. 人类胚胎干细胞来源引发的伦理问题. 中国医学伦理学, 2004, 17(93) : 15–16. Kang Y N, Liu H. Ethical issues of human embryonic stem cell sources. Chinese Journal of Medical Ethics, 2004, 17(93) : 15–16. |
| [8] | Cohen C B. Ethical and policy issues surrounding the donation of cryopreserved and fresh embryos for human embryonic stem cell research. Stem Cell Rev, 2009, 5(2) : 116–122. DOI:10.1007/s12015-009-9060-6 |
| [9] | 王佃亮. 移植细胞的种类及其有效性和安全性. 中国生物工程杂志, 2013, 33(9) : 119–125. Wang D L. The types, safety and efficacity of the transplanted cells. China Biotechnology, 2013, 33(9) : 119–125. |
| [10] | Si Y, Yang K, Qin M, et al. Efficacy and safety of human umbilical cord derived mesenchymal stem cell therapy in children with severe aplastic anemia following allogeneic hematopoietic stem cell transplantation:a retrospective case series of 37 patients. Pediatr Hematol Oncol, 2014, 31(1) : 39–49. DOI:10.3109/08880018.2013.867556 |
| [11] | Zhang Z, Fu J, Xu X, et al. Safety and immunological responses to human mesenchymal stem cell therapy in difficult-to-treat HIV-1-infected patients. AIDS, 2013, 27(8) : 1283–1293. DOI:10.1097/QAD.0b013e32835fab77 |
| [12] | Gruen L, Grabel L. Concise review:scientific and ethical roadblocks to human embryonic stem cell therapy. Stem Cells, 2006, 24(10) : 2162–2169. DOI:10.1634/stemcells.2006-0105 |
| [13] | Reinders M E, Dreyer G J, Bank J R, et al. Safety of allogeneic bone marrow derived mesenchymal stromal cell therapy in renal transplant recipients:the neptune study. J Transl Med, 2015, 13 : 344. DOI:10.1186/s12967-015-0700-0 |
| [14] | Bole-Richard E, Deschamps M, Ferrand C, et al. Editorial:improving the safety of cell therapy products by suicide gene transfer. Front Pharmacol, 2015, 6 : 174. |
| [15] | Williams J K, Eckman D, Dean A, et al. The dose-effect safety profile of skeletal muscle precursor cell therapy in a dog model of intrinsic urinary sphincter deficiency. Stem Cells Transl Med, 2015, 4(3) : 286–294. DOI:10.5966/sctm.2014-0114 |
| [16] | Pawitan J A. Prospect of cell therapy for Parkinson's disease. Anat Cell Biol, 2011, 44(4) : 256–264. DOI:10.5115/acb.2011.44.4.256 |
| [17] | Hashmi S, Ahmed M, Murad M H, et al. Survival after mesenchymal stromal cell therapy in steroid-refractory acute graft-versus-host disease:systematic review and meta-analysis. Lancet Haematol, 2016, 3(1) : 45–52. DOI:10.1016/S2352-3026(15)00224-0 |
| [18] | Shetty A K, Upadhya D. GABA-ergic cell therapy for epilepsy:Advances, limitations and challenges. Neurosci Biobehav Rev, 2015, 62 : 35–47. |
| [19] | Gross G, Eshhar Z. Therapeutic potential of T cell chimeric antigen receptors (CARs) in cancer treatment:counteracting off-tumor toxicities for safe CAR T cell therapy. Annu Rev Pharmacol Toxicol, 2016, 56 : 59–83. DOI:10.1146/annurev-pharmtox-010814-124844 |
| [20] | Schimke M M, Marozin S, Lepperdinger G. Patient-specific age:the other side of the coin in advanced mesenchymal stem cell therapy. Front Physiol, 2015, 6 : 362. |
| [21] | Golpanian S, Schulman I H, Ebert R F, et al. Concise review:review and perspective of cell dosage and routes of administration from preclinical and clinical studies of stem cell therapy for heart disease. Stem Cells Transl Med, 2016, 5(2) : 186–191. DOI:10.5966/sctm.2015-0101 |
 2017, Vol. 37
2017, Vol. 37




