文章信息
- 李爱芳, 谷月, 李雪茹, 孙晖, 查何, 谢佳卿, 赵佳丽, 周兰.
- LI Ai-fang, GU Yue, LI Xue-ru, SUN Hui, ZHA He, XIE Jia-qing, ZHAO Jia-li, ZHOU Lan.
- 促宫颈癌细胞增殖、迁移及其可能机制研究
- Effects of S100A6 on Proliferation and Migration of Human Cervical Cancer Cells and Its Mechanism
- 中国生物工程杂志, 2017, 37(2): 8-14
- China Biotechnology, 2017, 37(2): 8-14
- http://dx.doi.org/DOI:10.13523/j.cb.20170202
-
文章历史
- 收稿日期: 2016-07-28
- 修回日期: 2016-08-20
宫颈癌作为女性各种恶性肿瘤中最多见的肿瘤之一,其发病率在女性生殖器官肿瘤中占首位;近年来,宫颈癌发病有年轻化及发病年龄段前移的趋势。高危型HPV的持续感染与宫颈癌的发展密切相关[1]。随着细胞学筛查的普及和疫苗的应用,宫颈癌患者虽然得到了有效的早期诊断[2],但转移和复发仍然是其主要的死亡原因。因此阐明宫颈癌的发生机理和发现宫颈癌治疗的新靶点对宫颈癌的预防和治疗具有积极意义。
S100家族是一类能与Ca2+结合的具有EF-手型结构的蛋白质分子[3],该家族成员的基因定位在人染色体1q21上,该区段易发生染色体重排、稳定性差,与多种肿瘤的发生发展密切相关[4]。S100A6是S100家族的成员之一,参与细胞内外多种生物学作用。近年来,S100A6在肿瘤中的作用备受关注。已有研究表明,S100A6在人结直肠癌[5]、胰腺癌[6]、胃癌[7]、肝癌[8]、骨肉瘤[9]等多种肿瘤的发生发展中起到了重要作用。谭媛等[10]研究发现S100A6蛋白在宫颈鳞癌组织中的表达明显升高,与宫颈病变恶性程度提高、宫颈鳞癌淋巴结转移呈正相关。但是关于S100A6对宫颈癌细胞增殖、迁移影响的研究目前少有报道。因此,本研究以宫颈癌细胞为研究对象,探讨S100A6对其增殖、迁移的影响及其机制。
1 材料与方法 1.1 材料 1.1.1 细胞人宫颈癌细胞系HeLa、SiHa和CaSki购自美国模式培养物集存库 (American Type Culture Collection,ATCC)。
1.1.2 病毒重组腺病毒AdS100A6、AdsiS100A6和对照腺病毒AdGFP、AdRFP由美国芝加哥大学分子肿瘤实验室何通川教授馈赠。
1.1.3 主要试剂DMEM高糖培养基和胎牛血清 (fetal bovine serum, FBS)(美国Gibco公司);实时荧光定量PCR检测试剂盒,TRIzol试剂和反转录试剂盒[宝生物工程 (大连) 有限公司];引物由南京金斯瑞生物科技有限公司合成;蛋白质提取及蛋白质印迹相关试剂购自碧云天生物技术研究所;鼠抗人β-actin单克隆抗体 (北京中杉金桥生物技术有限公司);兔抗人S100A6单克隆抗体 (美国Abcam公司);兔抗人E-cadherin单克隆抗体 (美国Santa Cruz公司);兔抗人N-cadherin单克隆抗体 (美国Santa Cruz公司);辣根过氧化物酶标记的山羊抗兔IgG和山羊抗鼠IgG (二抗) 均购自北京中杉金桥生物技术有限公司;MTT试剂购自北京Solarbiog公司。其他试剂均为国产分析纯。
1.2 方法 1.2.1 细胞培养宫颈癌细胞HeLa、SiHa和CaSki均为贴壁生长,用DMEM高糖完全培养基培养 (含10 %胎牛血清、100 U/ml青霉素和100 μg/ml链霉素)。当细胞汇合率约为80 %时,0.25 %胰蛋白酶消化并传代,于37 ℃、5 % CO2恒温培养箱中培养。
1.2.2 病毒感染细胞实验分为Blank组、对照组 (AdGFP组或AdRFP组) 及实验组 (AdS100A6组或AdsiS100A6组)。以对数生长期细胞为实验对象;以感染36 h后荧光阳性细胞达30 %~40 %为宜。
1.2.3 实时荧光定量PCR提取待测细胞的总RNA,取其中1μg反转录成cDNA,稀释5倍。以1 μl cDNA为模板进行PCR,检测3株宫颈癌细胞中S100A6的基础表达,引物见表 1。PCR反应条件为:94 ℃预变性3 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s;40个循环;最后,65 ℃ 5 s,每次升高0.5 ℃,直至95 ℃。Bio Rad软件进行分析。
| Gene | Primer sequences | Product size |
| S100A6 | Forward: 5′-ATGGCATGCCCCTGGATCAGG-3′ | 272bp |
| Reverse: 5′-TCAGCCCTTGAGGGCTTCAT-3′ | ||
| Snail | Forward: 5′-ACCCCACATCCTTCTCACTG-3′ | 217 bp |
| Reverse: 5′-TACAAAAACCCACGCAGACA-3′ | ||
| Twist | Forward: 5′-TCTTACGAGGAGCTGCAGAC-3′ | 406 bp |
| Reverse: 5′-TATCCAGCTCCAGAGTCTCT-3′ | ||
| GAPDH | Forward: 5′-CAG CGA CAC CCA CTC CTC-3′ | 120bp |
| Reverse: 5′-TGA GGT CCA CCA CCC TGT-3′ |
1.2.4 半定量RT-PCR
提取待测细胞的总RNA,取其中1μg反转录成cDNA,稀释5倍。以1 μl cDNA为模板进行PCR,检测细胞中内参GAPDH、Snail、Twist、的转录水平,引物见表 1。PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,62 ℃~54 ℃退火30 s,9个循环 (每个循环依次降低1℃),72℃延伸30s;94℃变性30s,55℃退火30s,72℃延伸30s,22~25个循环;最后,72℃延伸10min。然后进行2%琼脂糖凝胶电泳,采用Quantity One 4.6.2软件对电泳结果进行灰度值分析。
1.2.5 Western blot提取待测细胞的总蛋白并进行定量,行10% SDS-PAGE,再湿转至聚偏二氟乙烯膜,5%小牛血清37 ℃封闭2 h,分别加入一抗 (β-actin以1:1 000稀释,E-cadherin、N-cadherin以1:1 000稀释,S100A6以1:3 000稀释),4℃孵育过夜;TBST洗膜10 min 3次,加入二抗 (兔二抗和鼠二抗均为1:5 000稀释),37℃反应1 h;洗膜,按照电化学发光试剂盒说明进行显影。采用Quantity One 4.6.2软件对蛋白质条带进行灰度值分析。
1.2.6 MTT试验取对数生长期细胞以3 000/孔接种于96孔板中,待细胞贴壁变形后感染重组腺病毒,分组同前,每组设5个平行孔,6~8 h后换成含1 % FBS的DMEM培养基。培养1~5 d后,避光加入10 μl MTT,37 ℃培养4 h,吸弃孔内培养液,每孔加入150 μl DMSO,震荡混匀10 min至结晶物充分溶解;用酶联免疫检测仪检测波长492 nm处各孔的光密度 (OD) 值,以OD值表示细胞的增殖活力。
1.2.7 划痕愈合试验接种细胞于6孔板中,待细胞贴壁变形达80 %后感染重组腺病毒,分组同前,6~8 h后用0.5~10 μl枪头行“十”字划痕,PBS洗2次后换成1 % FBS的DMEM培养基,于倒置显微镜下观察并记0 h划痕宽度。然后将细胞放入培养箱继续培养,1 d、2 d、3 d后取出6孔板,在相同位置观察并拍照记录划痕宽度。每组取3处计算划痕宽度平均值,并计算划痕愈合率。划痕愈合率=(0 d划痕宽度-3 d划痕宽度)/0 d划痕宽度×100 %。
1.2.8 统计学方法实验均独立重复3次,实验数据用均数±标准差表示,利用SPSS 17.0和GraphPad Prism 5软件进行统计学分析;多组间均数比较采用单因素方差分析 (One-Way ANOVA),P < 0.05表示差异具有统计学意义。
2 结果 2.1 三株宫颈癌细胞中内源性S100A6的水平qPCR检测HeLa、SiHa和CaSki中S100A6的表达。如图 1所示,S100A6在HeLa细胞中表达最低,而在SiHa、CaSki细胞中表达量较高,差异有统计学意义 (P < 0.05)。因此,后续实验中分别选取SiHa和HeLa细胞作为下调和上调S100A6基因表达的实验对象,以观察S100A6对宫颈癌细胞增殖、迁移等行为的影响。
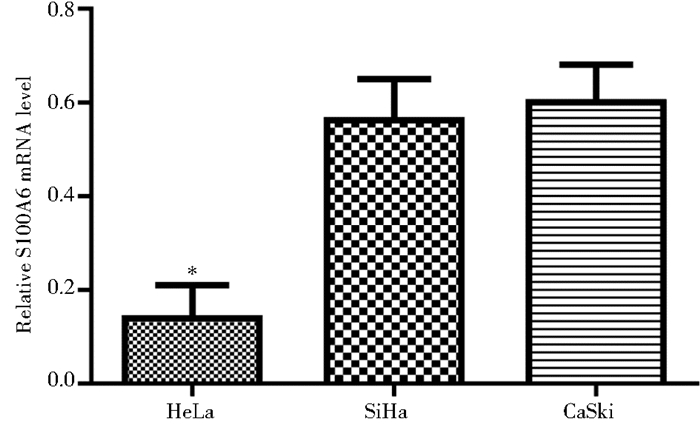
|
| 图 1 三株宫颈癌细胞系中S100A6的内源性表达 Figure 1 The endogenous expression of S100A6 in three cervical carcinoma cell lines * P < 0.05 |
Western blot结果显示,AdS100A6组的HeLa细胞中S100A6蛋白质水平显著高于对照组 (P < 0.005,图 2a),而AdsiS100A6组的SiHa细胞中S100A6则显著低于对照组 (P < 0.05,图 2b)。提示,重组腺病毒AdS100A6和AdsiS100A6分别成功感染HeLa、SiHa细胞,可用于后续研究。
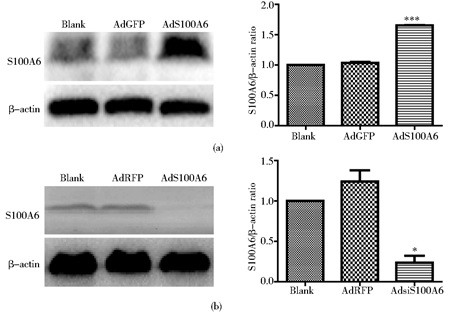
|
| 图 2 上调和下调S100A6表达的验证 Figure 2 Upregulation and downregulation of S100A6 were confirmed by Western blot (a) HeLa (b) SiHa * P < 0.05, *** P < 0.005 |
腺病毒处理后第1、2 d,三组细胞之间的OD492值无明显差异;较之相应对照组,AdS100A6组的HeLa细胞3 d时的OD492值则明显升高 (P < 0.005,图 3a),而AdsiS100A6组的SiHa细胞5 d时的OD492值则显著降低,差异有统计学意义 (P < 0.005,图 3b)。
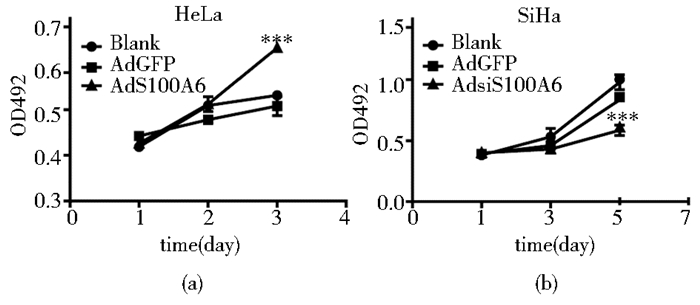
|
| 图 3 上调和下调S100A6对HeLa和SiHa细胞增殖的影响 (MTT) Figure 3 The effect of S100A6 upregulation and downregulation on proliferation of Hela and SiHa cells (MTT) (a) HeLa (b) SiHa *** P < 0.005 |
划痕愈合试验结果显示,3 d时HeLa细胞各组的划痕愈合率分别为 (8.70±1.26)%、(11.92±1.82)%和 (53.06±1.52)%,即AdS100A6组的划痕愈合率显著高于对照组 (P < 0.005,图 4a);而3 d时SiHa细胞各组的划痕愈合率分别为 (60.06±2.22) %,(59.60±2.02) %,(26.73±1.20) %,即AdsiS100A6组的划痕愈合率则显著低于对照组 (P < 0.05,图 4b)。

|
| 图 4 上调和下调S100A6对HeLa和SiHa细胞迁移的影响 Figure 4 The effect of S100A6 upregulation and downregulation on migration of Hela and SiHa cells (a) HeLa (b) SiHa |
Western blot检测EMT标志物时发现:在HeLa细胞中,与AdGFP组相比,AdS100A6组的E-cadherin水平降低,而N-cadherin水平增加;在SiHa细胞中,与AdRFP组相比,AdsiS100A6组的E-cadherin水平升高,而N-cadherin水平降低 (图 5)。
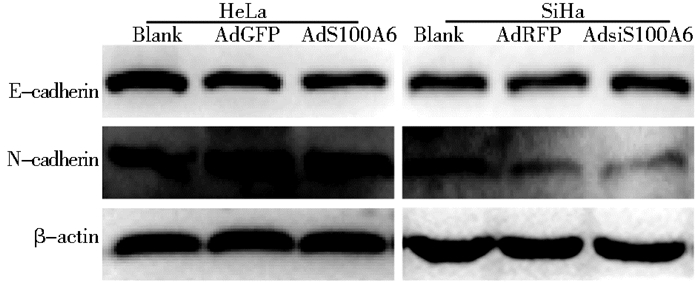
|
| 图 5 上调和下调S100A6对HeLa、SiHa细胞EMT的影响 Figure 5 The effect of S100A6 upregulation and downregulation on EMT of Hela and SiHa cells |
Western blot检测发现:上调HeLa细胞S100A6表达可明显增加p-Akt的蛋白水平,见图 6a;同时,PI3K-Akt信号通路的下游靶基因Snail和Twist的mRNA水平也随之有不同程度升高,见图 6b。提示,上调S100A6可激活PI3K-Akt信号通路。
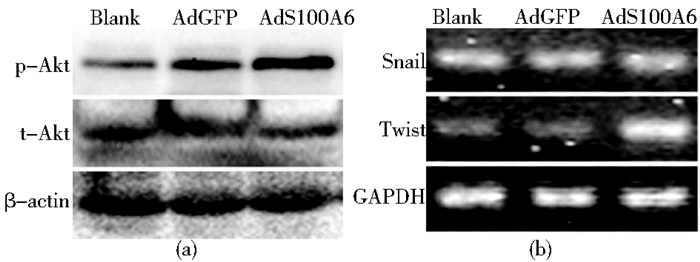
|
| 图 6 上调HeLa中S100A6对PI3K-Akt信号通路的影响 Figure 6 The effects of S100A6 upregulation on PI3K-Akt pathway of HeLa cells (a) Western blot (b) PCR |
宫颈癌是女性最常见的肿瘤,在女性生殖系统肿瘤中占首位。其发病隐匿,发病率和死亡率高,且其发病有年轻化的趋势。细胞学筛查的普及和疫苗的应用提高了宫颈癌的防治水平。但是,宫颈四周毗邻各种器官,极易向周围播散,向前侵及膀胱,向后侵及直肠;同时,宫颈旁淋巴、血管丰富,极易通过淋巴结转移和血行转移,导致其侵袭和转移率高。目前,转移和复发仍成为患者死亡的主要原因[11]。因此,寻找宫颈癌迁移的具体机制、寻找宫颈癌治疗的有效靶点,对提高治疗效果、缓解病人的痛苦具有积极意义。
S100A6作为S100家族成员,参与多种肿瘤的发生发展,可能在肿瘤的发生发展过程中起着重要作用。我们课题组前期研究表明S100A6可以促进结直肠癌细胞[5]、乳腺癌细胞[12]及骨肉瘤细胞[13]的增殖和迁移。本课题采用重组腺病毒感染宫颈癌细胞,发现上调S100A6可以促进宫颈癌细胞的增殖、迁移,而下调S100A6则可抑制其增殖、迁移。提示S100A6具有促进宫颈癌细胞增殖和迁移的作用。
基于S100A6对宫颈癌细胞迁移能力的影响显著,我们检测了与细胞迁移密切相关的EMT标志物,并发现上调S100A6可明显下调上皮标志物E-cadherin和上调间质标志物N-cadherin,而下调S100A6可明显上调E-cadherin、下调N-cadherin。提示S100A6可以促进EMT进程。Ansieau等[14]指出,EMT的诱导导致失巢凋亡抑制,生成侵袭和转移性癌细胞。刘海霞等[15]发现,发生EMT后,癌细胞迁移和入侵,EMT在转移级联中是一个关键的过程。因此,提示S100A6可通过诱导EMT从而促进宫颈癌细胞发生转移。
Grille等[16]发现,在鳞癌细胞系中,Akt的持续性表达能诱导EMT,赋予组织侵袭和转移所需的运动性。这就表明PI3K-Akt通路参与了粘附因子所介导的细胞粘附、运动和侵袭作用。Liangru等[17]也发现,c-Src可以通过PI3K-Akt信号通路诱导EMT,从而促进鼻咽癌的转移。课题组前期研究也发现,S100A6可以通过PI3K/Akt信号通路促进人骨肉瘤细胞143B增殖和迁移[13]。在宫颈癌研究中,谭媛等[10]研究发现S100A6蛋白在宫颈鳞癌组织中的表达明显升高,与宫颈病变恶性程度提高、宫颈鳞癌淋巴结转移呈正相关。Shu等[18]也发现PAK4可以通过PI3K/Akt信号通路赋予宫颈癌更高的恶性程度和顺铂耐药性。因此,我们推测PI3K/Akt信号通路可能也参与介导S100A6促进宫颈癌细胞增殖、迁移的作用。Western blot检测证明,S100A6表达的上调可以明显增加Akt的磷酸化水平。RT-PCR也证实S100A6可以促进其下游靶基因Snail和Twist的表达。该结果与我们的推测相符。
我们的前期研究发现,与S100A6同一家族的S100A9也促进HeLa细胞的增殖、迁移、上皮间质转化[19]。这是否提示该家族成员对宫颈癌的发生发展具有相似的作用,值得深入探讨,以拓展对S100家族成员及其对宫颈癌的作用的认识,为宫颈癌的防治提供更多思路。
总之,S100A6可以促进宫颈癌细胞的增殖、迁移,其机制可能与其诱导EMT和激活PI3K/Akt信号通路有关。本研究为阐明S100A6对宫颈癌的作用和机制积累了实验依据,也为宫颈癌的早期诊断及治疗提供了潜在的新靶点。
| [1] | Zur Hausen H. Papillomaviruses and cancer:from basic studies to clinical application. Nature Reviews Cancer, 2002, 2(5) : 342–350. DOI:10.1038/nrc798 |
| [2] | Das B C, Hussain S, Nasare V, et al. Prospects and prejudices of human papillomavirus vaccines in India. Vaccine, 2008, 26(22) : 2669–2679. DOI:10.1016/j.vaccine.2008.03.056 |
| [3] | Chen H, Xu C, Jin Q, et al. S100 protein family in human cancer. American Journal of Cancer Research, 2014, 4(2) : 89–115. |
| [4] | Heizmann C W, Fritz G, Schafer B W. S100 proteins:structure, functions and pathology. Frontiers in Bioscience, 2002, 7 : 1356–1368. |
| [5] | Duan L, Wu R, Zou Z, et al. S100A6 stimulates proliferation and migration of colorectal carcinoma cells through activation of the MAPK pathways. International Journal of Oncology, 2014, 44(3) : 781–790. |
| [6] | Chen X, Liu X, Lang H, et al. S100 calcium-binding protein A6 promotes epithelial-mesenchymal transition through beta-catenin in pancreatic cancer cell line. PloS One, 2015, 10(3) : e0121319. DOI:10.1371/journal.pone.0121319 |
| [7] | Wang X H, Zhang L H, Zhong X Y, et al. S100A6 overexpression is associated with poor prognosis and is epigenetically up-regulated in gastric cancer. The American Journal of Pathology, 2010, 177(2) : 586–597. DOI:10.2353/ajpath.2010.091217 |
| [8] | Li Z, Tang M, Ling B, et al. Increased expression of S100A6 promotes cell proliferation and migration in human hepatocellular carcinoma. Journal of Molecular Medicine, 2014, 92(3) : 291–303. DOI:10.1007/s00109-013-1104-3 |
| [9] | Li Y, Wagner E R, Yan Z, et al. The Calcium-binding protein S100A6 accelerates human osteosarcoma growth by promoting cell proliferation and inhibiting osteogenic differentiation. Cellular Physiology and Biochemistry:International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2015, 37(6) : 2375–2392. DOI:10.1159/000438591 |
| [10] | 谭媛, 姚德生. S100A6在宫颈癌组织中的表达及其意义. 中国现代医生, 2010, 48(11) : 9–10. Tan Y, Yao D S. Expression and role of A100A6 in cervical cancer. China Mordern Doctor, 2010, 48(11) : 9–10. |
| [11] | Das B C, Tyagi A, Vishnoi K, et al. Cervical cancer stem cells selectively overexpress HPV oncoprotein E6 that controls stemness and self renewal through upregulation of HES1. Clinical Cancer Research, 2016, 22(16) : 4170–4184. DOI:10.1158/1078-0432.CCR-15-2574 |
| [12] | 游莉, 徐兰兰, 郭元元, 等. 重组人S100A6促进人乳腺癌细胞MCF-7的增殖和迁移侵袭并抑制其凋亡. 中国细胞生物学学报, 2011, 33(7) : 746–751. You L, Xu L L, Guo Y Y, et al. Recombinant human S100A6 promotes the proliferation, migration and invasion but inhibits the apoptosis of human breast cancer cell line MCF-7. Chinese Journal of Cell Biology, 2011, 33(7) : 746–751. |
| [13] | 王海燕, 邹正渝, 段亮, 等. S100A6通过PI3K_Akt信号通路促进人骨肉瘤细胞143B增殖和迁移. 中国病理生理杂志, 2013, 29(11) : 1928–1933. Wang H Y, Zou Z Y, Duan L, et al. S100A6 promotes proliferation and migration of human osteosarcoma cell 143B through PI3K/Akt signaling pathway. Chinese Journal of Pathophysiology, 2013, 29(11) : 1928–1933. |
| [14] | Ansieau S, Courtois-Cox S, Morel A P, et al. Failsafe program escape and EMT:a deleterious partnership. Seminars in Cancer Biology, 2011, 21(6) : 392–396. |
| [15] | 刘海霞, 陈必良, 李佳, 等. EMT参与肿瘤侵袭转移的研究进展. 现代生物医学进展, 2014, 14(14) : 2790–2793. Liu H X, Chen B L, Li J, et al. The research progress of EMT in tumor invasion and migration. Progress in Modern Biomedcine, 2014, 14(14) : 2790–2793. |
| [16] | Grille S J, Bellacosa A, Upson J, et al. The protein kinase Akt induces epithelial mesenchymal transition and promotes enhanced motility and invasiveness of squamous cell carcinoma lines. Cancer Research, 2003, 63(9) : 2171–2178. |
| [17] | Liangru Ke, Xiang Yanqun, Guo Xiang. c-Src activation promotes nasopharyngeal carcinoma metastasis by inducing the epithelial-mesenchymal transition via PI3K_Akt signaling pathway——a new and promising target for NPC. Oncotarget, 2016, 7(19) : 28340–28355. |
| [18] | Shu X R, Wu J, Sun H, et al. PAK4 confers the malignance of cervical cancers and contributes to the cisplatin-resistance in cervical cancer cells via PI3K/AKT pathway. Diagnostic Pathology, 2015, 10 : 177. DOI:10.1186/s13000-015-0404-z |
| [19] | 李雪茹, 孙晖, 查何, 等. S100A9对宫颈癌Hela细胞的增殖和迁移的影响及其机制探讨. 中国细胞生物学学报, 2015, 37(12) : 1632–1638. Li X R, Sun H, Zha H, et al. The effects of S100A9 on proliferation and migration of human squamous cervical carcinoma hela cell line and its mechanisms. Chinese Journal of Cell Biology, 2015, 37(12) : 1632–1638. |
 2017, Vol. 37
2017, Vol. 37




