文章信息
- 温杰, 宋琳琳, 张莹, 王荷, 何金生, 洪涛.
- WEN Jie, SONG Lin-lin, ZHANG Ying, WANG He, HE Jin-sheng, HONG Tao.
- 稳定表达Aβ特异性单链抗体的哺乳动物细胞株构建和功能研究
- Construction and Function of Stable Mammalian Cell Lines Expressing the Aβ-specific Single Chain Fragment Variants
- 中国生物工程杂志, 2017, 37(2): 1-7
- China Biotechnology, 2017, 37(2): 1-7
- http://dx.doi.org/DOI:10.13523/j.cb.20170201
-
文章历史
- 收稿日期: 2016-09-05
- 修回日期: 2016-09-24
2. 中国疾病预防控制中心病毒病预防控制所 北京 100052
2. Institute for Viral Disease Control and Prevention, China CDC, Beijing 100052, China
阿尔茨海默病 (Alzheimer’s disease,AD) 是一种常见于老年人的渐进性、难治性的神经退行性疾病[1]。β淀粉样肽 (Amyloid β-peptide,Aβ) 的异常聚集被认为是AD神经毒性的动因,特异性的抗体则有希望从分子和细胞水平调控Aβ代谢[2]。
单链抗体 (single chain fragment variant, scFv) 不含Fc效应区,分子量小,免疫原性低,穿透力强[3],定位迅速,精确区分微小的结构差异[4],易于基因工程制备和改造[5],在AD治疗策略研究中有一定的优势。体外研究证明,单链抗体能够抑制Aβ聚集和阻止Aβ的神经毒性[6-7],体内的实验表明,单链抗体能够改善在体定位注射后的脑淀粉样病变[8]。本研究通过构建真核表达系统获得稳定表达单链抗体的细胞株,得到Aβ特异性单链抗体,有望应用于AD的免疫治疗[9]。
本研究通过优化scFv的构建方式及连接肽 (Linker) 的序列并比较表达产物含量,建立Aβ特异性scFv的哺乳动物细胞表达体系,并筛选构建稳细胞株,同时鉴定其生物学活性,为后续研究和应用提供实验基础。
1 材料与方法 1.1 材料 1.1.1 细胞、载体和宿主菌中国仓鼠卵巢细胞 (CHO) 购自中国医学科学院细胞资源中心,人宫颈癌细胞 (Hela) 和小鼠神经母细胞瘤细胞 (N2a) 购自中国科学院上海生科院细胞资源中心;哺乳动物表达载体pSecTag2/Hygro A为美国Invitrogen公司产品,质粒pET-30α (﹢) 为本实验室保存,pMD-18T载体为TaKaRa公司产品;工程菌株E.coli DH5α为本实验室保存。
1.1.2 工具酶与试剂盒限制性内切酶 (BamH Ⅰ·HF、SalⅠ·HF和XhoⅠ)、蛋白质分子量标准 (Marker) 为美国NEB公司产品;质粒小提试剂盒 (E.Z.N.A.TM Plasmid Mini Kit) 和DNA凝胶回收试剂盒为OMEGA BIO-TEK公司产品;T4 DNA连接酶和Ex Taq®DNA聚合酶 (DNA Polymerase) 为Promega公司产品;dNTP和DNA分子量标准 (DNA Marker) 为日本TaKaRa公司产品;脂质体转染试剂Lipofectamine 2000为Invitrogen公司产品;蛋白浓度测定 (BCA) 试剂盒及化学发光底物 (SuperSignal® West Pico) 为美国Pierce公司产品。DNA合成和测序均由生工生物工程 (上海) 股份有限公司完成。
1.2 方法 1.2.1 单链抗体scFv基因片段的构建基于课题组前期工作建立的单抗A8(鼠源)、其可变区基因以及采用 (G4S)3连接而成的VH-(G4S)3-VL和VL-(G4S)3-VH基因片段,进一步采用p2A[10]作为连接短肽 (linker),利用重叠延伸PCR的方法扩增得到第3种连接形式的scFv基因片段——VL-p2A-VH。根据哺乳动物表达载体pSecTag/HygroA (载体骨架含有myc和His标签) 的多克隆位点,引入酶切位点BamH Ⅰ和Xho Ⅰ。首先分别扩增得到VL-p2A和p2A-VH;然后以第一轮PCR产物互为引物,扩增得到VL-(G4S)3-VH,VH-(G4S)3-VL和VL-p2A-VH。
(1) 引物设计:VL-(G4S)3-VH和VH-(G4S)3-VL的引物见文献[7],VL-p2A-VH的引物分别如下。
VLF 5′-CGCGGATCCACAAGTTACTCTAAAAGAG-3′
VLR 5′-GGGGCCAGGATTCTCTTCAACATCACCGGCTTGTTTAGTAGCTTTCAGCTCCAGCTTGGT-3′
VHF 5′-GCTACTAAACAAGCCGGTGATGTTGAAGAGAATCCTGGCCCCCAAGTTACTCTAAAAGAG-3′
VHR 5′-ATACTCGAGCTGAGGAGACTGTGAGAGT-3′
(2) SOE-PCR拼接及质粒构建:对scFv进行PCR扩增,取等摩尔的第一次PCR产物互为模板和引物,SOE-PCR拼接scFv,分别得到完整的scFv。PCR条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,72℃后延伸10 min,4℃保存。PCR产物用1%琼脂糖凝胶电泳鉴定。
将构建好的单链抗体scFv片段连接至pMD18T,连接产物转化DH5α感受态细胞,挑取单克隆,提取重组质粒,双酶切鉴定,将双酶切鉴定为正确的质粒送生工生物工程 (上海) 股份有限公司测序。
1.2.2 哺乳动物细胞表达及细胞株的建立(1) 抗Aβ单链抗体真核表达载体的构建和鉴定:将1.2.1中测序正确的重组质粒,经1%琼脂糖凝胶电泳分离,用DNA胶回收试剂盒回收纯化。将BamH Ⅰ/Xho Ⅰ双酶切的目的片段,与同样酶切处理的pSecTag/HygroA载体连接。连接产物转化DH5α感受态细胞,挑取单克隆,提取重组质粒pSecTag/HygroA-VL-(G4S)3-VH、pSecTag/HygroA-VH-(G4S)3-VL和pSecTag/HygroA-VL-p2A-VH,双酶切鉴定。用常规的PEG8000沉淀法进行质粒提取,用紫外分光光度计测定质粒浓度。
(2) 确定筛选培养基中潮霉素合适的浓度:分别将Hela细胞和CHO细胞各接种于24孔板培养,待80%汇合时加潮霉素 (hygromycin) 使其浓度分别为100 μg/ml、200 μg/ml、300 μg/ml、400 μg/ml、500 μg/ml、600 μg/ml、700 μg/ml、800 μg/ml、900 μg/ml和1000 μg/ml,置于37℃、5%CO2培养箱中培养10~14天。筛选使细胞死亡的最低药物浓度。
(3) 细胞瞬时转染:按照Invitrogen公司的产品说明书,用lipofectamine 2000转染Hela和CHO细胞,各种质粒量均为10 μg。
(4) Western blot检测scFv的表达情况:取瞬时转染后的细胞培养基上清,约4 ml (含有分泌的单链抗体),加入到超滤管 (Amicon Ultra-4) 中,7 500×g,体积浓缩到400 μl (约10倍),测定蛋白浓度后,按常规方法进行Western blot检测。
(5) 稳定表达单链抗体细胞株的筛选及建立:转染24 h后,按1:10传代,用含有潮霉素 (Hela细胞200 μg/ml;CHO细胞300 μg/ml) 的完全DMEM培养液加压筛选,隔3天换液,持续2周。选择生长状态良好的抗性细胞集落,扩大培养,取上清检测。
(6) 间接ELISA分析单链抗体抗原结合能力:①按照文献[11]的方法,制备Aβ42抗原。②用包被液稀释的Aβ42包被96孔酶标板。常规洗涤、封闭,依次加入倍比稀释的单链抗体 (His标签) 和小鼠抗His单抗 (1:1000)。显色,并用TECON全自动酶标仪检测450 nm吸光值 (A450)。
(7) 斑点印迹 (Dot blot) 分析单链抗体识别抗原的能力:将Aβ42(0.5 mg/ml)、CTFα和CTFβ分别点样2 μl到处理后的NC膜上,设2个重复,室温晾干;常规封闭,依次加入一抗 (单链抗体) 和小鼠抗His单克隆抗体 (1:1 000) 室温孵育,胶片曝光[方法同1.2.2(5)]。
(8) 单链抗体对Aβ42寡聚体细胞毒性的抑制:取70%~80%汇合的N2a细胞3瓶 (T75),分3组:①Aβ-olig组,加入终浓度为10 μmol的Aβ42寡聚体;②scFv中和组,加入单链抗体细胞上清和终浓度10 μmol的Aβ42寡聚体;③scFv对照组,加入单链抗体细胞上清。24 h后,收集细胞,制备电镜样品。
(9) 超薄切片与透射电镜:将收集的细胞常规固定、脱水、包埋、切片并染色。利用透射电镜JEM-1400(JEOL,日本) 在加速电压80 kV,放大倍数为8 000~40 000倍的条件下观察细胞的超微结构改变。
2 结果 2.1 单链抗体scFv片段的拼接前期工作已获得VL-(G4S)3和 (G4S)3-VH,VH-(G4S)3和 (G4S)3-VL[7],用相同的方法,获得VL-p2A和p2A-VH基因片段,如图 1所示,即第一轮产物位于300 bp左右,与预期结果相同。

|
| 图 1 琼脂糖凝胶电泳检测第一轮SOE-PCR产物 Figure 1 The first-step SOE-PCR products analyzed by agarose gel electrophoresis M: DNA standard (DL2000); 1: VL-p2A fragment; 2: p2A-VH fragment |
分别以VL-p2A和p2A-VH互为模板和引物,SOE-PCR拼接得到基因片段VL-p2A-VH,经琼脂糖凝胶电泳检测,如图 2所示,即第二轮PCR产物位于750 bp附近,与预期结果相同,提示scFv基因拼接成功。VL-(G4S)3-VH和VH-(G4S)3-VL同前期实验[7]。

|
| 图 2 琼脂糖凝胶电泳检测第二轮SOE-PCR产物 Figure 2 The second-step SOE-PCR products analyzed by agarose gel electrophoresis M: DNA standard (DL 2000); 1: VL-p2A-VH fragment |
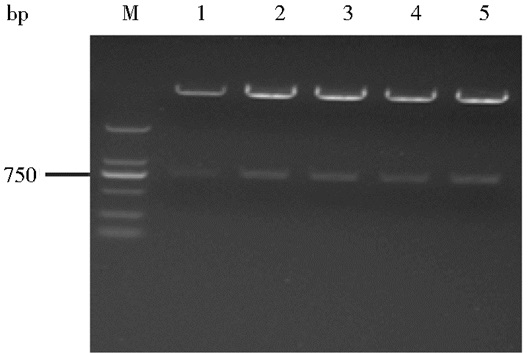
测序正确的scFv片段VL-(G4S)3-VH、VH-(G4S)3-VL和VL-p2A-VH,克隆至真核表达载体pSecTag/HygroA,双酶切 (BamHⅠ/XhoⅠ) 鉴定显示,目的片段大小正确,如图 3、图 4和图 5所示。

|
| 图 3 pSecTag/HygroA-VL-(G4S)3-VH双酶切鉴定 Figure 3 Identification of pSecTag/HygroA-VL-(G4S)3-VH by restriction endonuclease digestion M: DNA standard (DL 2000); 1~6: Products of BamHⅠ/XhoⅠ restriction endonuclease digestion randomly selected |
|
| 图 4 pSecTag/HygroA-VH-(G4S)3-VL双酶切鉴定 Figure 4 Identification of pSecTag/HygroA-VH-(G4S)3-VL by restriction endonuclease digestion M: DNA standard (DL 2000); 1~5: Products of BamHⅠ/XhoⅠ restriction endonuclease digestion randomly selected |

|
| 图 5 pSecTag/HygroA-VL-p2A-VH双酶切鉴定 Figure 5 Identification of pSecTag/HygroA-VL-p2A-VH by restriction endonuclease digestion M: DNA standard (DL 2000); 1~5: Products of BamHⅠ/XhoⅠ restriction endonuclease digestion randomly selected |
选择能在10~14天将CHO或Hela细胞全部杀死的最低浓度作为潮霉素的筛选浓度。最终确定200 μg/ml和300 μg/ml分别为实验中Hela细胞和CHO细胞的压力选择培养基中潮霉素的浓度。
2.2.3 细胞瞬时转染(1) 瞬时转染Hela细胞:首先用VL-(G4S)3-VH转染Hela细胞约48 h后,收集细胞上清,并超滤浓缩后,进行Western blot检测 (同时用转染载体pSecTag/HygroA质粒作为阴性对照;载体试剂盒提供的pSecTag/HygroA-PSA作为蛋白表达的阳性对照,不转染的Hela细胞作为空白对照)。结果如图 6所示,VL-(G4S)3-VH转染的细胞上清浓缩后,在大约30 kDa左右显示出一条特异性条带,与预期的scFv的分子量相符。同样,VH-(G4S)3-VL和VL-p2A-VH转染的细胞上清浓缩后,在同样位置出现条带 (结果未显示),表明正确表达了相应的单链抗体。

|
| 图 6 Western blot鉴定瞬时转染Hela细胞分泌的scFv [VL-(G4S)3-VH] Figure 6 Western blot analysis of scFv VL-(G4S)3-VH secreted by transient transfected Hela cells 1: Cytoplasm protein of PSA positive control; 2: Cell supernatant of PSA positive control; 3:Cytoplasm protein of VL-(G4S)3-VH from transient transfected Hela cells; 4: Supernatant of VL-(G4S)3-VH from transient transfected Hela cells; 5: Cytoplasm protein of vector-transfected cells; 6: Supernatant of vector-transfected cells; 7: Supernatant of Hela cell control |
(2) 瞬时转染CHO细胞:分别用VL-(G4S)3-VH,VH-(G4S)3-VL和VL-p2A-VH转染CHO细胞约48 h后,收集细胞上清 (未浓缩),进行Western blot检测,如图 7所示,分别在大约30 kDa左右显示出一条特异性条带,表明转染成功,正确表达了单链抗体。以上结果提示,瞬时转染CHO细胞scFv的表达量比Hela细胞较高 (转染CHO细胞后未浓缩的上清液能检测到目的蛋白的条带,而转染Hela细胞后,细胞上清则需要浓缩处理才能检测到目的条带)。

|
| 图 7 Western blot鉴定瞬时转染CHO细胞分泌的scFv (未浓缩的细胞上清) Figure 7 Western blot analysis of scFvs produced by transient transfected CHO cells (supernatants without concentration treatment) 1: VL-(G4S)3-VH transient transfected; 2: VH-(G4S)3-VL transient transfected; 3: VL-p2A-VH transient transfected; 4: Supernatant of CHO control cells; 5: Supernatant of PSA transient transfected control |
经潮霉素筛选,分别获得抗性细胞单克隆 (图 8)。将单克隆传代并扩大培养,从而获得稳定表达抗Aβ的scFv的细胞株。

|
| 图 8 经潮霉素筛选后获得细胞的单克隆 Figure 8 Mono-clones were formed by hygromycin B screening (a) Mono-clones of Hela cells (b) Monoclones of CHO cells |
为了分析稳定表达的单链抗体的抗原识别能力,通过间接ELISA检测其对Aβ抗原的识别情况,以单克隆抗体A8作为阳性对照。结果显示,稳定细胞株表达的scFv能够识别Aβ抗原,但是A450值偏低,表明其表达量需要进一步提高 (表 1)。
| 表达scFv的细胞上清 | A450(Aβ抗原) | ||
| 1 | 2 | 平均值 | |
| VL-(G4S)3-VH-Hela | 0.486 | 0.586 | 0.536 |
| VH-(G4S)3-VL-Hela | 0.497 | 0.463 | 0.480 |
| VL-p2A-VH-Hela | 1.122 | 1.151 | 1.137 |
| VL-(G4S)3-VH-CHO | 0.434 | 0.573 | 0.504 |
| VH-(G4S)3-VL-CHO | 0.361 | 0.239 | 0.300 |
| 阳性对照 (A8单抗) | 2.238 | 2.330 | 2.077 |
| 空白对照 | 0.069 | 0.064 | 0.067 |
| 阴性对照 | 0.102 | 0.099 | 0.101 |
2.3.2 斑点印迹分析单链抗体识别抗原的能力
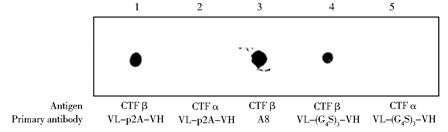
斑点印迹分析结果显示,如图 9所示,Hela-VL-p2A-VH细胞株和CHO-VL-(G4S)3-VH细胞株能够识别Aβ42抗原。同样,识别CTFβ而不识别CTFα,如图 10显示。提示,A8来源的scFv具有和A8相同的抗原识别力。

|
| 图 9 斑点印迹检测scFv与Aβ42的特异性 Figure 9 Identification of Aβ oligomers by different scFvs via dot blot 1: Not concentrate supernatant of VL-p2A-VH; 2: Concentrate supernatant of VL-p2A-VH; 3: Negative control of nomal cells supernatant; 4: Positive control of A8 monoclonal antibody; 5: Not concentrate supernatant of VL-(G4S)3-VH; 6: Concentrate supernatant of VL-(G4S)3-VH |
|
| 图 10 斑点印迹检测scFv与CTFβ和CTFα的特异性 Figure 10 Identification of CTF β and CTFα by different scFvs via dot blot 1~2: Concentrate supernatant of VL-p2A-VH; 3: Positive control of A8 monoclonal antibody; 4~5: Concentrate supernatant of VL-(G4S)3-VH |
为了从亚细胞水平研究所得scFv对Aβ寡聚体细胞毒性的抑制作用,利用透射电镜分析了Aβ-olig以及scFv等各处理组细胞的超微结构改变,结果如下:(1) Aβ-olig组,细胞核变形,染色质边集,有明显的凋亡的特征,见图 11A(箭头所示);有单层膜的吞噬小体出现,细胞核异常,见图 11B(三角和箭头所示);线粒体变形肿胀,见图 11C(虚线箭头所示)。(2) scFv中和组,细胞核形态正常,染色质分布均匀,见图 11D;核糖体分布正常,见图 11E。(3) scFv对照组细胞形态未见明显异常,见图 11F。

|
| 图 11 透射电镜观察scFv中和Aβ寡聚体引起N2a细胞超微病理改变 Figure 11 Ultrastructural changes of N2a cells treated with scFv to neutralize Aβ oligomers A~C: Aβ oligomers group; D~E: scFv neutralized group; F: scFv control group |
本实验通过使用不同形式的连接肽[Linker,(G4S)3和p2A]成功构建了单链抗体VL-(G4S)3-VH、VH-(G4S)3-VL和VL-p2A-VH。在此基础上获得了稳定表达单链抗体的细胞株Hela-VL-p2A-VH和CHO-VL-(G4S)3-VH,生物学功能研究表明,所得单链抗体具有抗原识别能力,并且可以阻断Aβ寡聚体的细胞毒性。
从单链抗体的构建方式看,影响其表达量、构象和功能的因素有以下两点:(1) VH和VL的顺序:研究表明,单链抗体VH和VL的排列方式对其表达量和活性有非常重要的影响,VH-Linker-VL和VL-Linker-VH连接方式在抗原结合活性和表达量方面有很大区别[12]。(2) 弹性短肽 (Linker):设计理想的Linker需保证VH和VL在表达系统中等摩尔产生,不干扰VH和VL自由折叠,使抗原结合位点处于适当的构型,不引起分子动力学的改变,尽可能减少蛋白酶的攻击及防止scFv的聚集等条件[13]。本实验除了常用的 (G4S)3,还选择了一段真核细胞依赖的短肽p2A序列作为Linker,构建了VL-p2A-VH单链抗体。p2A序列是一段真核细胞依赖的具有自我剪切功能的p2A肽 (ATKQAGDVEENPGP)。其切割机制还不是很清楚,最可能的机制是p2A肽破坏正常肽键的形成,但允许翻译继续。理论上p2A的切割功能破坏正常肽键的形成,使其分泌表达的单链抗体被剪切为VH和VL,但Western blot结果表明其分子量仍大约在30kDa左右 (图 7),p2A如何决定scFv空间结构和表达量,有待进一步的实验证实和研究。
同时,细胞株的种类影响单链抗体的表达。在scFv构建方式相同的条件下,本研究中未经浓缩的CHO细胞上清中很容易检测到scFv目的条带,而Hela细胞上清则需要浓缩后才可以检测到scFv条带,提示所用CHO细胞的scFv表达量应当高于Hela细胞 (图 6和图 7)。
然而,scFv的活性则是其构建方式、连接肽组成以及受体细胞株选择等多种因素综合作用的结果。间接ELISA结果表明,同样是VL-VH的构建方式,当连接肽为p2A时,所得scFv的抗原识别能力较高。如表 1所示,在检测抗原结合能力时,VL-p2A-VH-Hela表达的scFv测得的A450数值,是VL-(G4S)3-VH-Hela或VL-(G4S)3-VH-CHO组数值的2倍左右。
细胞功能保护实验表明本研究获得的抗Aβ scFv能够阻断和抑制Aβ寡聚体对细胞的毒性,在AD治疗研究方面将有独特的作用。本研究也为抗Aβ scFv制备的进一步优化提供了实验基础。
| [1] | Tam J H, Pasternak S H. Amyloid and Alzheimer's disease:inside and out. Can J Neurol Sci, 2012, 39(3) : 286–298. DOI:10.1017/S0317167100013408 |
| [2] | Bayer A J, Bullock R, Jones R W, et al. Evaluation of the safety and immunogenicity of synthetic Abeta42 (AN1792) in patients with AD. Neurology, 2005, 64(1) : 94–101. DOI:10.1212/01.WNL.0000148604.77591.67 |
| [3] | Fernandez-Funez P, Zhang Y, Sanchez-Garcia J, et al. Anti-Abeta single-chain variable fragment antibodies exert synergistic neuroprotective activities in Drosophila models of Alzheimer's disease. Hum Mol Genet, 2015, 24(21) : 6093–6105. DOI:10.1093/hmg/ddv321 |
| [4] | Droste P, Frenzel A, Steinwand M, et al. Structural differences of amyloid-beta fibrils revealed by antibodies from phage display. BMC Biotechnol, 2015, 15 : 57. DOI:10.1186/s12896-015-0146-8 |
| [5] | Kamynina A V, Holmström K M, Koroev D O, et al. Acetylcholine and antibodies against the acetylcholine receptor protect neurons and astrocytes against beta-amyloid toxicity. Int J Biochem Cell Biol, 2013, 45(4) : 899–907. DOI:10.1016/j.biocel.2013.01.011 |
| [6] | Zhao M, Wang S W, Wang Y J, et al. Pan-amyloid oligomer specific scFv antibody attenuates memory deficits and brain amyloid burden in mice with Alzheimer's disease. Curr Alzheimer Res, 2014, 11(1) : 69–78. DOI:10.2174/15672050113106660176 |
| [7] | Zhang Y, Yang H Q, Fang F, et al. Single chain variable fragment against abeta expressed in baculovirus inhibits abeta fibril elongation and promotes its disaggregation. PLoS One, 2015, 10(4) : e0124736. DOI:10.1371/journal.pone.0124736 |
| [8] | Meli G, Visintin M, Cannistraci I, et al. Direct in vivo intracellular selection of conformation-sensitive antibody domains targeting Alzheimer's amyloid-beta oligomers. J Mol Biol, 2009, 387(3) : 584–606. DOI:10.1016/j.jmb.2009.01.061 |
| [9] | Marin-Argany M, Rivera-Hernández G, Martí J, et al. An anti-Abeta (amyloid beta) single-chain variable fragment prevents amyloid fibril formation and cytotoxicity by withdrawing Abeta oligomers from the amyloid pathway. Biochem J, 2011, 437(1) : 25–34. DOI:10.1042/BJ20101712 |
| [10] | Kim J H, Lee S R, Li L H, et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PLoS One, 2011, 6(4) : e18556. DOI:10.1371/journal.pone.0018556 |
| [11] | Zhang H, Darvell B W. Morphology and structural characteristics of hydroxyapatite whiskers:effect of the initial Ca concentration, Ca/P ratio and pH. Acta Biomater, 2011, 7(7) : 2960–2968. DOI:10.1016/j.actbio.2011.03.020 |
| [12] | Medecigo M, Manoutcharian K, Vasilevko V, et al. Novel amyloid-beta specific scFv and VH antibody fragments from human and mouse phage display antibody libraries. J Neuroimmunol, 2010, 223(1-2) : 104–114. DOI:10.1016/j.jneuroim.2010.03.023 |
| [13] | Zameer A, Kasturirangan S, Emadi S, et al. Anti-oligomeric Abeta single-chain variable domain antibody blocks Abeta-induced toxicity against human neuroblastoma cells. J Mol Biol, 2008, 384(4) : 917–928. DOI:10.1016/j.jmb.2008.09.068 |
 2017, Vol. 37
2017, Vol. 37




