文章信息
- 张中素, 杨瑞刚, 朱凌云, 吴小敏.
- ZHANG Zhong-su, YANG Rui-gang, ZHU Ling-yun, WU Xiao-min.
- 提高微生物合成萜类化合物产量的策略
- Strategies for Improving The Yield of Microbial Terpenoids Production
- 中国生物工程杂志, 2017, 37(1): 97-103
- China Biotechnology, 2017, 37(1): 97-103
- http://dx.doi.org/DOI:10.13523/j.cb.20170114
-
文章历史
- 收稿日期: 2016-09-27
- 修回日期: 2016-11-26
萜类化合物也称为类异戊二烯化合物,是以异戊二烯为基本单元的一大类结构迥异的天然化合物,包括单萜、倍半萜、二萜、多萜等。萜类化合物广泛分布在古细菌、细菌、真核生物体内,已发现的萜类化合物超过55 000种[1]。种类繁多的萜类化合物结构各异,功能多样,如类固醇可作为激素信号[2]、类胡萝卜素在植物光合作用中可作为抗氧化剂[3]、醌类可用于电子运输[4]等。其中许多萜类化合物极具药用价值,如青蒿素被用于治疗疟疾,紫杉醇被用于治疗癌症等。萜类化合物还可用作调味品、香料及生物燃料[5-6]。目前萜类的生产主要从植物中提取或化学法合成。从植物中提取依赖于植物栽培,植物生产周期长,萜类含量低,产量难以提高[7]。化学合成法依赖于石油原料,生产过程易对环境造成污染[8]。以上两种方法不利于萜类化合物大规模生产。采用微生物合成技术生产萜类化合物易人为控制,且微生物生长繁殖迅速,不受场地、季节和气候等因素的限制,因此,采用微生物生产萜类化合物最有可能实现大规模生产,已成为当下各国研究者关注的热点。
尽管萜类化合物结构和功能各异,但这类化合物都源自于C5前体化合物异戊烯焦磷酸酯(isopentenyl pyrophosphate,IPP)和二甲基丙烯焦磷酸酯(3,3-dimetytlallypyrophosphate,DMAPP)[9]。DMAPP与一个或多个IPP缩合,可生成异戊烯基二磷酸前体化合物,如焦磷酸香叶酯(geranyl pyrophosphate,GPP)、法尼基焦磷酸(farnesyl pyrophosphate,FPP)、香叶基焦磷酸(geranylgeranyl diphosphate,GGPP)等。这些骨架通过一系列环化、甲基化、乙酰化、重排等反应进而生成各种萜类化合物终产物。目前研究表明,IPP和DMAPP这两种代谢前体分子在生物体可通过两种途径来合成(图 1) ,其中一条代谢途径是甲羟戊酸(mevalonate,MVA)途径;另一条代谢途径是赤藓醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径,也称为脱氧木酮糖(1-deoxy-D-xylulose-5-phosphate,DXP)途径。MVA途径最早被人们所认识,1958年Conrad Bloch和Feodor Lynen在动物和酵母中发现MVA途径的存在[10]。1993年,研究者在微生物中发现了MEP途径[11]。现已证实MEP途径存在于原核生物中。此外,绿藻和高等植物的叶绿体中也存在MEP途径[12]。
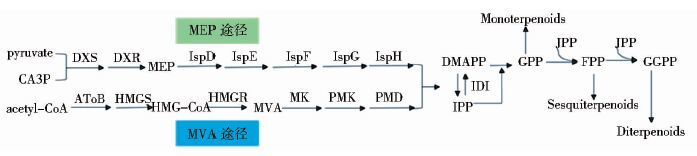
|
| 图 1 萜类化合物合成途径 Figure 1 Biosynthesis of terpenoids DXS:1-deoxy-D-xylulose-5-phosphate synthase;DXR:1-deoxy-D-xylulose-5-phosphate reductoisomerase;IspD:2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase;IspE:4-diphosphocytidyl-2-C-methyl-D-erythritol kinase;IspF:2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase;IspG:(E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase;IspH:4-hydroxy-3-methylbut-2-en-1-yl diphosphate reductase;atoB:Acetyl-CoA C-acetyltransferase;HMGS:Hydroxymethylglutaryl-CoA synthase;HMGR:Hydroxymethylglutaryl-CoA reductase;MK:Mevalonate kinase;PMK:Phosphomevalonate kinase;PMD:Diphosphomevalonate decarboxylase;IDI:Isopentenyl-diphosphate delta-isomeras |
基于对萜类代谢途径的认识,人们利用基因工程、代谢工程和合成生物学手段,通过微生物生产萜类化合物已经取得了很大的进步,并在医药、能源、生物材料等领域展现出了广泛的应用前景。最为成功地是抗疟疾药物青蒿素的前体产物青蒿酸已在酿酒酵母中实现生物合成,堪称该领域的里程碑[13],对应的萜烯紫穗槐二烯在酵母中的产量高达40g/L[14],目前已经实现了工业化生产。其他多种萜类化合物也已实现了在微生物中的生产,但产量较低,如蒎烯也可在大肠杆菌中合成,经过短短几年的研究,产量已从5mg/L提高到了140mg/L[15-17]。但若要以蒎烯为原料实现高能化合物蒎烯二聚体的大量生产,当前产量远远达不到要求。如何提高萜类化合物的产量已成为当前各国科学家关注的热点。本文总结了近些年研究者提高萜类化合物产量所用到的方法和策略,旨在为萜类化合物在微生物中的生产与研究提供参考和借鉴。
1 筛选高活性萜烯合酶萜烯合酶(terpene synthase,TPS)的活性是萜类化合物生物合成过程中非常重要的一个因素。不同物种来源的萜烯合酶在底盘微生物中表现出不同的活性。Sarria等[15]在大肠杆菌中分别表达了来源于3种不同物种(A. grandis、P. abies、P.taeda)的蒎烯合酶基因,其中来源于A. grandis的蒎烯活性最高,对应的蒎烯产量也最高。Beekwilder等[18]发现了一种新的来源于C. nootkatensis的瓦伦烯合酶CnVS,将瓦伦烯合酶Citru VS在不同的微生物中进行异源表达,并与常见的瓦伦烯合酶Citru VS的活性进行比较,发现在光合细菌Rhodobacter sphaeroides中异源表达CnVS,瓦伦烯产量比表达Citru VS提高了20多倍,未经过通路优化的光合细菌中产量由2.5mg/L提高到57.5mg/L,异源表达MEV途径时产量由24.9mg/L提高到352mg/L。在未经过通路优化的Saccharomyces cerevisiae中异源表达CnVS,瓦伦烯产量达1.36mg/L,而表达Citru VS时,瓦伦烯产量仅为2μg/L。由此可见,获得高活性的萜烯合酶可以极大提高萜类化合物的产量。
萜烯合酶的表达活性一方面取决于其蛋白质结构,另一方面取决于其自身的催化特性。由于表达的大部分萜烯合酶基因来自于植物,其N端有针对通过叶绿体质体的转运肽,在原核生物中进行表达时,这种转运肽会引起蛋白质不溶导致蛋白质凝聚或形成包涵体,因此,在原核生物中表达萜烯合酶,必须要去除N端转运肽,研究显示,去除柠檬烯合酶的转运肽后,柠檬烯在酵母中的产量提高了4~8倍[19]。此外,为了提高萜烯合酶活性,研究者通过定点诱变技术(site-directed mutagenesis)或随机突变的“定向进化”(directed enzymes evolution)技术提高其催化活性。Tashiro等[16]利用错配PCR制造蒎烯合酶突变基因,并设计了高通量筛选系统来筛选消耗较多GPP的突变株,获得新的蒎烯合酶的活性优于野生型蒎烯合酶。在E.coli中,新获得的蒎烯合酶与MEV途径中相关酶及GPPS共表达,蒎烯产量达到140mg/L,提高了4倍。
提高萜烯合酶活性在一定程度上可提高萜类化合物产量,但前体化合物IPP和DMAPP的供应同样重要。研究表明,大多数植物来源的TPS的Kcat值较低,米氏常数Km值较高,往往在μmol/L数量级,少数TPS的Km值甚至在mmol/L数量级,如异戊二烯合酶[20-22],这意味着异戊二烯合成速率严重依赖于前体化合物的浓度。基于质粒的E.coli表达系统比整合到基因组中的蓝藻表达系统具有更高的基因拷贝数,因而产生更多的IPP和DMAPP,事实表明,E.coli中的异戊二烯产量远远高于蓝藻细胞的[22-23]。因此,合成高产量的萜类化合物必须要保证高通量的前体化合物IPP和DMAPP的供应。
2 增加前体供应目前主要通过改造和调控微生物内源代谢途径或者引入异源代谢途径来提高前体化合物的供应。
2.1 改造和调控微生物内源代谢途径 2.1.1 改造和调控微生物内源萜类代谢途径增加前体化合物供应的一个策略是改造和调控微生物内源代谢途径,提高限速酶的表达量。对于MVA途径,已发现羟甲基戊二酸单酰辅酶A还原酶(HMGR)是限速酶,Keasling团队在酵母中过表达截短的tHMGR使紫穗槐二烯产量提高了近5倍[8]。
对于MEP途径,DXS、DXR、IDI被认为是该途径的限速酶,在过去的十几年里,研究者通过过表达DXS、DXR或IDI等限速酶基因,成功提高了代谢前体化合物量,进而提高了目标产物产量[24-26]。例如,Matthew和Wurtzed[27]在大肠杆菌中过表达DXS,使类胡萝卜素产量提高了10.8倍。使用多拷贝质粒来过表达限速酶基因往往对细菌产生代谢负担,且质粒不稳定,容易丢失,而对基因组中基因进行直接调控则可避免这些问题。Yuan等[28]将染色体中DXP途径相关基因的天然启动子换成强启动子T5,构建了工程菌E. coli PT5-dxs PT5-ispDispF PT5-idi PT5-ispB,其β-胡萝卜产量达6mg/gDW。
2.1.2 改造和调控微生物乙酰CoA或丙酮酸代谢途径由于IPP和DMAPP是通过MVA途径或MEP途径来合成,理论上增加MVA途径或MEP途径的前体化合物的供应也可以提高IPP和DAMPP的产量。对于MVA途径,乙酰CoA是直接前体分子,Chen等[29]深入研究了乙酰CoA在酿酒酵母S. cerevisiae中的代谢过程,乙酰CoA在细胞核、细胞质、线粒体和过氧化物酶体中均有产生,但只有细胞质中的乙酰CoA可用于合成萜类化合物,对此,研究者提出了pull-push-block策略以提高细胞质中乙酰CoA含量,即过表达内源乙醇脱氢酶Adh2、乙醛脱氢酶Ald6,以及表达来源于肠道沙门氏菌Salmonella enterica的乙酰CoA合酶的突变体[30],从而丙酮酸可有效地转化成乙酰CoA,最终使倍半萜烯紫穗槐二烯的产量得到了明显地提高[31]。在此方法的基础上,敲除消耗乙酰CoA的反应,如过氧化物酶体柠檬酸合酶Cit2或者细胞质内的苹果酸合酶MIs1,α-檀香萜烯产量达8.29mg/L,较原始菌株提高了4倍[30]。利用上述改造过的微生物生产由乙酰CoA衍生的产品,如正丁醇和聚β-羟基丁酸酯,其产量分别提高到16.3mg/L和250mg/L,较原始菌株分别提高6.5倍和18倍[32-33]。然而,以上方法严重依赖丙酮酸脱氢酶(PDH)旁路途径,该途径需要消耗大量ATP。有研究将乙酰CoA合成酶换成乙酰乙醛脱氢酶或丙酮酸甲酸裂解酶,消耗较少的ATP,从而提高了萜类化合物产量[34]。对于MEP途径,前体分子是丙酮酸和3-磷酸甘油醛(G3P),两者的比例是影响依赖MEP途径的细胞生产萜类化合物的一个重要因素。丙酮酸更多地转化为G3P可提高番茄红素的产量[35]。
2.2 引入异源代谢途径除了改造微生物内源代谢途径外,目前最常用的策略是表达多个异源蛋白或者整体引入异源代谢途径来增加IPP和DMAPP的供应量,这样做的好处是异源代谢途径不受细菌内源性调控,从而可以减少耗损。Martin等[36]首次将来源于S. cerevisiae的MVA途径全部引入E.coli中,使最终紫穗槐二烯产量提高6.5倍,达112.2mg/L。
虽然表达异源代谢途径可有效提高前体化合物量,但由于微生物缺乏对异源代谢途径的调控,可能引起代谢通量的不平衡,积累对细胞有毒害的中间产物,由此带来一些负面影响。在大肠杆菌中异源表达MVA途径,中间产物3-羟-3-甲戊二酰辅酶A(HMG-CoA)积累后对细胞产生毒害作用,抑制细菌生长,当过表达tHMGR后,HMG-CoA消耗速率增加,细菌生长速率恢复到与野生型细菌相当水平[37]。由此可见,要进一步提高萜类化合物产量,还需调节各基因表达水平以平衡代谢通量。
3 调节代谢通量研究者通过调节关键酶基因表达水平,构建融合蛋白、蛋白质支架,以及采用动态调节型启动子等方法来平衡代谢通量。
3.1 调节关键酶基因表达水平涉及多个酶参与的代谢途径,各个酶的表达水平的平衡至关重要。研究者通过平衡代谢途径上游和下游酶的表达水平成功地提高了紫衫二烯和紫杉二烯-5α-醇的产量[24]。该方法以IPP和DMAPP为节点将紫衫二烯代谢途径分为两个模块,天然的上游MEP途径中4个关键酶基因(dxs、ispd、ispF和idi)为一个模块,下游萜烯形成途径中的GGPP合酶基因和紫衫二烯合酶基因为另一个模块。通过使用不同强弱的启动子及不同拷贝数质粒优化上游和下游基因表达水平,最终可获得1g/L的紫衫二烯,比优化前提高了15 000倍。该方法在提高其他不同类型的产物量中也有应用,如丹参酮二烯[38]、脂肪酸[39]、松属素[40]。
3.2 融合表达关键酶受天然代谢通路中常见的共区域化现象的启发,研究人员尝试用各种方法将异源酶系在胞内聚集,以提高酶以及相关代谢物的局部浓度,从而进一步提高目的产物的产量,减少代谢体系的串扰。
其中将代谢途径中的两个酶进行融合表达是最直接最常见的方法。Zhou等[38]发现,融合二萜合酶SmCPS和SmKSL,以及融合BTS1(GGPP合酶)和erg20(FPP合酶),可显著提高丹参酮二烯产量和降低副产物的积累。将异戊二烯合酶(IspS)与IDI进行融合后,在蓝藻中异戊二烯产量提高了3.3倍,摇瓶培养条件下达3.3mg/L[41]。Sarria等[15]将来源于P. abies、A. grandis和P. taeda的GPPS和PS分别进行蛋白质融合,构建了9个蛋白质融合,表达其中5个融合蛋白可显著提高蒎烯产量,最高可提高52%。然而,将来源于P. taeda的GPPS和PS进行融合后产量与共表达时相比略有下降,这可能是因为蛋白质融合影响了酶的空间结构进而使酶活降低,故这一技术的应用往往局限于2~3个酶的融合。
3.3 引入生物支架生物分子支架体系在解决融合蛋白的局限性上展现出了巨大潜力和发展价值,应用生物分子支架将酶局限在胞内狭小的区域,可在局部提高酶以及代谢产物的浓度,减少了代谢中间产物的损失浪费,有利于酶促反应代谢通量的最大化。生物分子支架体系中最具代表性的是基于蛋白质的支架体系、基于核酸的支架体系和基于微室(microcompartment)的支架体系。Dueber等[42]在大肠杆菌中构建了以GBD、SH3和PDZ蛋白为基础的支架,在以上支架上连接AToB、HGMS和HMGR(MEV途径中的三个酶)等酶,可拉近这三个酶在空间上的距离,通过改变支架个数优化酶的表达量,结果表明,AToB、HMGS、HMGR以1:2:2比例组合,可将甲羟戊酸滴度提高77倍,达5mmol/L。类似地,基于DNA的锌指结构域支架与相应的合酶(AToB、HGMS和HMGR)结合,通过优化支架设计可将甲羟戊酸产量提高3倍[43]。基于RNA的适体和配体可高效结合,在相关领域得到了广泛的应用。2011年,Delebecque和Aldaye[44]利用RNA支架在胞内成功将氢酶和铁氧还原蛋白联合产氢的速率提高了50倍。但目前,未见RNA支架用于萜类化合物生产的相关报道。此外,代谢微室也可集中产物和酶,减少有毒中间产物的扩散。Farhi等[45]将信号肽与萜烯合酶融合,使萜烯合酶在线粒体FPP池中表达,瓦伦烯产量提高了3倍,结合其他方法,如在酵母菌中表达截短的HMG1和线粒体靶向的FPP合酶(FDPS)基因,瓦伦烯和紫穗槐二烯分别提高8倍(1.5mg/L)和20倍(20mg/L)。
3.4 动态调控代谢途径对于大多数异源代谢途径,可通过改变启动子强度[46-47]、改变mRNA的稳定性[48]或核糖体结合强度[49]等方法调节基因表达强度。然而微生物生长和环境条件随时会发生变化,而以上特定调节方法却不能随之改变,因此通过感应环境及生长的变化来动态调控代谢途径显得尤为重要。通过动态调控,可减少代谢中间产物的积累,减少额外的蛋白质生产,减轻对昂贵的诱导剂的需求。
基于RNA的适配子或者转录因子可结合中间产物或终产物,通过感应代谢产物的浓度来精确调节转录和翻译。目前一个基于天然代谢感应蛋白的动态感应调控系统已经用于生产脂肪酸衍生物和燃料[50]。该系统应用基于RNA的转录因子结合重要的中间代谢产物,通过感应代谢产物浓度来调节转录和翻译,从而动态调控目的基因表达,将产量提高到理论产量的28%,同时还提高了菌株的稳定性。
生物传感器的应用在动态调控细胞代谢途径中显现出巨大的潜力,但由于许多代谢物的感应器还未发现,该方法在提高萜类化合物合成方面的应用较少。Robert等[51]另辟蹊径,通过转录组学方法,发现对积累的有毒代谢产物有响应的启动子,他们利用这些启动子来调控中间代谢产物FPP的生产,在不使用诱导剂的情况下,对FPP的生产进行动态调控,将目的产物紫穗槐二烯的产量提高至1.6g/L。动态控制系统的发展依赖于更加稳定的遗传通路,以便遗传通路的功能在菌种中更好地保存,同时要求传感和驱动的动态反应足够快,以便有效的响应代谢的变化。
4 其他方法除上述常用策略以外,还有很多可用于提高萜类化合物产量的方法。抑制竞争代谢途径是常用方法之一,如鲨烯合酶和紫穗槐二烯合酶竞争性地利用FPP,则可通过抑制鲨烯合酶的表达,提高紫穗槐二烯的产量[52]。微生物的培养过程及条件同样重要,由于部分萜类物质,如单萜对细胞有毒害作用,在培养基上层加入有机相,可将有毒的萜类化合物萃取到有机相中,减少对细菌的毒害。例如,生产过程中加入邻苯二甲酸丁二酯作为溶剂后,柠檬烯的最小抑菌浓度与不加有机溶剂的系统相比提高700倍(42g/L柠檬烯)[53]。使用不同宿主生产也会对目标化合物产量有影响,对于含氧的植物萜类,由于大肠杆菌表达植物P450单加氧酶的局限性,包括缺乏电子传递链和跨膜区翻译不相容等,造成P450的活性较低,青蒿酸在E.coli中的产量为105mg/L[54],而相应酵母青蒿酸产量高达25g/L[13]。因此,我们需要根据不同的生产需要及目的产物,选择合适的底盘生物及合适的策略。
5 讨论纵观近20年来萜类化合物在微生物中的合成研究,上述用于提高萜类化合物微生物合成产量的诸多策略中,筛选高活性的萜烯合酶虽至关重要,但往往筛选难度较大,且微生物本身内源前体合成通量很低,仅异源表达萜烯合酶进行生产远远满足不了工业化需求。目前主要研究工作集中在改造微生物代谢途径以增加前体化合物的供应,这往往可有效提高萜类化合物产量。改造微生物代谢途径可能会造成代谢流的不平衡,因此需监控代谢途径中是否有中间产物的积累,通过调节各蛋白质的表达水平可有效平衡代谢通量,而融合表达关键酶最为常见且简单易行,但局限于二酶的融合,生物支架方法可调节多个酶的相对表达量,但操作较为复杂因此应用较少。涉及采用不同启动子、RBS等组合策略调控多个酶的表达较为有效但工作量很大,动态调控的发展仍有赖于生物传感器的发现。上述各方法并不是完全独立的,研究者往往会采用多种方法(如增加前体化合物产量并融合表达关键酶)对底盘微生物进行改造,以获得目的萜类化合物高产的平台菌株。
6 展望合成生物学和代谢工程的发展推动了萜类化合物在微生物中的生产,与萜类化合物相关的研究成果也逐年递增。结构复杂的萜类化合物,如紫杉二烯-5α-醇、青蒿酸等在细菌或酵母细胞平台中的成功合成,显示出微生物合成萜类化合物潜能。目前已发现的超过55 000种萜类化合物中,能在微生物中合成的只是冰山一角,许多萜类化合物合酶亟待发掘。异源合成萜类化合物需要打破细胞原有的复杂代谢网络,而我们对如何保持细胞内的代谢平衡,如何调控新的代谢网络以达到最优产量知之甚少,这是目前限制萜类化合物产量的一个很重要的原因。此外,一些重要萜类化合物前体物在微生物中产量虽高,如紫杉醇和青蒿素,但其下游终产物产量仍然较低甚至无法合成,其中的原因和相关机制仍需要深入研究。相关技术和方法的发展,必将促进生产萜类化合物的细胞工厂的发展。
| [1] | Breitmaier E. Terpenes:Flavors, Fragrances, Pharmaca, Pheromones. New Jersey: Wiley-VCH, 2006. |
| [2] | Nemere I, Pietras R J, Blackmore P F. Membrane receptors for steroid hormones:signal transduction and physiological significance. Journal of Cellular Biochemistry, 2003, 88(3) : 438–445. DOI:10.1002/(ISSN)1097-4644 |
| [3] | Howitt C A, Pogson B J. Carotenoid accumulation and function in seeds and non-green tissues. Plant Cell & Environment, 2006, 29(3) : 435–445. |
| [4] | Berry S. The chemical basis of membrane bioenergetics. Journal of Molecular Evolution, 2002, 54(5) : 595–613. DOI:10.1007/s00239-001-0056-3 |
| [5] | Tippmann S, Chen Y, Siewers V, et al. From flavors and pharmaceuticals to advanced biofuels:Production of isoprenoids in Saccharomyces cerevisiae. Biotechnology Journal, 2013, 8(12) : 1435–1444. DOI:10.1002/biot.201300028 |
| [6] | Chang M C, Keasling J D. Production of isoprenoid pharmaceuticals by engineered microbes. Nature Chemical Biology, 2006, 2(12) : 674–681. DOI:10.1038/nchembio836 |
| [7] | 杨金玲, 高丽丽, 朱平. 人参皂苷生物合成研究进展. 药学学报, 2013, 48(2) : 170–178. Yang J L, Gao L L, Zhu P. Advances in the biosynthesis research of ginsenosides. Acta Pharmaceutica Sinica, 2013, 48(2) : 170–178. |
| [8] | Keasling J D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering, 2012, 14(3) : 189–195. DOI:10.1016/j.ymben.2012.01.004 |
| [9] | Ajikumar P K, Tyo K, Carlsen S, et al. Terpenoids:opportunities for biosynthesis of natural product drugs using engineered microorganisms. Molecular Pharmaceutics, 2008, 5(2) : 167–190. DOI:10.1021/mp700151b |
| [10] | Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria:a novel pathway for the early steps leading to isopentenyl diphosphate. Biochemical Journal, 1993, 295(Pt 2)(1):517-524. |
| [11] | Lichtenthaler H K. Non-mevalonate isoprenoid biosynthesis:enzymes, genes and inhibitors. Biochemical Society Transactions, 2000, 28(6) : 785–789. DOI:10.1042/bst0280785 |
| [12] | Kuzuyama T. Mevalonate and nonmevalonate pathways for the biosynthesis of isoprene units. Bioscience Biotechnology & Biochemistry, 2002, 66(8) : 1619–1627. |
| [13] | Paddon C J, Westfall P J, Pitera D J, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446) : 528–532. DOI:10.1038/nature12051 |
| [14] | Westfall P J, Pitera D J, Lenihan J R, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proceedings of the National Academy of Sciences, 2012, 109(3) : E111–E118. DOI:10.1073/pnas.1110740109 |
| [15] | Sarria S, Wong B, García M H, et al. Microbial synthesis of pinene. Acs Synthetic Biology, 2014, 3(7) : 466–475. DOI:10.1021/sb4001382 |
| [16] | Tashiro M, Kiyota H, Kawainoma S, et al. Bacterial production of pinene by a laboratory-evolved pinene-synthase. Acs Synthetic Biology, 2016. |
| [17] | Yang J, Nie Q, Ren M, et al. Metabolic engineering of Escherichia coli for the biosynthesis of alpha-pinene. Biotechnology for Biofuels, 2013, 6(1) : 1–10. DOI:10.1186/1754-6834-6-1 |
| [18] | Beekwilder J, Houwelingen A V, Cankar K, et al. Valencene synthase from the heartwood of Nootka cypress (Callitropsis nootkatensis) for biotechnological production of valencene. Plant Biotechnology Journal, 2014, 12(2) : 174–182. DOI:10.1111/pbi.12124 |
| [19] | Jongedijk E, Cankar K, Ranzijn J, et al. Capturing of the monoterpene olefin limonene produced in Saccharomyces cerevisiae. Yeast, 2014, 32(1) : 159–171. |
| [20] | Sasaki K, Ohara K, Yazaki K. Gene expression and characterization of isoprene synthase from Populus alba. Febs Letters, 2005, 579(11) : 2514–2518. DOI:10.1016/j.febslet.2005.03.066 |
| [21] | Schnitzler J, Zimmer I, Bachl A, et al. Biochemical properties of isoprene synthase in poplar (Populus x canescens). Planta, 2005, 222(5) : 777–786. DOI:10.1007/s00425-005-0022-1 |
| [22] | Zurbriggen A, Kirst H, Melis A. Isoprene production via the mevalonic acid pathway in Escherichia coli (Bacteria). Bioenergy Research, 2012, 5(4) : 814–828. DOI:10.1007/s12155-012-9192-4 |
| [23] | Fiona, Bentley, Andreas, et al. Heterologous expression of the mevalonic acid pathway in cyanobacteria enhances endogenous carbon partitioning to isoprene. Molecular Plant, 2014, 7(1) : 71–86. DOI:10.1093/mp/sst134 |
| [24] | Ajikumar P K, Xiao W H, Tyo K E J, et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000) : 70–74. DOI:10.1126/science.1191652 |
| [25] | Lv X, Xu H, Yu H. Significantly enhanced production of isoprene by ordered coexpression of genes dxs, dxr, and idi in Escherichia coli. Applied Microbiology & Biotechnology, 2013, 97(6) : 2357–2365. |
| [26] | Kim S W, Keasling J D. Metabolic engineering of the nonmevalonate isopentenyl diphosphate synthesis pathway in Escherichia coli enhances lycopene production. Biotechnology & Bioengineering, 2001, 72(4) : 408–415. |
| [27] | Matthews P D, Wurtzel E T. Metabolic engineering of carotenoid accumulation in Escherichia coli by modulation of the isoprenoid precursor pool with expression of deoxyxylulose phosphate synthase. Applied Microbiology & Biotechnology, 2000, 53(4) : 396–400. |
| [28] | Yuan L Z, Rouvière P E, Larossa R A, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E. coli. Metabolic Engineering, 2006, 8(1):79-90. |
| [29] | Chen Y, Siewers V, Nielsen J. Profiling of cytosolic and peroxisomal acetyl-CoA metabolism in Saccharomyces cerevisiae. PLoS One, 2012, 7(8) : 599–602. |
| [30] | Yun C, Daviet L, Schalk M, et al. Establishing a platform cell factory through engineering of yeast acetyl-CoA metabolism. Metabolic Engineering, 2013, 15(1) : 48–54. |
| [31] | Shiba Y, Paradise E M, Kirby J, et al. Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae for high-level production of isoprenoids. Metabolic Engineering, 2007, 9(2) : 160–168. DOI:10.1016/j.ymben.2006.10.005 |
| [32] | Krivoruchko A, Serrano-Amatriain C, Yun C, et al. Improving biobutanol production in engineered Saccharomyces cerevisiae by manipulation of acetyl-CoA metabolism. Journal of Industrial Microbiology & Biotechnology, 2013, 40(9) : 1051–1056. |
| [33] | Kocharin K, Yun C, Siewers V, et al. Engineering of acetyl-CoA metabolism for the improved production of polyhydroxybutyrate in Saccharomyces cerevisiae. Amb Express, 2012, 2(1) : 1–11. DOI:10.1186/2191-0855-2-1 |
| [34] | Kozak B U, Rossum H M V, Benjamin K R, et al. Replacement of the Saccharomyces cerevisiae acetyl-CoA synthetases by alternative pathways for cytosolic acetyl-CoA synthesis. Metabolic Engineering, 2014, 21(1) : 46–59. |
| [35] | Farmer W R, Liao J C. Precursor balancing for metabolic engineering of lycopene production in Escherichia coli. Biotechnology Progress, 2001, 17(1) : 57–61. DOI:10.1021/bp000137t |
| [36] | Martin V J J, Pitera D J, Withers S T, et al. Engineering a mevalonate pathway in Escherichia coli forproduction of terpenoids. Nature Biotechnology, 2003, 21(7) : 796–802. DOI:10.1038/nbt833 |
| [37] | Pitera D J, Paddon C J, Newman J D, et al. Balancing a heterologous mevalonate pathway for improved isoprenoid production in Escherichia coli. Metabolic Engineering, 2007, 9(2) : 193–207. DOI:10.1016/j.ymben.2006.11.002 |
| [38] | Zhou Y J, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. Journal of the American Chemical Society, 2012, 134(6) : 3234–3241. DOI:10.1021/ja2114486 |
| [39] | Xu P, Gu Q, Wang W, et al. Modular optimization of multi-gene pathways for fatty acids production in E. coli. Nature Communications, 2013, 4(1):273-275. |
| [40] | Wu J, Du G, Zhou J, et al. Metabolic engineering of Escherichia coli for (2S)-pinocembrin production from glucose by a modular metabolic strategy. Metabolic Engineering, 2013, 16(1) : 48–55. |
| [41] | Gao X, Gao F, Liu D, et al. Engineering the methylerythritol phosphate pathway in cyanobacteria for photosynthetic isoprene production from CO2. Energy & Environmental Science, 2016, 9(4) : 1400–1411. |
| [42] | Dueber J E, Wu G C, Malmirchegini G R, et al. Synthetic protein scaffolds provide modular control over metabolic flux. Nature Biotechnology, 2009, 27(8) : 753–759. DOI:10.1038/nbt.1557 |
| [43] | Conrado R J, Wu G C, Boock J T, et al. DNA-guided assembly of biosynthetic pathways promotes improved catalytic efficiency. Nucleic Acids Research, 2012, 40(4) : 1879–1889. DOI:10.1093/nar/gkr888 |
| [44] | Delebecque C J, Aldaye F A. Organization of intracellular reactions with rationally designed RNA assemblies. Science, 2011, 333(6041) : 470–474. DOI:10.1126/science.1206938 |
| [45] | Farhi M, Marhevka E, Masci T, et al. Harnessing yeast subcellular compartments for the production of plant terpenoids. Metabolic Engineering, 2011, 13(5) : 474–481. DOI:10.1016/j.ymben.2011.05.001 |
| [46] | Hammer K, Mijakovic I, Jensen P R. Synthetic promoter libraries-tuning of gene expression. Trends in Biotechnology, 2006, 24(2) : 53–55. DOI:10.1016/j.tibtech.2005.12.003 |
| [47] | Miksch G, Bettenworth F K, Flaschel E, et al. Libraries of synthetic stationary-phase and stress promoters as a tool for fine-tuning of expression of recombinant proteins in Escherichia coli. Journal of Biotechnology, 2005, 120(1) : 25–37. DOI:10.1016/j.jbiotec.2005.04.027 |
| [48] | Smolke C D, Martin V J J, Keasling J D. Controlling the metabolic flux through the carotenoid pathway using directed mRNA processing and stabilization. Metabolic Engineering, 2001, 3(4) : 313–321. DOI:10.1006/mben.2001.0194 |
| [49] | Salis H M, Mirsky E A, Voigt C A. Automated design of synthetic ribosome binding sites to control protein expression. Nature Biotechnology, 2009, 27(10) : 946–950. DOI:10.1038/nbt.1568 |
| [50] | Zhang F, Carothers J M, Keasling J D. Design of a dynamic sensor-regulator system for production of chemicals and fuels derived from fatty acids. Nature Biotechnology, 2012, 30(4) : 354–359. DOI:10.1038/nbt.2149 |
| [51] | Robert H D, Zhang F I, Alonsogutierrez J, et al. Engineering dynamic pathway regulation using stress-response promoters. Nature Biotechnology, 2013, 31(11) : 1039–1046. DOI:10.1038/nbt.2689 |
| [52] | Asadollahi M A, Maury J, K M, et al. Production of plant sesquiterpenes in Saccharomyces cerevisiae:Effect of ERG9 repression on sesquiterpene biosynthesis. Biotechnology & Bioengineering, 2008, 99(3) : 666–677. |
| [53] | Brennan T C R, Turner C D, Kr mer J O, et al. Alleviating monoterpene toxicity using a two-phase extractive fermentation for the bioproduction of jet fuel mixtures in Saccharomyces cerevisiae. Biotechnology & Bioengineering, 2012, 109(10) : 2513–2522. |
| [54] | Chang M C, Eachus R A, Trieu W, et al. Engineering Escherichia coli for production of functionalized terpenoids using plant P450s. Nature Chemical Biology, 2007, 3(5) : 274–277. DOI:10.1038/nchembio875 |
 2017, Vol. 37
2017, Vol. 37




