文章信息
- 卓丽霞, 王莹, 张春萍, 段静, 张亚妮.
- ZHUO Li-xia, WANG Ying, ZHANG Chun-ping, DUAN Jing, ZHANG Ya-ni.
- α-溶血素的表达及其纳米孔的制备
- The Expression of α-Hemolysin and the Preparation of Its Nanopore
- 中国生物工程杂志, 2017, 37(1): 53-57
- China Biotechnology, 2017, 37(1): 53-57
- http://dx.doi.org/DOI:10.13523/j.cb.20170108
-
文章历史
- 收稿日期: 2016-08-23
- 修回日期: 2016-09-06
2. 西北大学化学与材料科学学院 西安 710069
2. College of Chemistry & Mateirals Secience, Northwest University, Xi'an 710069, China
纳米孔单分子检测技术是一种新兴的单分子分析技术,融合了生物技术、纳米技术和单分子技术的优势,在单分子化学反应、蛋白质结构检测以及高通量DNA测序等领域有着广阔的应用前景。其工作原理是在纳米孔两端施加外源电场后,溶液中的离子或分子在电场驱动下通过纳米孔时造成不同程度的孔道阻塞,引起纳米孔电流的微弱变化(皮安级)。利用膜片钳系统监测、放大、转化这种微电流的变化,并根据电流的振幅、阻滞时间、事件频率判断溶液中待测物的浓度大小、结构特征。α-溶血素(α-hemolysin,αHL)纳米孔是众多生物纳米孔中结构组成相对简单且研究比较详细的一种,也是应用最广泛的蛋白纳米孔。αHL是金黄色葡萄球菌(Staphylococcus aureus)分泌的一种水溶性毒素,分子质量为33.2kDa[1],可在磷脂双分子层膜上自组装成一个蘑菇形的七聚体跨膜通道,其14 股反平行β片层构成一个纳米管[2-3]。该纳米孔最窄处约为1.4nm,允许3kDa以下大小的分子通过,是理想的纳米检测器件[4-9]。基于该纳米孔,牛津大学的Hagan Bayley和剑桥大学的Branton提出了纳米孔DNA测序及1 000美元人类基因组测序计划,将纳米孔单分子检测技术推向了研究热潮。另外,αHL也是研究膜孔蛋白组装机制、结构和功能的优秀模型[2]。
目前,用于构筑纳米孔的αHL蛋白主要采用无细胞蛋白质表达系统,体外转录与翻译(in vitro transcription and translation,IVTT)[10-11],或从S. aureus中分离得到,花费较高,产量有限,极大限制了αHL纳米孔的应用。在本研究中,我们利用大肠杆菌BL21(DE3)pLysS 成功高表达αHL及突变体M113C,并用超滤膜分子截留法简单快速纯化蛋白质,获得活性保持良好的单体蛋白,大大简化了αHL制备方法。利用兔血红细胞膜将单体蛋白组装成七聚体纳米孔,并证明纳米孔能够插入人工双脂膜进行单分子分析。该研究为大量制备野生型及αHL位点突变型纳米孔提供了可靠方法,可进一步推动其在单分子分析或其它方面的研究。
1 材料与方法 1.1 材 料DH5α、BL21(DE3)pLys、S. aureus(Wood 46)、质粒提取试剂盒购自宝生物工程有限公司;TMuta-directTM基因定点突变试剂盒购自北京赛百盛基因技术有限公司;蛋白质Marker购自Promega公司;超滤离心管购自Millipore公司;膜片钳放大器(Axopatch 200B)购自Axon公司,并配套1440数字转换器及其软件pClamp 10。
1.2 方 法 1.2.1 蛋白质表达质粒的构建野生型αHL基因的克隆以S. aureus基因组为模板,以αHL FWD(5′-GTCCGCTCATATGGCAGATTCTGAT-3′)(斜体为NdeI 酶切位点)和αHLREV(5′-CATTTCTGAAGCTTTCGGGCTAAAG-3′)(斜体为HindIII酶切位点)为引物,扩增αHL基因。αHL基因重组至pT7质粒,命名为pT7-αHL。
突变体M113C基因以pT7-αHL质粒为模板,利用特异性引物进行定点突变,按照TMuta-directTM基因定点突变试剂盒操作步骤进行。M113C突变引物为M113C FWD(5′-CGATTGATACAAAAGAGTATTGCAGTACTTTAACTTATGGATTC- 3′)和M113C REV(5′- GAATCCATAAGTTAAAGTACTGCAATACTCTTTTGTATCAATCG-3′),斜体为突变位点(ATG→TGC)。突变后的重组质粒进行测序验证(上海生工生物工程有限公司),命名为pT7-M113C。
1.2.2 单体蛋白的表达pT7-αHL和pT7-M113C分别转化至BL21(DE3)pLysS后,接种单克隆菌株于5ml LB培养基,含氨苄青霉素(ampicillin,Amp)100μg/ml、氯霉素(chloramphenicol,Cm)34μg/ml,37℃过夜培养。过夜培养物按1%转接到含Amp和Cm的新鲜LB液体培养基中,37℃扩增培养,3h后加终浓度为0.6mmol/L的IPTG。30℃诱导8h,12%SDS-PAGE分析蛋白质表达情况。4℃ 5 500r/min离心收集细胞。
用细胞裂解液[50mmol/L Tris-HC1、50mmol/L EDTA,1% (V/V) Triton X-100,1mg/ml溶菌酶,pH8.0]重悬细胞,置于冰上,期间间断使用涡旋振荡器剧烈振荡,直至细胞完全裂解。4℃ 13 400g离心40min,收集细胞裂解上清液。12% SDS-PAGE分析。
1.2.3 单体蛋白的纯化采用超滤膜分子质量截留纯化蛋白质,方法如下:将细胞裂解上清液加入截留分子质量为50kDa的超滤管,5 000g离心10min;取下层液体加入截留分子质量为30kDa的超滤管,5 000g离心10min,取上层液体,即为较纯净的αHL单体蛋白溶液。12% SDS-PAGE分析。
1.2.4 蛋白质定量参照王多宁微盘比色法测定蛋白质含量[12],以牛血清白蛋白(BSA)为标准蛋白质。在96孔板中分别加入BSA(0.5mg/ml)标准液1.25μl、2.50μl、3.75μl、5.00μl、6.25μl、7.50μl、8.75μl,用生理盐水补充到10μl,同时做空白对照。每孔混匀后分别加CBB显色液200μl,测OD600,制作标准曲线。以同样方法测αHL单体OD600值,并根据标准曲线计算蛋白质浓度。
1.2.5 溶血活性分析取新鲜兔血100ml,加等体积阿氏液,3 500g常温条件下离心10min,弃上清液和上清液下的白细胞、血小板层。将沉淀用10倍体积的PBS (pH7.4)缓冲溶液洗涤,4℃ 5 000g,离心15min。重复洗涤3次后离心收集并得到离心管下层紧密的兔血红细胞,用MBSA缓冲液(10mmol/L NaMOPS、150mmol/L NaCl、1mg/ml BSA,pH7.4)洗涤并配制成1%(m/V)的红细胞溶液。
取5μl单体蛋白(浓度为0.2mg/ml)和95μl MBSA缓冲液充分混和,在96孔板上用MBSA进行双倍稀释,每孔最后体积为50μl,然后每孔加50μl 1%的兔血红细胞,37℃条件下,用多功能酶标仪测OD595,间隔时间为1min。以纯净水为空白对照。
1.2.6 七聚体纳米孔的制备用预冷的 0.01mol/L Tris-HCl(pH7.4)裂解兔血红细胞,离心收集沉淀即得到细胞膜,并用MBSA溶液配制成0.5%(m/V)的细胞膜混合液。取200μl αHL单体,加入1ml的兔血红细胞膜,混匀,37℃水浴3h。4℃、13 400g离心15min,沉淀用MBSA洗涤2次[10],加入1×loading buffer样品缓冲液,不要煮沸直接进行8%的SDS-PAGE电泳,用切胶法纯化七聚体蛋白。具体方法如下:将电泳完毕的凝胶1/5切下,放入考马斯亮蓝G250染色液中染色,另外4/5胶用保鲜膜封好存于4℃。将染好的凝胶放入脱色液中脱色,直至目的蛋白质条带清晰可见。将此胶与未染色的凝胶对比,以购买的αHL七聚体蛋白(Sigma公司)为标准对照,兔血红细胞膜为阴性对照,用锋利刀片切下目的蛋白条带,加入少量无菌水,捣碎胶条,-80℃反复冻融,析出蛋白质,离心收集液体即为七聚体蛋白液。
1.2.7 单通道电流记录将预先打好小孔的Teflon膜装在电解槽中央,隔电解槽为两室,并加入2ml 1mol/L KCl,10mmol/L Tris-HCl(pH 8.0)缓冲溶液,采用Montal-Mueller法在小孔处形成磷脂双层膜,Ag/AgCl电极检测跨膜电势[13]。在电解池顺式边,加浓度为0.2~2.0ng/ml的αHL七聚体,待单通道形成后使用Axopatch 200B采集和分析αHL纳米孔电流信号。
2 结果与分析 2.1 αHL单体的表达重组质粒转化至BL21(DE3)pLysS细菌中,用IPTG诱导蛋白质表达。收集菌体裂解上清液进行SDS-PAGE分析,与未诱导组对照,αHL在BL21(DE3)pLysS中成功表达[图 1(a)]。为进一步研究诱导时间对目的蛋白含量的影响,对不同诱导时间的菌液进行了电泳分析。如图 1(b)所示,诱导8h后菌液中目的蛋白含量最高,因此选择8h作为最佳诱导时间。
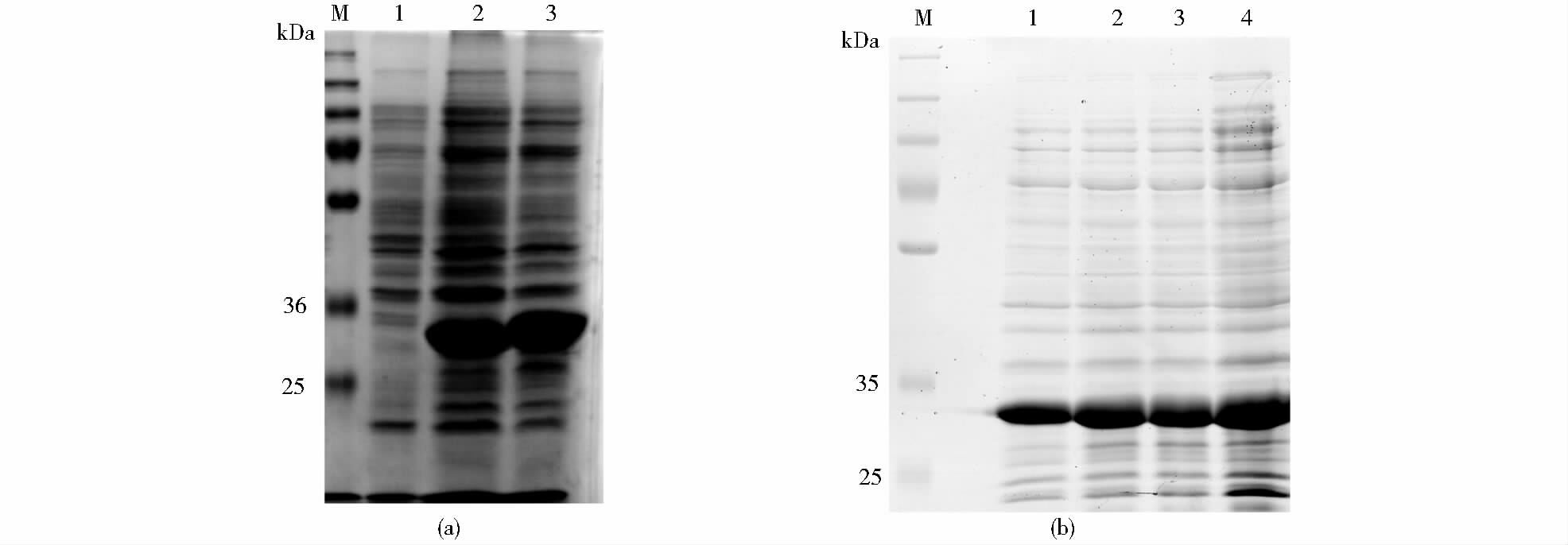
|
| 图 1 αHL的诱导表达及诱导时间对表达量的影响 Figure 1 Overexpression and effect of different time of inducing on the production of αHL (a) Overexpression of monomer in BL21(DE3)pLysS M: Marker; 1: Not induction; 2: M1C (b)The effect of different time of inducing on the production of αHL M: Marker; 1,2,3,4 was induced 2h,4h,6h,8h respectively |
为了保持良好的野生型αHL蛋白活性及自组装能力,在本研究中表达α-溶血素时未加任何表达标签,目的表达蛋白分子质量应为33.24kDa。采用超滤膜分子质量截留法纯化蛋白质,用50kDa和30kDa超滤离心管截留掉杂蛋白,留下相对纯净的目的蛋白,结果如图 2所示。对纯化后的单体进行定量,蛋白质浓度为0.67mg/ml左右。用兔血红细胞进一步对单体蛋白进行溶血活性分析,结果发现113位突变体溶血活性未受影响,野生型αHL和M113C蛋白活性保持良好。以αHL单体为例,进行浓度梯度稀释后的溶血分析(图 3),半数溶血值(HC50)为30ng/ml,说明单体在兔血红细胞膜上打孔能力良好。
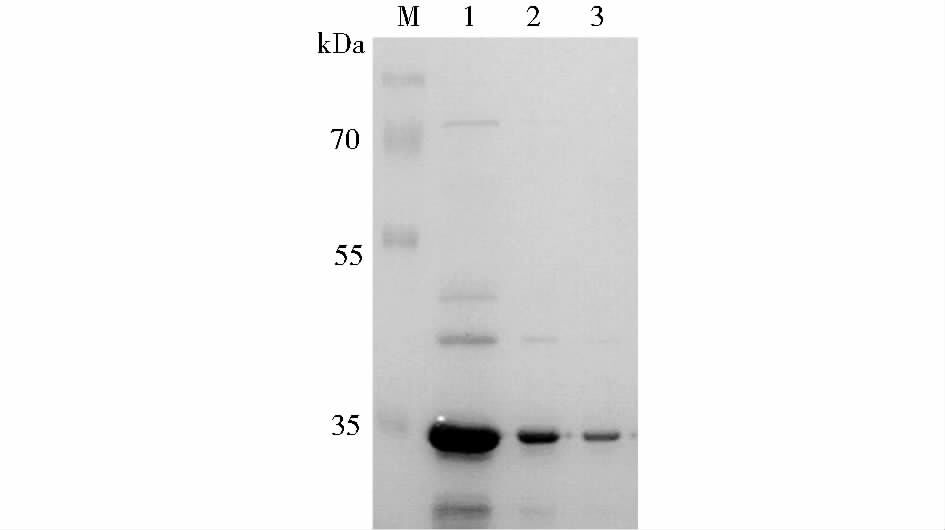
|
| 图 2 αHL蛋白单体纯化蛋白电泳图 Figure 2 SDS-PAGE of purified αHL M: Marker; 2: Purified αHL; 3: Purified M113C |
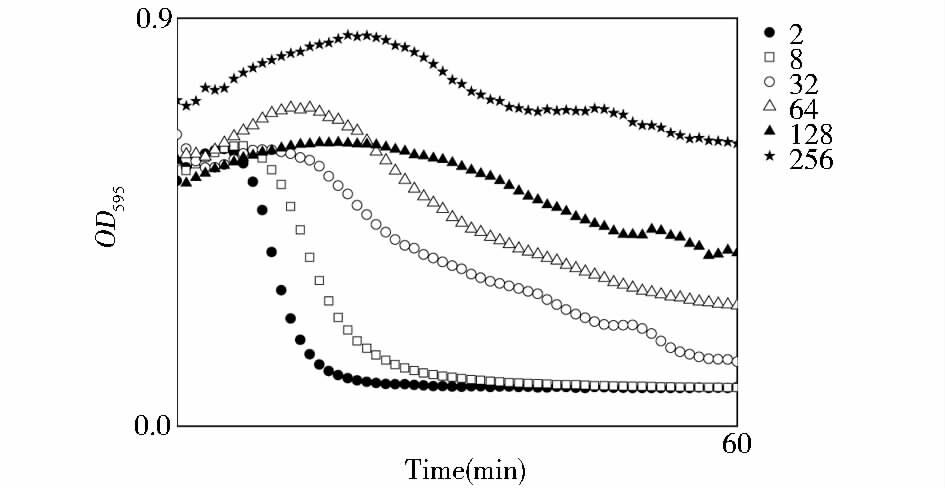
|
| 图 3 αHL单体蛋白稀释不同浓度后的溶血活性分析 Figure 3 Hemolytic activity of αHL at different diluted concentration The first concentration of αHL was 0.67mg/ml,it was diluted to 2,8,32,64,128,256.The hemolysis was measured by assaying the OD595 at 1min interval |
研究了单体浓度和细胞膜比例以及聚合时间对七聚体产量的影响。实验结果表明,单体浓度和细胞膜浓度为4∶1时,聚合反应时间为3h时,单体聚合效率最高。单体在兔红细胞膜上进行组装后,将获得的七聚体通过7%的SDS-PAGE凝胶电泳分离,切取目的条带,经过反复冻融后析出蛋白质,并用真空冷冻干燥进行浓缩。从图 4可看出,通过此方法可获得较纯净、浓度较高的七聚体。

|
| 图 4 αHL在兔血红细胞膜上形成的七聚体 Figure 4 αHL protein forms heptameric nanopore on rabbit red blood cell memberanes M: Marker; 1.2: αHL heptameric |
室温条件下用磷脂双分子层膜验证αHL纳米孔自组装形成跨膜通道的功能,根据纳米单通道电流变化分析其理化性质。在1mol/L KCL 10mmol/L Tris-HCl(pH 7.4)缓冲液中,单通道可持续数小时。图 5记录了αHL纳米孔单通道的电流。改变电压大小,蛋白质通道电流值发生变化。电压值为+40mV时,αHL纳米孔通道电流为(29±2)pA,+60mV时蛋白质通道电流为(41±1)pA。通过本实验方法制备出的αHL七聚体可成功用于在磷脂双分子层膜上打孔。

|
| 图 5 αHL七聚体在磷脂双分子层膜上打孔后的单通道电流 Figure 5 Single channel current flowing through pore formed by αHL in planar lipid bilayers |
在临床诊断、环境监测、食品工业、防恐、医学研究等方面,蛋白纳米孔得到了高度重视和广泛应用。其相比较于固态纳米孔而言,更容易进行分子设计、化学或生物修饰,控制分子的配位和选择性,制造出一系列化学、物理性质丰富的纳米孔[14]。αHL纳米孔目前在单分子检测方面发展十分迅速,前景诱人,但是,它的应用还存在诸多限制条件。野生型αHL是一个开放性、非选择性的通道,怎样解决检测分析的特异性、灵敏性、稳定性和重现性,是αHL单分子检测中亟待解决的难题。根据αHL分子结构或原子图谱,利用基因工程法、化学目标修饰法在不同部位进行修饰,可设计并制造出理想的、具有各种性能的蛋白质纳米管[15-19]。如果对αHL纳米孔进行半胱氨酸定点取代,结合化学修饰,将极大的扩展蛋白纳米孔的选择专一性。 在本研究中,我们利用大肠杆菌高表达αHL及113位点的半胱氨酸突变体,并制备出可用于单分子分析的纳米器件。采用超滤膜分子截留法纯化蛋白质,是本研究的创新之一,该方法简单、快速、能够最大限度保持蛋白活性。利用单通道电流对制备的七聚体纳米孔进行检测,发现结构稳定,离子通透性良好,且有较低的噪声,已用于本实验室中其他单分子检测实验。该研究为进一步拓展αHL纳米孔的应用和功能集成化组装,为开发更加灵敏高效的单分子检测器提供前提和基础。
| [1] | Gray G S, Kehoe M. Primary sequence of the alpha-toxin gene from Staphylococcus aureus wood 46. Infection and Immunity , 1984, 46 (2) : 615–618. |
| [2] | Tobkes N, Wallace B A, Bayley H. Secondary structure and assembly mechanism of an oligomeric channel protein. Biochemistry , 1985, 24 (8) : 1915–1920. DOI:10.1021/bi00329a017 |
| [3] | Song L, Hobaugh M R, Shustak C, et al. Structure of staphylococcal alpha-hemolysin, a heptameric transmembrane pore. Science , 1996, 274 (5294) : 1859–1866. DOI:10.1126/science.274.5294.1859 |
| [4] | Branton D, Deamer D W, Marziali A, et al. The potential and challenges of nanopore sequencing. Nat Biotechnol , 2008, 26 (10) : 1146–1153. DOI:10.1038/nbt.1495 |
| [5] | Kang X F, Cheley S, Rice-Ficht A C, et al. A storable encapsulated bilayer chip containing a single protein nanopore. J Am Chem Soc , 2007, 129 (15) : 4701–4705. DOI:10.1021/ja068654g |
| [6] | Ayub M, Bayley H. Individual RNA base recognition in immobilized oligonucleotides using a protein nanopore. Nano Lett , 2012, 12 (11) : 5637–5643. DOI:10.1021/nl3027873 |
| [7] | Bond P J, Guy A T, Heron A J, et al. Molecular dynamics simulations of DNA within a nanopore:arginine-phosphate tethering and a binding/sliding mechanism for translocation. Biochemistry , 2010, 50 (18) : 3777–3783. |
| [8] | Cracknell J A, Japrung D, Bayley H. Translocating kilobase RNA through the staphylococcal alpha-hemolysin nanopore. Nano Lett , 2013, 13 (6) : 2500–2505. DOI:10.1021/nl400560r |
| [9] | Yao F, Duan J, Wang Y, et al. Nanopore single-molecule analysis of DNA-doxorubicin interactions. Anal Chem , 2015, 87 (1) : 338–342. DOI:10.1021/ac503926g |
| [10] | Cheley S, Braha O, Lu X, et al. A functional protein pore with a "retro" transmembrane domain. Protein Sci , 1999, 8 (6) : 1257–1267. DOI:10.1110/(ISSN)1469-896X |
| [11] | Japrung D, Henricus M, Li Q, et al. Urea facilitates the translocation of single-stranded DNA and RNA through the alpha-hemolysin nanopore. Biophys J , 2010, 98 (9) : 1856–1863. DOI:10.1016/j.bpj.2009.12.4333 |
| [12] | 王多宁, 赵雁武, 田芙蓉. 考马斯亮蓝微盘比色法测定蛋白质含量. 第四军医大学学报 , 2001, 22 (6) : 528–529. Wang D N, Zhao Y W, Tian F R. Protein quantif ication with coomassie bull iant blue microplate-colormetric. J Fourth Mil Med Univ , 2001, 22 (6) : 528–529. |
| [13] | Rotem D, Jayasinghe L, Salichou M, et al. Protein detection by nanopores equipped with aptamers. J Am Chem Soc , 2012, 134 (5) : 2781–2787. DOI:10.1021/ja2105653 |
| [14] | Bayley H. Designed membrane channels and pores. Curr Opin Biotechnol , 1999, 10 (1) : 94–103. DOI:10.1016/S0958-1669(99)80017-2 |
| [15] | Gu L Q, Dalla Serra M, Vincent J B, et al. Reversal of charge selectivity in transmembrane protein pores by using noncovalent molecular adapters. Proc Natl Acad Sci USA , 2000, 97 (8) : 3959–3964. DOI:10.1073/pnas.97.8.3959 |
| [16] | Boersma A J, Brain K L, Bayley H. Real-time stochastic detection of multiple neurotransmitters with a protein nanopore. ACS Nano , 2012, 6 (6) : 5304–5308. DOI:10.1021/nn301125y |
| [17] | Gu L Q, Cheley S, Bayley H. Prolonged residence time of a noncovalent molecular adapter, beta-cyclodextrin, within the lumen of mutant alpha-hemolysin pores. J Gen Physiol , 2001, 118 (5) : 481–494. DOI:10.1085/jgp.118.5.481 |
| [18] | Hammerstein A F, Jayasinghe L, Bayley H. Subunit dimers of alpha-hemolysin expand the engineering toolbox for protein nanopores. J Biol Chem , 2011, 286 (16) : 14324–14334. DOI:10.1074/jbc.M111.218164 |
| [19] | Mantri S, Sapra K T, Cheley S, et al. An engineered dimeric protein pore that spans adjacent lipid bilayers. Nature Communications , 2013, 4 (2) : 216–219. |
 2017, Vol. 37
2017, Vol. 37




