文章信息
- 王利群, 鲁洪中, 储炬, 王永红.
- WANG Li-qun, LU Hong-zhong, CHU Ju, WANG Yong-hong.
- 不同培养方式下dCO2对黑曲霉发酵产糖化酶的影响
- Dissolved Carbon Dioxide Effects on Glucoamylase Synthesis of Aspergillus niger in Batch and Chemostat Cultures
- 中国生物工程杂志, 2017, 37(1): 27-37
- China Biotechnology, 2017, 37(1): 27-37
- http://dx.doi.org/DOI:10.13523/j.cb.20170105
-
文章历史
- 收稿日期: 2016-10-25
- 修回日期: 2016-11-12
黑曲霉是重要的工业微生物,在工业酶制剂、有机酸发酵等方面应用广泛。黑曲霉还具有出色的蛋白质分泌能力,常被开发为通用的异源蛋白表达载体[1],在工业相关的食品酶类的生产中广泛采用,如糖化酶和凝乳酶[2]。糖化酶是一种由微生物分泌的具有外切酶活性的胞外酶,作为一种酸性蛋白酶,主要功能是从多聚糖(如淀粉)分子的非还原性末端水解释放β-D-葡萄糖,在食品工业中广泛运用[3]。
CO2是微生物生化代谢的产物,同时也是生化反应的底物,在好氧与厌氧发酵中都具有很关键的作用。由微生物代谢产生的大量CO2积累往往会抑制或者促进细胞生长和产物的合成。这种效果往往在工业规模反应器中更加突出,因为高静压、高耗氧及高密度发酵的特性会使反应器中尤其是底部形成高dCO2水平的发酵环境。已有的研究表明,dCO2对生物体的影响作用与dCO2水平、培养方式、培养成分和研究对象的选择有关[4]。因此,dCO2对生物体的具体影响需要在特定的研究对象和环境下进行。
本研究通过控制质量流量计实现进气中不同的CO2进气比例,结合发酵过程质谱仪检测分析尾气成分,以及依赖于培养基中pH、温度、离子强度和有机物质浓度建立的CO2溶解度的数学模型,可以较为准确的估算进气中不同CO2混合比例下发酵液的实际dCO2水平,从而定量分析不同dCO2水平对黑曲霉产糖化酶的影响。此外,通过菌体不同金属元素的摄入水平来阐述dCO2对黑曲霉产糖化酶的影响。
1 材料与方法 1.1 材 料 1.1.1 菌种本研究中采用的黑曲霉菌株GAM15由荷兰帝斯曼(DSM)公司提供,是一株经过诱变的糖化酶高产突变株。菌种通过孢子悬浮液置于-80℃冷冻保藏。
1.1.2 培养基斜面孢子培养基(PDA培养基)(g/dl):一水葡萄糖2.2,马铃薯20,琼脂1.8。培养温度为30℃,培养时间为6天。
种子培养基(g/kg):一水葡萄糖22,玉米浆20。
分批培养培养基(g/kg):一水葡萄糖44,NH4SO4 3,CaCl2 0.076,MgSO4 1,EDTA·Na2 0.67,KH2PO4 3,NaH2PO4·2H2O 1.69,ZnCl2 0.02,CuSO4·5H2O 0.015,CoCl2 0.015,FeSO4·7H2O 0.3,MnSO4·H2O 0.04。
恒化培养分批培养培养基(g/kg):一水葡萄糖10,其他成分同以上分批培养培养基。
恒化培养补料培养基(g/kg):一水葡萄糖14.3,NH4SO4 2.5,其他成分同以上分批培养培养基。
种子培养基和分批培养培养基121℃高温灭菌30min,恒化培养补料培养基121℃高温灭菌40min,葡萄糖均采取单独灭菌并在无菌条件下加入到培养基中。
1.2 方 法 1.2.1 发酵种子培养:采用500ml挡板摇瓶,包含100ml种子培养基,107 spores/ml孢子悬液接种1ml,起始培养基pH为6.5±0.02,摇床转速150r/min,种子培养24h。
分批培养:采用5L发酵罐(上海国强生化公司),初始发酵体积为3.5L,搅拌转速为450r/min,培养温度为(34±0.2)℃,发酵至葡萄糖耗尽。
恒化培养:按照200ml的接种量接种至5L发酵罐(同上),采取液位控制发酵体积为3L,使用3mmol/L的NaOH控制pH为4.5±0.05,通气量为3L/min,搅拌转速为425r/min,温度控制在(34±0.2)℃。当分批培养进入葡萄糖限制,表现为在线监测的CER降低、溶氧回升时,开始转入恒化培养补料阶段。当发酵液完成约4个洗脱体积后,发酵过程达到稳态,表现为尾氧、尾碳和菌浓等过程参数保持相对恒定。
1.2.2 分批培养和恒化培养中的通气组成分批培养和恒化培养实验中采用图 1所示的通气系统,控制两个质量流量计以实现在进气中混入不同比例的CO2气体。在5L分批发酵过程中,发酵罐顶空压力维持在0.05MPa恒定,根据1.2.3 小节中的溶解CO2模型,结合过程质谱在线检测的尾气中的CO2浓度,可估算出发酵液中相应的dCO2水平,详见表 1。
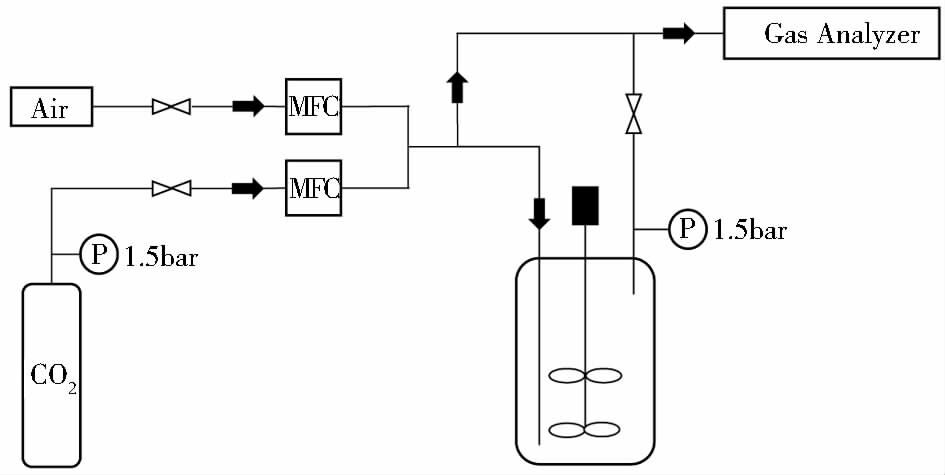
|
| 图 1 CO2对黑曲霉发酵产糖化酶影响的供气装置示意图 Figure 1 Setup of gas supply system for study impact of CO2 on production of glucoamylase using Aspergillus niger GAM15 |
| Cultivation mode | Fermentation | Gas mixture(L/min) | dCO2 in medium(mmol/L) |
| B-CN | Air | 0.38 | |
| Batch | B-CL | CO2:0.3 Air:2.7 | 4.13 |
| B-CH | CO2:0.6 Air:2.4 | 6.20 | |
| C-CN | Air | 0.15(D1=0.05/h)/0.20(D2=0.08/h) | |
| Chemostat | C-CL | CO2:0.3 Air:2.7 | 3.95 |
| C-CH | CO2:0.6 Air:2.4 | 5.83 | |
| Note: B-CN and C-CN refer to pure air in the inlet gas of batches and chemostats; B-CL and C-CL refer to relative low CO2 ratio in the inlet gas of batches and chemostats; B-CH and C-CH refer to relative high CO2 ratio in the inlet gas of batches and chemostats | |||
1.2.3 培养基中dCO2模型描述和计算
采用空气和CO2的混合气体为生物反应器供气,在达到气液相平衡时,发酵液中的CO2溶解量可由亨利定律描述[5]:
| ${P_{C{O_2}}} = HdC{O_2}$ | (1) |
式中,PCO2是CO2分压(kPa),H是CO2在本研究中所使用的恒化补料发酵液中对应的亨利常数[(kPa·L)/mol],dCO2是发酵液中溶解的CO2浓度(mol/L)。
由于发酵液中含有不同种类的盐离子和有机物质,因此CO2在发酵液中的溶解度根据Rischbieter等和Weisenberger等描述的经验公式计算:
| $log\left( {\frac{H}{{{H_0}}}} \right) = log\left( {\frac{{{c_{G,0}}}}{{{c_G}}}} \right) = i{({h_i} + {h_G})_{{C_i}}} + \sum\limits_j {({b_n} + {b_G}){c_{n,j}}} $ | (2) |
式中,H0是CO2在纯水中的亨利常数[(kPa.L)/mol],ci是i离子的浓度(mol/L),cn,j是有机物质j的浓度(g/L),CG,0和cG是气体在纯水和发酵液中的溶解度,Hi是离子特定常数(L/mol)。本研究中恒化补料培养基中盐离子的hi值[6]见表 2。
| Ion | Hi(L/mol) | Ion | Hi(L/mol) |
| Mg2+ | 0.169 4 | Ca2+ | 0.176 2 |
| NH4+ | 0.055 6 | Cu2+ | 0.167 5 |
| K+ | 0.092 2 | Co2+ | 0.168 |
| H+ | 0 | Fe2+ | 0.152 3 |
| Na+ | 0.114 3 | SO42- | 0.111 7 |
| Mn2+ | 0.146 3 | PO43- | 0.211 9 |
| Zn2+ | 0.153 7 | Cl- | 0.031 8 |
hG可通过Weisenberger 和Schumpe的经验式(3)估算:
| ${h_G} = {h_{G,0}} + {b_{G,T}}(T - 298.15K)$ | (3) |
在温度为273~313K时,对应的CO2的hG,0和hG,T值分别为-0.017 2L/mol和-0.338×10-3L/(mol·K)。式(2)中的bG可通过Rischbieter等的经验式(4)估算:
| ${b_G} = {b_{G,0}} + {b_{G,T}}(T - 298.15K)$ | (4) |
式(4)中在283~303K时,CO2对应的bG,0和bG,T值分别为-1.86×10-4m3/kg和0.01×10-4m3/(kg·K)。此外,葡萄糖的bn值为6.68×10-4m3/kg,联合式(2)~式(4),可得特定发酵培养基所对应的CO2亨利常数。
| $\begin{gathered} log\left( {\frac{H}{{{H_0}}}} \right) = \sum\limits_i {[{h_i} + {h_{G,0}} + {h_{G,T}}(T - 298.15K)]{c_i} + } \hfill \\ \sum\limits_j {[{b_n} + {b_{G,T}}(T - 298.15K)]{c_{n,j}}} \hfill \\ \end{gathered} $ | (5) |
在式(5)中,纯水中的CO2亨利常数为H0=3989(kPa·L)/mol(37℃),T是发酵培养时的绝对温度。
联合以上所有参数至式(5)和式(1)中,可近似得到CO2分压和dCO2浓度之间的关系式:
| $log\left( {\frac{H}{{{H_0}}}} \right) = log\left( {\frac{{{c_{G,0}}}}{{{c_G}}}} \right) = 0.0166$ | (6) |
因此H=1.039 H0=4 144.6(kPa·L)/mol,可由此得到在标准状态下(纯水)和本实验特定培养基成分条件下的CO2溶解度变化曲线,见图 2。
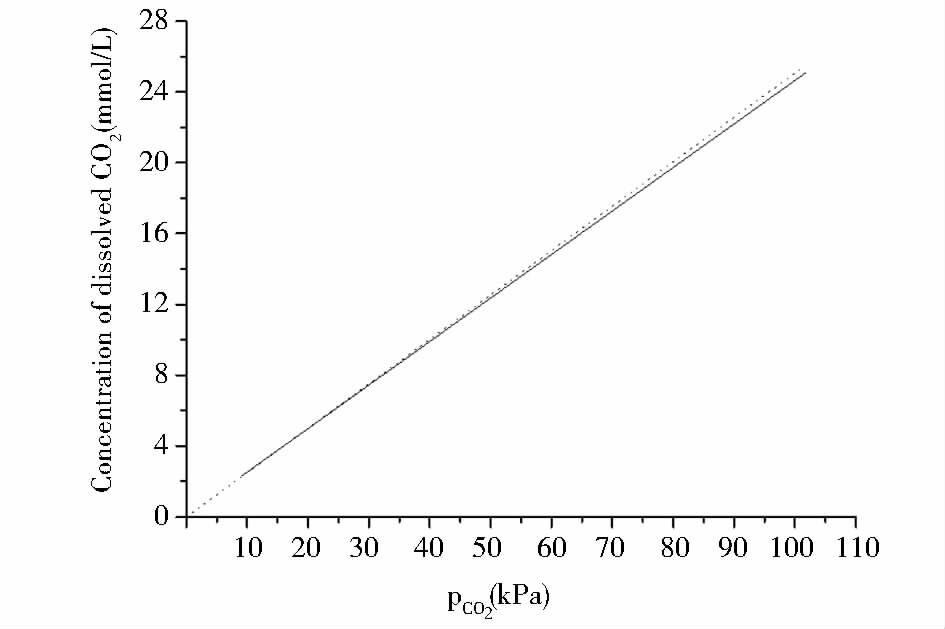
|
| 图 2 基于模型计算的不同CO2分压下的纯水(H0)和培养基(H)中的CO2溶解度 Figure 2 The dissolved CO2 concentrations calculated using the models: The dissolved CO2 concentrations in pure water,H0 (- - -) and medium,H (-) as a function of CO2 partial pressure |
CO2、HCO3-、CO32-在发酵液中处于一个化学平衡:
| $C{O_2} + {H_2}O\overset {{K_1}} \leftrightarrows HC{O_3}^ - + {H^ + }\overset {{K_2}} \leftrightarrows C{O_3}^{2 - } + 2{H^ + }$ | (7) |
| $\begin{gathered} {K_1} = [{H^ + }\left] {\left[ {HC{O_3}^ - } \right]/} \right[C{O_2}] \hfill \\ {K_2} = [{H^ + }\left] {\left[ {C{O_3}^{2 - }} \right]} \right[HC{O_3}^ - ] \hfill \\ \end{gathered} $ | (8) |
| $\alpha = \frac{{C{O_2}}}{{C{O_{2,total}}}} = \frac{{{H^2}}}{{{H^2} + {K_1}H + {K_1}{K_2}}}$ | (9) |
| $\beta = \frac{{HC{O_3}^ - }}{{C{O_{2,total}} = {K_1}H{H^2} + {K_1}H + {K_1}{K_2}}}$ | (10) |
| $\gamma = \frac{{C{O_3}^{2 - }}}{{C{O_{2,total}}}} = \frac{{{K_1}{K_2}}}{{{H^2} + {K_1}H + {K_1}{K_2}}}$ | (11) |
上述关系式中存在
| $C{O_{2,total}} = C{O_2} + HC{O_3}^ - + C{O_2}^{2 - }$ | (12) |
并且
| $H = {10^{ - pH}}$ | (13) |
此外,可查知解离常数K1、K2分别为5.350 2×10-7和6.124 510×10-11。黑曲霉分批发酵和恒化培养中pH控制为4.5±0.05,可以计算出此条件下对应α=98.34%、β=1.66%,即发酵液中CO2绝大多数是以dCO2形式存在,少量以HCO3-形式存在。
1.2.4 分析检测方法细胞干重:取5ml发酵液,记录所取质量,通过提前烘干并称重的玻璃纤维滤纸抽滤,并使用30ml去离子水洗涤后置于70℃烘箱24h后迅速称取滤膜质量。
葡萄糖:采用生物DNS法进行测定,测定前样品稀释至测定范围(0.00~1.00g/L)[7]。
乙二酸测定:使用SHIMADZU高效液相色谱定量,柱VARIAN Metacarb H plus,柱温50℃,流动相5mmol/L H2SO4,流速0.4ml/min,检测器SPD-20AV。
糖化酶酶活测定:酶活使用AGI单位表示。一个AGI单位定义为每分钟在pH 4.3和温度60℃条件下从可溶性淀粉上水解生成1μmol葡萄糖所需的酶量。50mg糖化酶标品对应大约2 500AGI。糖化酶酶活测量:230μl AGIsub试剂(37℃预热5min)与20μl发酵液上清混合,37℃反应20min后加100μl AGIstop试剂,在405nm下测量混合液体吸光度来定量糖化酶。使用不同浓度的标品按上述方法所得到的糖化酶标准曲线由下式表示(R2>0.999):
糖化酶酶活=稀释倍数×OD450+0.010.08
摄氧率(OUR)和二氧化碳的生成速率(CER)测定:发酵过程中尾气浓度由尾气过程质谱仪(MAX300-LG,Extrel)测定,溶氧使用极谱溶氧电极(Mettler Toledo)检测。
| $\begin{gathered} OUR = \frac{{{F_{in}}}}{V}[{C_{{O_{2in}}}} - \frac{{{C_{inertin}}*{C_{{O_{2out}}}}}}{{1 - ({C_{{O_{}}2out}} + {C_{C{O_{2out}}}})}}]*{\text{ }}\frac{{273}}{{273 + {t_{in}}}}* \hfill \\ {P_{in}}*\frac{1}{{1 + h}}*{10^{ - 5}} \hfill \\ \end{gathered} $ | (14) |
| $\begin{gathered} CER = \frac{{{F_{in}}}}{V}[\frac{{{C_{inertin}}*{C_{{O_{2out}}}}}}{{1 - ({C_{{O_{2out}}}} + {C_{C{O_{2out}}}})}} - {C_{C{O_{2out}}}}]*\frac{{273}}{{273 + {t_{in}}}}* \hfill \\ {P_{in}}*\frac{1}{{1 + h}}*{10^{ - 5}} \hfill \\ \end{gathered} $ | (15) |
元素分析:碳和氮元素由VARIO ELⅢ元素分析仪测定,磷、硫、钙、钾、镁和锰元素由IRIS ADVANTAG等离子体发射光谱仪测定。
1.2.5 动力学模型恒化培养下的质量平衡可由式(16)来计算物质i的比生成速率(生物量[X],葡萄糖[S],或者产物[P])。
| $\frac{{d\left( {V{C_i}} \right)}}{{dt}} = {F_{in}}{C_i} - {F_{out}}{C_i} + {q_i}{C_x}V$ | (16) |
式中,F是流进或流出反应器的体积流速,Ci是物质i的浓度,qi是物质i的比生成速率。在稳定状态下,d(VCi)/dt等于零,可由式(16)计算物质i的比生成速率。比生长速率(μ)等于流出速率除以反应体积。葡萄糖比消耗速率(qS)定义为每克干生物量每小时消耗的葡萄糖量。酶活比生成速率qP定义为每克干生物量每小时生成的酶量。从以上计算的q速率中,还可计算出相应的得率系数(Yis)[8]。
2 结果与分析已有文献表明,不同培养方式下,CO2对细胞的具体影响结果存在差异。本实验首先在分批培养条件下研究了通气中混入约10%和20%CO2(V/V)对黑曲霉发酵产糖化酶的影响。为了准确考察dCO2对黑曲霉产糖化酶的影响,本研究中采用在延滞期结束(分批培养第10h)后通入混有CO2的空气,从而避免细胞在延滞期时暴露在高dCO2环境中,这主要是考虑到大规模发酵初期dCO2水平较低。
2.1 分批培养条件下不同dCO2水平对黑曲霉的生理影响 2.1.1 不同dCO2水平对底物葡萄糖消耗和生长的影响从图 3(a)、(b)可以看出,随着发酵液中dCO2浓度增加,qS逐渐降低,这表明dCO2会降低细胞的葡萄糖摄入速率,并且抑制程度随着发酵液中dCO2浓度增加而加大。
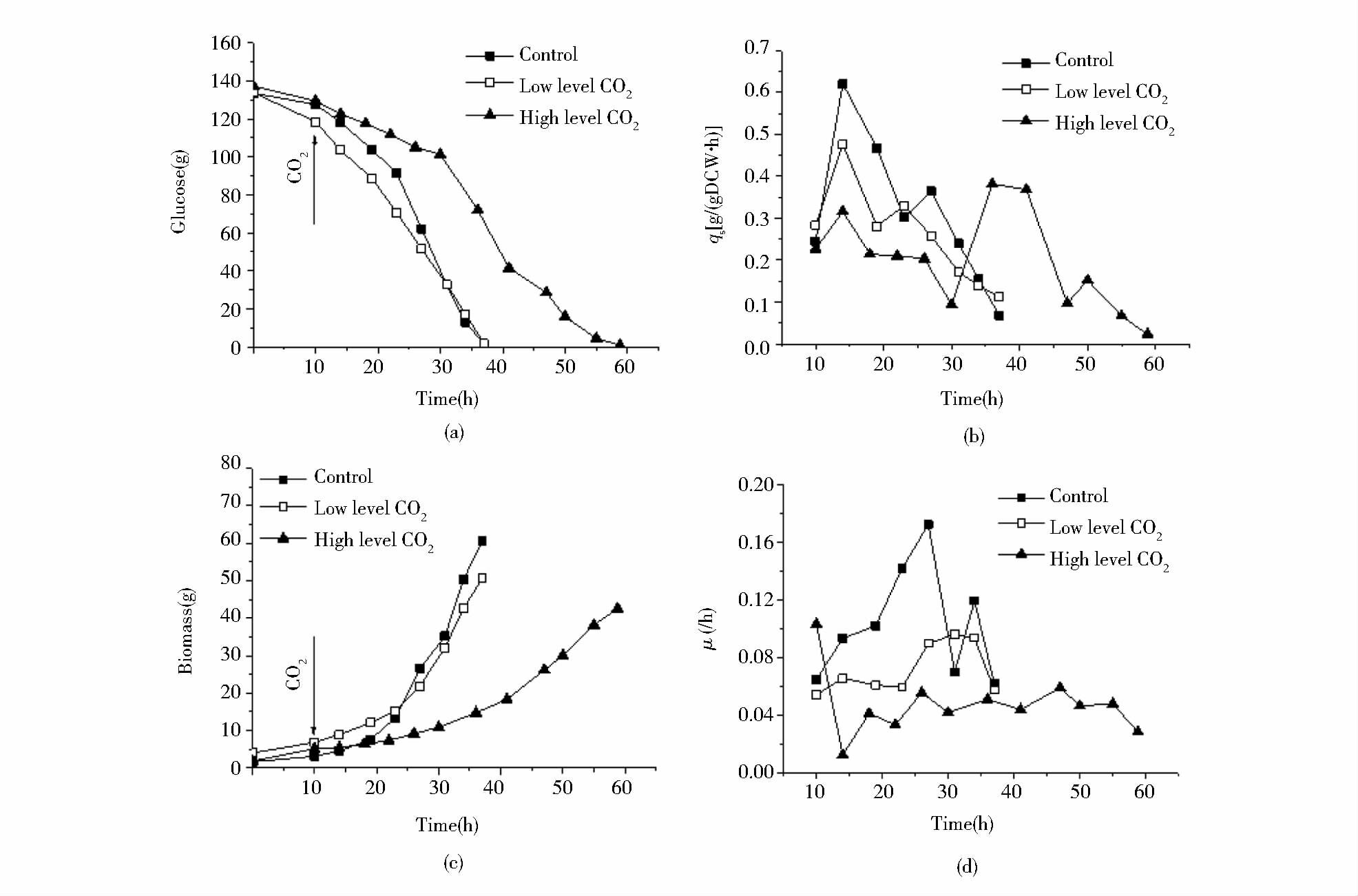
|
| 图 3 三种不同dCO2水平下的5L分批发酵的葡萄糖(a),比底物消耗速率qS(b)、生物量(c)、比生长速率μ(d)的变化 Figure 3 The profile of glucose(a),specific glucose consumption rate(qS)(b),biomass(c),specific growth rate(μ)(d)of 5L batch cultures with three different levels of dissolved CO2 |
由图 3(a)、(b)知,当发酵液中dCO2浓度约为0.38mmol/L时,细胞生长最快,细胞的平均比生长速率达到0.12/h。当发酵液中dCO2浓度约为4.13mmol/L时,细胞平均比生长速率降低至约0.08/h,较对照组降低了约40%,细胞的生长明显受到一定程度的抑制。当发酵液中dCO2浓度约为6.20mmol/L时,细胞平均比生长速率进一步降低至约0.05/h,细胞的生长受到进一步的抑制,较对照组降低了约60%。
2.1.2 不同dCO2水平对糖化酶和副产物合成的影响对比3种进气条件下的比糖化酶生成速率可知,在20h之前,当发酵液中dCO2浓度约为0.38mmol/L时,qP是最高的。当发酵液中dCO2浓度约为4.13mmol/L时,分批发酵前期qP的增加速率明显低于对照组,推测是因为CO2导致细胞内能量与中间代谢物的重新分配,以适应高dCO2对细胞造成的生理压力。在后期适应了CO2的压力刺激后,qP恢复至和对照组相近的水平。而当发酵液中dCO2浓度约为6.20mmol/L时,qP值在第22h达到最高后,缓慢降低,但qP仍高于同期的相对低dCO2实验组和对照组约25%。
从图 4(c)、(d)可以看出,当发酵液中dCO2浓度约为4.13mmol/L时,乙二酸的积累速率在发酵前期较对照组有一定程度的降低,在后期则高于对照组。当发酵液中dCO2浓度约为6.20mmol/L时,在第10h时切换通气后,从第10h至约20h,乙二酸的浓度先增加后减少,qOA值也同时表明胞外乙二酸在初期积累,后期草酸消耗速率超过生成速率。据文献报道,可能是因为在高dCO2环境压力刺激下,细胞短期内快速响应,回补反应增强,胞外乙二酸浓度下降。在切换通气14h后,比乙二酸生成速率的逐渐提高,并且较对照组高出了近1倍,达到0.02g/(gDCW·h)。这表明,qS的降低影响了细胞的生长,副产物的比生成速率反而增加了。
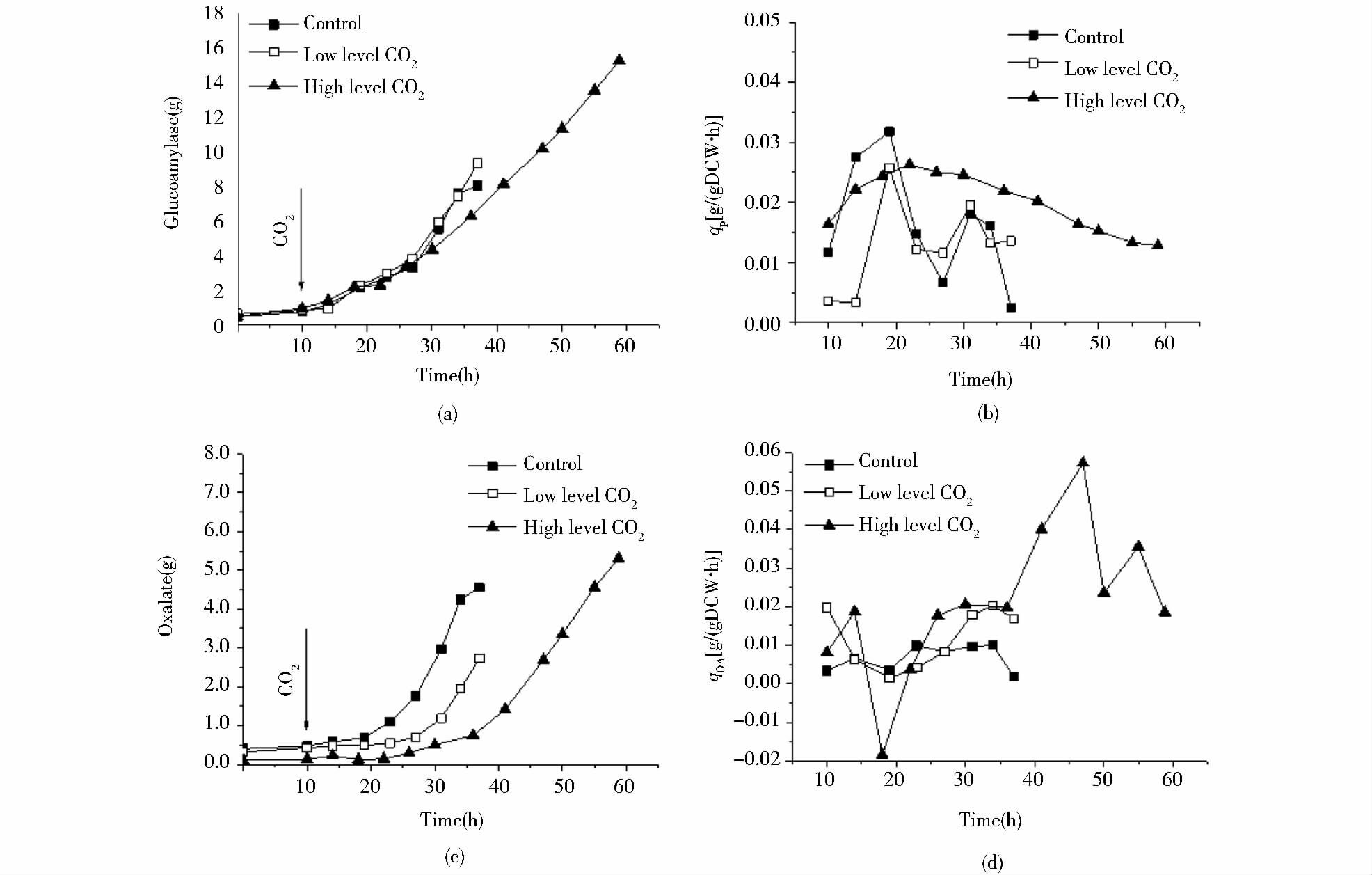
|
| 图 4 三种不同dCO2水平下的5L分批发酵的糖化酶(a)、比产物生成速率qP(b)、草酸(c)、比乙二酸形成速率qOA(d)的变化 Figure 4 The profile of glucoamylase(a),specific glucoamylase formation rate(qS)(b),oxalate (c), specific oxalate formation rate(μ)(d)of 5L batch cultures with three different levels of dissolved CO2 |
McIntyre和Mcneil[9]在分批培养模式下,通过连续混入不同比例的CO2(0%、1%、3%、5%、7.5%、12%、15% V/V)来研究dCO2对黑曲霉A60产柠檬酸的影响。结果发现,当进气中CO2比例大于3%时,会导致生物量、柠檬酸浓度以及底物消耗速率降低,并且随着高dCO2环境压力刺激时间的增加,这种作用将更加显著,推测可能是高dCO2抑制了柠檬酸合成途径中某些酶的活性。McIntyre和Mcneil[10]同样在恒化培养模式下研究了进气中不同比例的CO2对黑曲霉产柠檬酸的影响。结果表明,同样进气比例的CO2对黑曲霉A60生长、柠檬酸合成、葡萄糖酸合成以及菌形的影响较分批培养模式下温和很多。此外,El-Sabbagh等[11]同样通过在进气中混入一定比例的CO2来研究dCO2对产黄青霉合成青霉素的影响。结果发现,延滞期高溶解CO2水平会降低细胞的生长和底物的利用速率,并引起菌丝形态变化,产物青霉素的合成也会减少。
2.1.3 不同dCO2水平的黑曲霉分批发酵的得率图 5为三种不同dCO2水平下的5L分批发酵的得率。为了区分CO2与溶氧对黑曲霉产糖化酶的影响,以上得率均在溶氧不受限制的情况下进行比较。随着发酵液中dCO2水平增加,YP/S逐渐升高。当发酵液中dCO2浓度约为6.20mmol/L时,YP/S最高,达到0.104g/g。而相对低dCO2实验组和对照组对应的YP/S分别为0.059g/g和0.056g/g。而在YX/S对比上,从图 5可以看出发酵液中dCO2比例越高,YX/S相对降低,这符合YP/S的相反变化的规律。
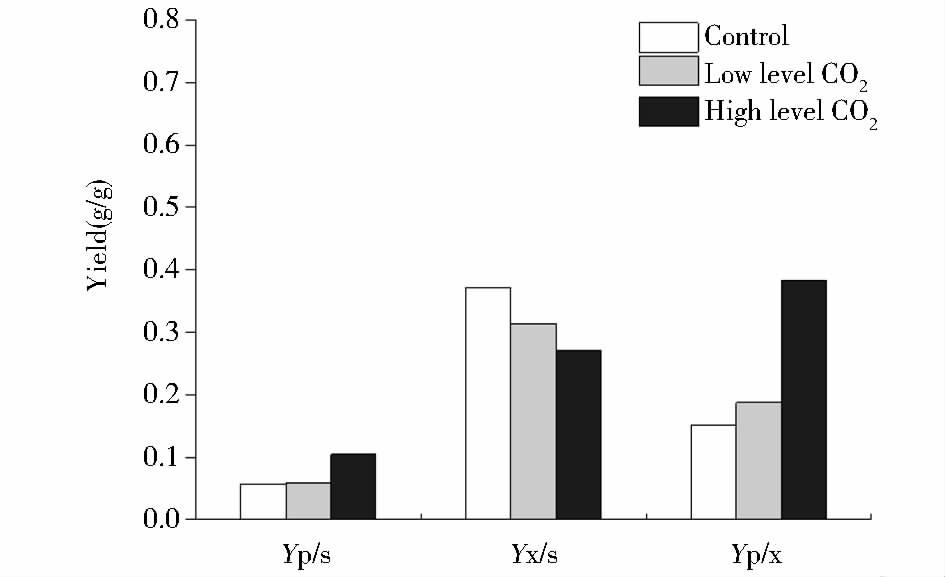
|
| 图 5 三种不同dCO2水平下5L分批发酵的得率 Figure 5 The yields of 5L batch cultures with three different levels of dissolved CO2 |
已有文献表明,CO2对微生物的作用效果与培养方式有关。分批培养条件下,发酵过程中细胞的生物量、底物浓度、溶氧等都在不断变化,因此很难准确界定CO2对细胞的单一影响。基于2.1小节的研究结果,本小节在恒化培养条件下探究CO2对黑曲霉产糖化酶的影响。在恒化实验分批培养阶段结束后立即进入补料阶段,同时按照表 1中所设的CO2和空气流量比例切换通气条件。恒化培养时,细胞的生物量较低,加上小试反应器顶空压力相对较高,即使在进气中通入约20%体积分数CO2时,发酵过程中溶氧仍明显处于溶氧限制以上(数据未显示),因此本实验可以较好的研究单一因素dCO2对黑曲霉发酵表现的影响。本实验通过相对低(D1=0.05/h)和高(D2=0.08/h)稀释率的恒化培养实验来研究dCO2对黑曲霉产糖化酶的影响。
2.2.1 不同dCO2水平对葡萄糖消耗和生长的影响从图 6(a)中可以看出,在稀释率为D1=0.05/h时,0.15mmol/L、3.95mmol/L和5.83mmol/L三种dCO2水平的恒化培养稳定期菌体干重平均值分别为4.00g/kg、4.01g/kg和3.92g/kg。相对高dCO2实验组的平均菌体干重略微下降了2%,这表明三种dCO2水平下细胞生长没有受到抑制。而在分批培养下,随着发酵液中dCO2水平增加,细胞生长抑制程度加大。从图 6(c)可以看出,高低dCO2条件下发酵液残糖较实验组略高,表明细胞对葡萄糖的利用并没有受到明显的影响。
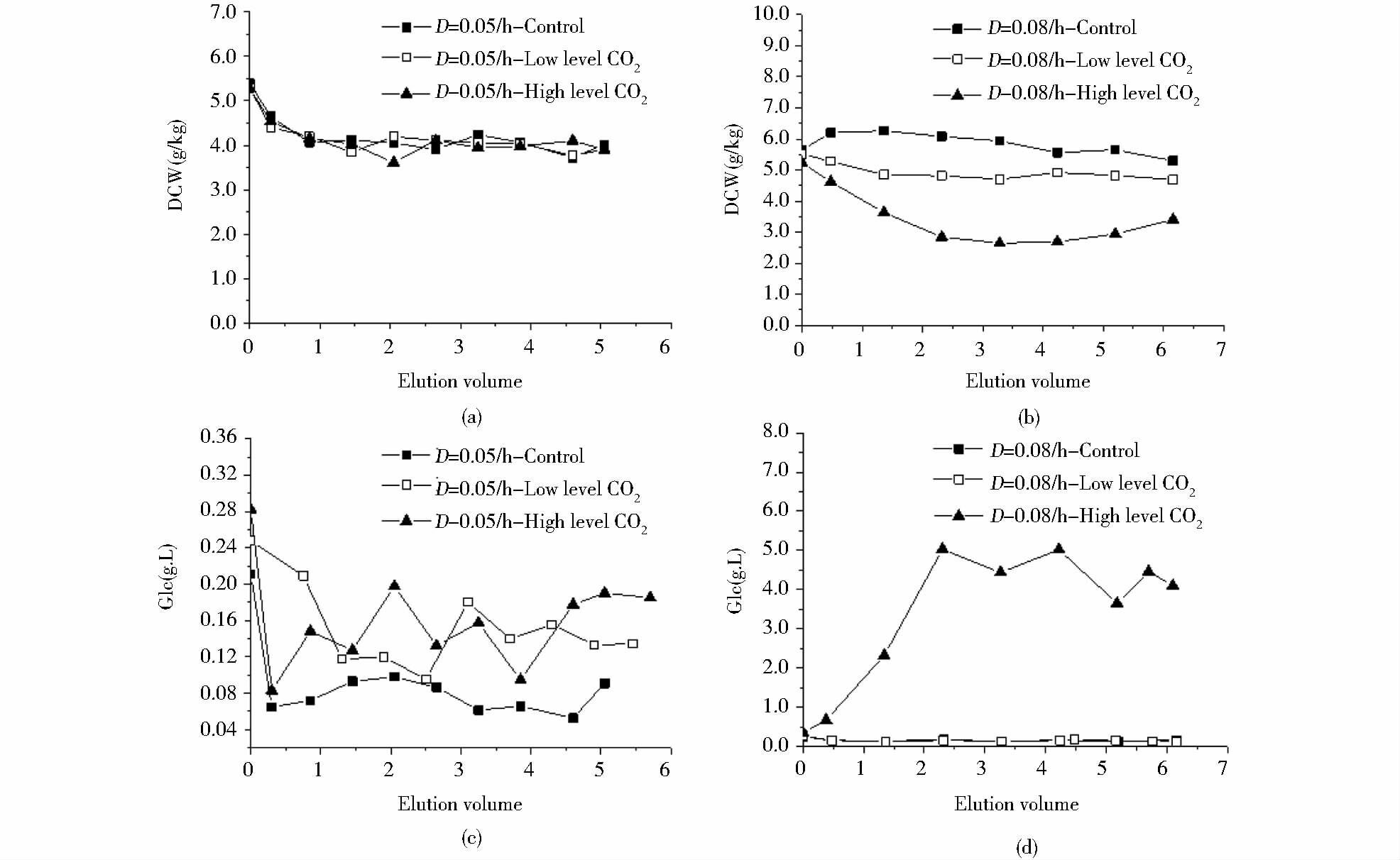
|
| 图 6 三种不同dCO2水平和稀释率下的恒化培养的生物量[(a)、(b)]、葡萄糖的变化[(c)、(d)] Figure 6 The profile of biomass [(a),(b)],glucose [(c),(d)] of 5L chemostat cultures with three different levels of dissolved CO2 |
从图 6(b)中可以看出,在D2=0.08/h时,0.15mmol/L、3.95mmol/L和5.83mmol/L三种dCO2水平的恒化培养稳定期菌体干重平均值分别为5.70g/kg、4.73g/kg和2.95g/kg。低dCO2实验组和高dCO2实验组的平均细胞干重较对照组分别降低了17.0%和48.2%,表明发酵中较高水平的dCO2会抑制细胞生长,并且其对细胞生长的抑制程度随着发酵液中dCO2水平的增加而加大。从图 6(d)可以看出,高dCO2实验组的发酵液残糖较高,表明高水平dCO2会抑制细胞对葡萄糖的消耗。恒化稳态下的比生长速率等同于相应的控制稀释率,这表明稀释率D2=0.08/h时,高dCO2浓度会降低菌体对于底物葡萄糖的亲和力,导致稳态下的葡萄糖浓度明显高于对照组。
2.2.2 不同dCO2水平对糖化酶和副产物合成的影响从图 7(a)中可以看出,当稀释率为D1=0.05/h,且dCO2水平为0.15mmol/L时,稳定期酶活是最低的,而相对低dCO2下的酶活是最高的,相对高dCO2下的酶活介于两者之间。对比三种不同dCO2水平恒化培养的乙二酸可知,在dCO2水平为0.15mmol/L时,对照组稳定期的草酸是最高的,相对低dCO2下的乙二酸略低于对照组,相对高dCO2下的乙二酸是最低的,平均为0.8g/L,明显低于低dCO2实验组和对照组。
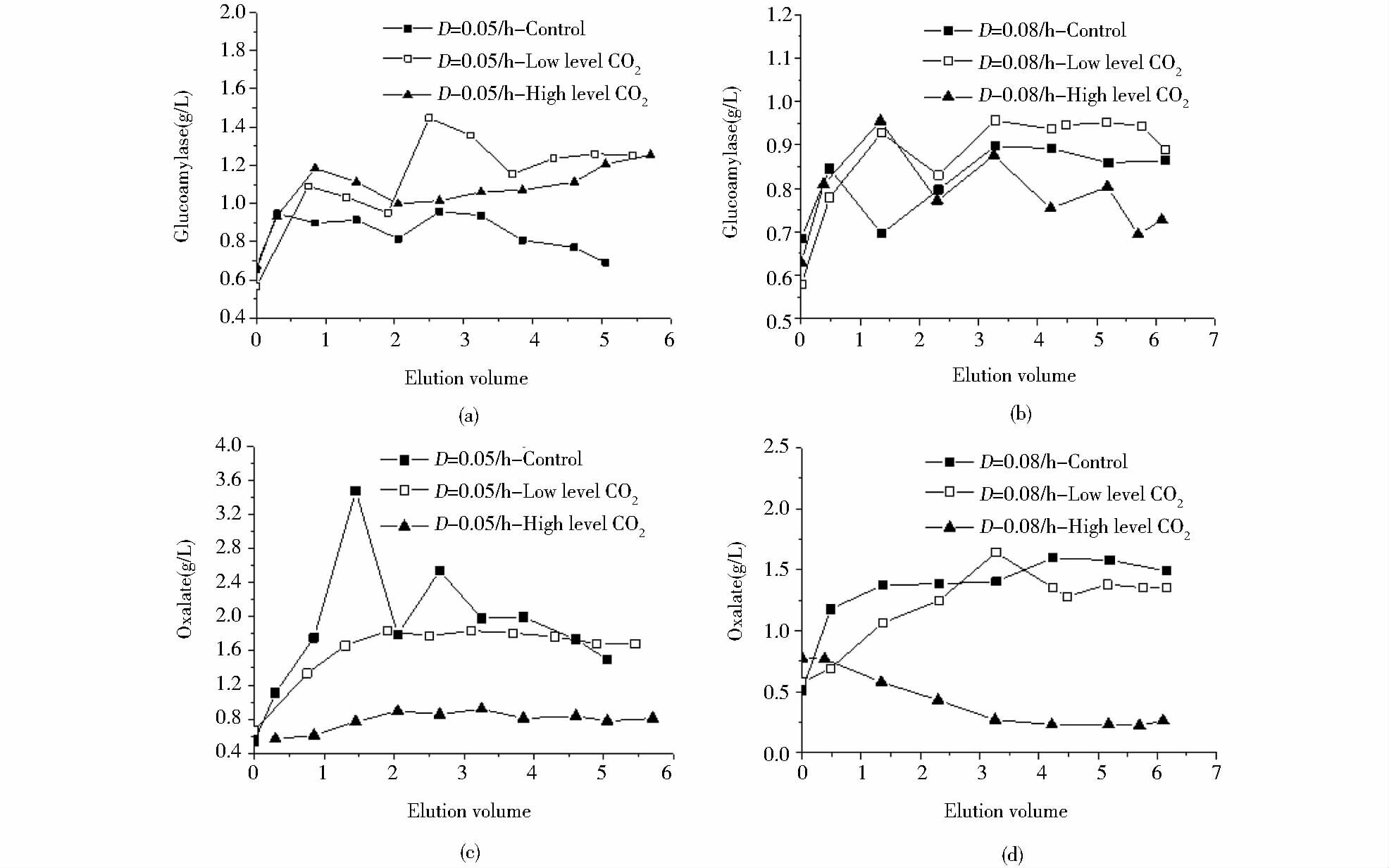
|
| 图 7 三种不同dCO2水平和稀释率下的恒化培养的糖化酶[(a)、(b)]、乙二酸的变化[(c)、(d)] Figure 7 The profile of glucoamylase[(a),(b)],oxalate [(c),(d)] of 5L chemostat cultures with three different levels of dissolved CO2 Low level CO2 refers to relative low dissolved carbon dioxide concentration in the medium (3.95mmol/L); High level CO2 refers to relative high dissolved carbon dioxide concentration in the medium (5.83mmol/L) |
从图 7(b)中可以看出,当稀释率为D1=0.08/h,且dCO2水平为5.83mmol/L时,稳定期酶活是最低的,而相对低dCO2下的酶活是最高的,这与此稀释率下所对应的生物量大小也有关联。对比三种不同dCO2水平恒化培养的乙二酸可知,相对低dCO2下的乙二酸略低于对照组,而相对高dCO2下的乙二酸是最低的,平均为0.25g/L,明显低于低dCO2实验组和对照组。
从表 3可知,在稀释率为D1=0.05/h时,低dCO2实验组的qS较对照组降低了9.3%,而在高dCO2实验组的qS较对照组略增1%。对比qP可知,低dCO2实验组的qP却是最高的,达到0.017 6molC(molX·h),较对照组增加了55.8%;高dCO2实验组的qP为0.015 molC/(molX·h),较对照组增加了37.2%。对比qOA可知,对照组的qOA是最高的,低dCO2实验组的qOA较对照组略低,而高dCO2实验组的qOA明显低于低dCO2实验组和对照组。
| Parameter | D1=0.05 | D1=0.05-LC | D1=0.05-HC | D2=0.08 | D2=0.08-LC | D2=0.08-HC |
| dCO2(mmol/L) | 0.15 | 3.95 | 5.83 | 0.20 | 3.95 | 5.83 |
| μ(/h) | 0.048 | 0.052 | 0.050 | 0.078 | 0.081 | 0.078 |
| qGlc[molC/(molX·h)] | 0.143 | 0.133 | 0.146 | 0.155 | 0.179 | 0.204 |
| qP[molC/(molX·h)] | 0.011 3 | 0.017 6 | 0.015 5 | 0.016 2 | 0.017 5 | 0.022 8 |
| qOA[molC/(molX·h)] | 0.007 | 0.006 4 | 0.002 9 | 0.005 0 | 0.006 3 | 0.001 9 |
| qO2[molC/(molX·h)] | 0.059 | 0.065 | ||||
| qCO2[molC/(molX·h)] | 0.059 | 0.058 | ||||
| C-balance/% | 93.5 | 102.3 | ||||
| Note: Blank refers to not determined. LC is the abbreviation for low level CO2 and refers to relative low dissolved carbon dioxide concentration in the medium(3.95mmol/L); HC is the abbreviation for high level CO2 and refers to relative high dissolved carbon dioxide concentration in the medium (5.83mmol/L) | ||||||
从表 3可知,在稀释率为D2=0.08/h时,对比qS可知,随着发酵液中dCO2水平增加,qS不断增大。这一变化规律与三种不同dCO2水平下qP的变化规律是相同的,即细胞的qP随着qS增加而增加,这说明细胞摄取葡萄糖的能力增强,增加的部分葡萄糖摄入用于糖化酶生成速率的增加。对比主要副产物乙二酸可知,低dCO2实验组的qOA较对照组增加了14.5%,高dCO2实验组的qOA较对照组大幅减少了66%,表明高比生长速率(D2=0.08/h)条件下,低水平dCO2促进了副产物的合成,而高水平dCO2会使副产物的合成明显减少。
产物糖化酶的合成依赖于氨基酸的合成,而氨基酸是依赖于糖酵解、TCA循环及回补反应中的前体进行合成的。在常见的氨基酸合成中间前体中,α-酮戊二酸、草酰乙酸、磷酸烯醇式丙酮酸、丙酮酸、磷酸甘油酸及5-磷酸核糖都参与到生成或者利用CO2的生化反应中。因此,发酵液中的dCO2在代谢物水平能够直接影响生化反应的进行,进而改变整个生化反应途径的碳流和能量流,进而影响细胞的整体代谢情况[12]。
2.2.3 不同dCO2水平对黑曲霉菌体元素组成的影响从图 8(a)可以看出,在D1=0.05/h时,低dCO2实验组的菌体碳含量是最高的,但是总体差异很小,这可能是低dCO2时细胞利用葡萄糖合成更多胞内的储藏碳源及自身羧化反应增强所造成的。在D2=0.08/h下,随着发酵液中dCO2水平增加,菌体碳含量不断下降,在高dCO2下为45.63%,较对照组的50.24%低了9.2%。对比菌体氮含量可知,在D1=0.05/h时,3种不同dCO2水平条件下的氮含量非常相近。在D2=0.08/h下,低和高dCO2条件下的氮含量分别为7.29%和7.57%,分别较对照组增加了11.8%和16.1%。这与高dCO2条件下糖化酶合成增加有关,也可能与高dCO2对细胞的胁迫导致胞内一些多元醇、储藏性碳源及压力应激蛋白的合成增加有关[13]。
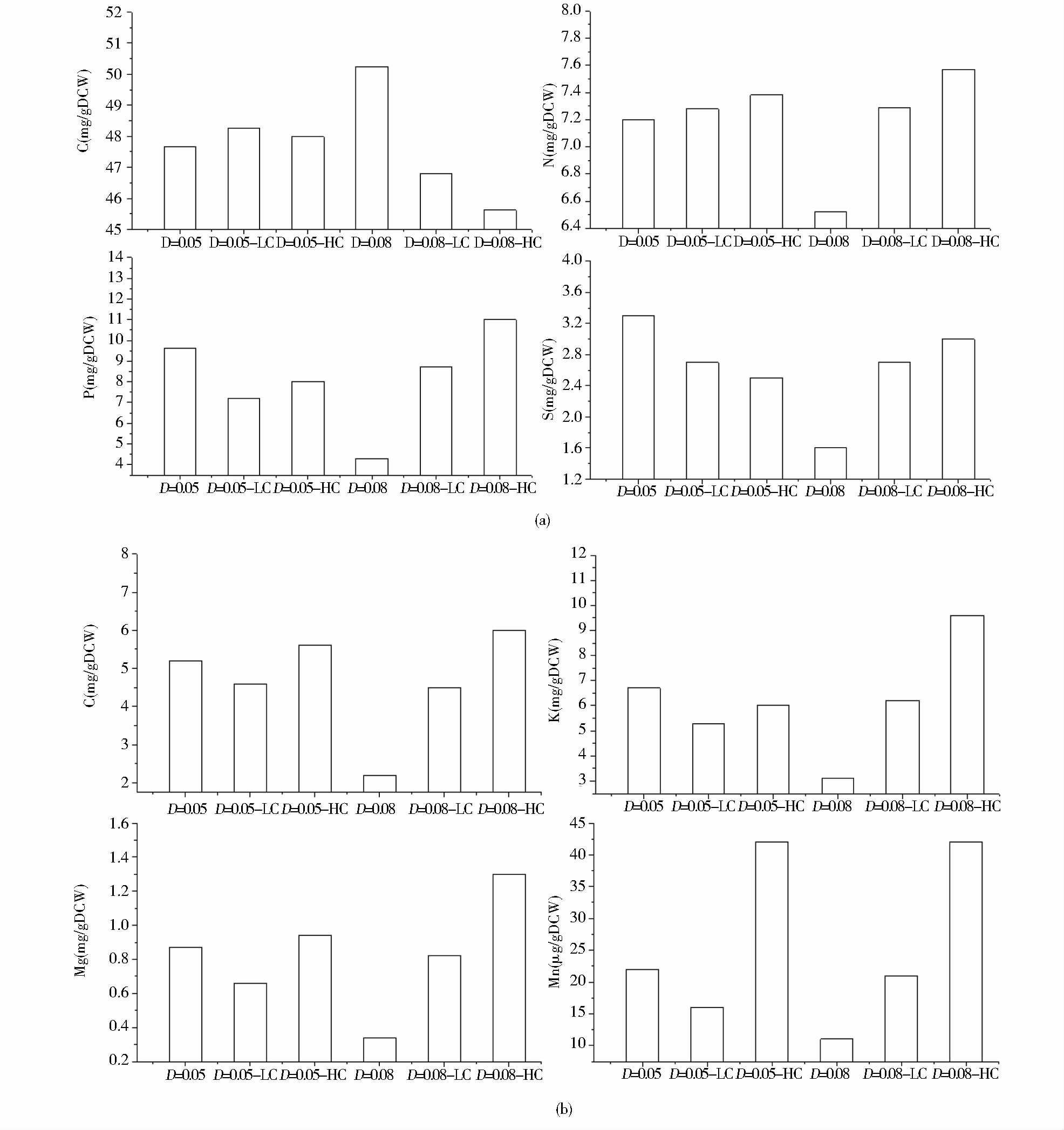
|
| 图 8 不同dCO2水平和稀释率下恒化培养黑曲霉菌体的元素组成 Figure 8 The elements analysis of Aspergillus niger in chemostat cultures with different dilution rates and different levels of dissolved CO2 (a) Carbon,nitrogen,phosphorus,sulphur (b) Calcium,potassium,magnesium,manganese Low level CO2 refers to relative low dissolved carbon dioxide concentration in the medium (3.95 mmol/L); High level CO2 refers to relative high dissolved carbon dioxide concentration in the medium (5.83 mmol/L) |
当D1=0.05/h时,菌体P、S、Ca、K、Mg、Mn元素含量的变化规律均保持一致,即低dCO2下这些元素含量均低于对照组,而高dCO2下这些元素的含量均高于对照组。
当D2=0.08/h时,菌体P、S、Ca、K、Mg、Mn这些微量元素,也保持相同的变化规律,即随着发酵液中dCO2水平增加,这些微量元素的含量呈显著增加的趋势。
有文献报道细胞在面临高dCO2水平胁迫时,胞内的ATP水平会下降,可能是丙酮酸羧化反应消耗了ATP。此外,CO2经跨膜运输至细胞内后,会在胞内解离生成H+和HCO3-,为了维持恒定的胞内酸碱环境,质子必须排出至细胞外,并且消耗ATP摄入阳离子以维持电荷平衡[13-14]。这可能与细胞胞内酸碱平衡和电荷平衡存在密切联系,进而影响细胞的生化代谢和能量状态。
Yusaku和Hiroshi[15]发现,往培养基中添加金属离子Zn和Ca有利于根霉A11合成糖化酶。由此推测,当发酵液中dCO2水平增加时,细胞对这些微量元素摄入的增加,可能与这些元素激活一些关键代谢反应的酶类有关,进而提高糖化酶产量。
3 结 论大规模发酵由于高密度、高耗氧、高静压的特性,通常在反应器局部会形成较高dCO2水平,而黑曲霉产糖化酶的工业生物过程成功放大必然需要在实验室规模评估dCO2对黑曲霉产糖化酶的影响。
从本研究结果可知,dCO2黑曲霉产糖化酶的影响依赖于培养方式和dCO2水平,而且和黑曲霉所处的具体代谢状态密切相关,如特定的比生长速率等。此研究结果有利于指导黑曲霉产糖化酶工业生物过程的建立。例如,设计一个对较高dCO2水平不敏感的比生长速率,以保证黑曲霉在面对dCO2生理胁迫时仍然有利于糖化酶的合成。因此可以推断,dCO2对黑曲霉产糖化酶的影响需要针对特定的黑曲霉实验条件来判定。以上的研究结果对考察较高dCO2水平对其他生物体的生理影响同样具有很重要的参考意义。同时菌体元素分析结果表明,黑曲霉在受到较高dCO2胁迫时,会增加阳离子的摄入,这可能与维持细胞胞内的酸碱平衡和电荷平衡有关。
| [1] | 郭艳梅, 郑平, 孙继宾. 黑曲霉作为细胞工厂——知识准备与技术基础. 生物工程学报 , 2010, 26 (10) : 1410–1418. Guo Y M, Zheng P, Sun J B. Aspergillus niger as a potential cellular factory:prior knowledge and key technology. Chinese Journal of Biotechnology , 2010, 26 (10) : 1410–1418. |
| [2] | Melzer G, Dalpiaz A, Grote A, et al. Metabolic flux analysis using stoichiometric models for Aspergillus niger:comparison under glucoamylase-producing and non-producing conditions. Journal of Biotechnology , 2007, 132 (4) : 405–417. DOI:10.1016/j.jbiotec.2007.08.034 |
| [3] | Marin N J, Polaina J. Glucoamylases:structural and biotechnological aspects. Applied Microbiology and Biotechnology , 2011, 89 (5) : 1267–1273. DOI:10.1007/s00253-010-3034-0 |
| [4] | Mhairi M, Brian M. Effects of elevated dissolved CO2 levels on batch and continuous cultures of Aspergillus niger A60:an evaluation of experimental methods. Aplied and Environmental Microbiology , 1997, 63 (11) : 4171–4177. |
| [5] | Song H, Lee J W, Choi S, et al. Effects of dissolved CO2 levels on the growth of Mannheimia succiniciproducens and succinic acid production. Biotechnology and Bioengineering , 2007, 98 (6) : 1296–1304. DOI:10.1002/(ISSN)1097-0290 |
| [6] | Gros J B, Dussap C G, Catté M. Estimation of O2 and CO2 solubility in microbial culture madia. Biotechnology Progress , 1999, 15 (5) : 923–927. DOI:10.1021/bp990074i |
| [7] | 赵凯, 徐鹏举, 谷光烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究. 食品科学 , 2008, 29 (8) : 534–536. Zhao K, Xu P J, Gu G Y. Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method. Food Science , 2008, 29 (8) : 534–536. |
| [8] | Youngquist J T, Lennen R M, Ranatunga D R, et al. Kinetic modeling of free fatty acid production in Escherichia coli based on continuous cultivation of a plasmid free strain. Biotechnology and Bioengineering , 2012, 109 (6) : 1518–1527. DOI:10.1002/bit.24420 |
| [9] | Mcintyre M, Mcneil B. Dissolved carbon dioxide effects on morphology, growth, and citrate production in Aspergillus niger A60. Enzyme and Microbial Technology , 1997, 20 (2) : 135–142. DOI:10.1016/S0141-0229(96)00108-1 |
| [10] | Mcintyre M, Mcneil B. Effect of carbon dioxide on morphology and product synthesis in chemostat cultures of Aspergillus niger A60. Enzyme and Microbial Technology , 1997, 21 (7) : 479–483. DOI:10.1016/S0141-0229(97)00007-0 |
| [11] | El-Sabbagh N, Mcneil B, Harvey L M. Dissolved carbon dioxide effects on growth, nutrient consumption, penicillin synthesis and morphology in batch cultures of Penicillium chrysogenum. Enzyme and Microbial Technology , 2006, 39 (2) : 185–190. DOI:10.1016/j.enzmictec.2005.10.020 |
| [12] | Lu S, Eiteman M A, Altman E. Effect of CO2 on succinate production in dual-phase Escherichia coli fermentations. Journal of Biotechnology , 2009, 143 (3) : 213–223. DOI:10.1016/j.jbiotec.2009.07.012 |
| [13] | Richard L, Guillouet S E, Uribelarrea J L. Quantification of the transient and long-term response of Saccharomyces cerevisiae to carbon dioxide stresses of various intensities. Process Biochemistry , 2014, 49 (11) : 1808–1818. DOI:10.1016/j.procbio.2014.07.020 |
| [14] | Aguilera J, Petit T, De Winde J H, et al. Physiological and genome-wide transcriptional responses of Saccharomyces cerevisiae to high carbon dioxide concentrations. FEMS Yeast Research , 2005, 5 (6-7) : 579–593. DOI:10.1016/j.femsyr.2004.09.009 |
| [15] | Yusaku F, Hiroshi M. Improved glucoamylase production by Rhizo-pus sp.A11 using metal-ion supplemented liquid medium. Journal of Fermentation and Bioengineering , 1996, 82 (6) : 554–557. DOI:10.1016/S0922-338X(97)81251-2 |
 2017, Vol. 37
2017, Vol. 37




