文章信息
- 焦洋, 刘恒, 拉提百克·买买提居马, 曹永平.
- JIAO Yang, LIU Heng, Talatibaike·Maimaitijuma, CAO Yong-ping.
- 石墨烯及其衍生物在骨科的应用
- The Application of Graphene and Derivatives in Orthopedics
- 中国生物工程杂志, 2017, 37(8): 78-83
- China Biotechnology, 2017, 37(8): 78-83
- http://dx.doi.org/DOI:10.13523/j.cb.20170812
-
文章历史
- 收稿日期: 2017-02-07
- 修回日期: 2017-04-07
石墨烯(Graphene)是从石墨材料中剥离出来,由一层以苯环结构(即六角形蜂巢结构)周期性紧密堆积的碳原子构成的只有一层原子厚度的二维晶体,其基本结构单元为有机材料中最稳定的苯六元环,它可以看做是构成零维的富勒烯、一维的碳纳米管及三维的石墨和金刚石的基本结构单元(图 1)[1]。2004年,英国曼彻斯特大学的Novoselo等[2]成功地在实验中从石墨中分离出石墨烯,并证实它可以单独存在。他们因此也获得2010年诺贝尔物理学奖。由于单层石墨烯的厚度仅为0.35nm,是世界上已知最薄的新型二维材料,所以具有独特的物理、化学及生物学特性,因此广泛应用于药物传递、抗菌、临床检测、抗肿瘤、生物工程等生物医学领域[3-7]。石墨烯应用于生物医学的主要形式是功能化石墨烯,如氧化石墨烯(GO),还原氧化石墨烯(r-GO)等。这些功能化石墨烯表面含有大量的活性基团,比如羰基、羧基、羟基及环氧基等,这些基团使石墨烯具有良好的水溶性及生物相容性[8]。本文着重介绍了石墨烯及其衍生物在骨科的应用及其相关研究,并为未来其在基础及临床研究提供理论依据及物质基础。
中国科学院上海应用物理所黄庆课题组在2010年首先研究并报道了石墨烯在抗菌方面的研究[9]。他们的研究发现氧化石墨烯悬液在与大肠杆菌孵育2h后抑菌率达到90%以上,其抗菌性的主要原理是基于氧化石墨烯对大肠杆菌细胞膜的机械切割破坏。同时,Liu等[10]研究发现氧化石墨烯和还原氧化石墨烯都可以氧化细菌体内的还原型谷胱甘肽,因此认为氧化石墨烯及还原氧化石墨烯的抗菌性除了来自对细胞膜的破坏外,还可能来自其引发的氧自由基进而诱发的氧化损伤。最近几年发现一种新的石墨烯抗菌机理,认为石墨烯不但可以通过接触切割作用对细菌细胞膜进行破坏,还可以通过大规模的直接抽提细胞膜上的磷脂分子来破坏细胞膜并杀死细菌[11]。植入物的细菌感染一直是一个很大的临床问题,这通常和生物材料表面粘附和形成生物膜有关。而Kumar等[12]将聚已内脂(poly-caprolactone,PCL)与PCL/GO,PCL/rGO,PCL/AGO(胺功能化的氧化石墨烯)进行大肠杆菌的抗菌性试验,发现PCL/AGO的抗菌性最强,然后分析3种复合物的硬度、促细胞增殖、干细胞成骨分化、生物膜的抑制作用(图 2),得出AGO的作用最佳,更适合在骨科中应用(表 1)。
1.2 促成骨分化性
Keun等[13]将GO-Ti膜植入到大鼠缺损的颅骨中,发现GO-Ti膜显著提升了全层缺损颅骨的新骨生成并且没有发生炎症反应。这表明GO-Ti膜可有效地刺激成骨细胞分化并且展现出了优秀的生物活性。Elkhenany等[14]利用石墨烯作为支架促进成年山羊骨髓间充质干细胞增殖、分化为成骨细胞。Aryaei等[15]证明了石墨烯不会对成骨细胞产生毒性,并且可以显著地提高成骨细胞的粘附和增殖。
1.3 载药缓释性药物和生物活性分子可以直接转运至细胞内,但由于机体免疫系统,酶及其他因素的影响,通常在到达作用部位前即被降解或吸收,而有效的药物载体可以实现控制释放或缓慢释放,减少药物的毒副作用,提高疗效[16]。Liu等[17]在石墨烯生物学的应用方面做出了开创性的研究, 其用聚乙二醇(PEG)对石墨烯进行了表面修饰,增加石墨烯的溶解性,同时利用石墨烯表面存在的苯环结构与不溶性药物SN38和喜树碱通过π-π键堆积的方式结合,从而有效避免了以化学方式结合,利于药物在体内的有效释放。壳聚糖为一种优秀的药物的缓释基质,Chen等[18]首次将壳聚糖衍生物(CSD)及rGO与藻朊酸盐相混合制作成水凝胶珠用作小分子药物的载体。CSD/rGO/藻朊酸盐复合物凝胶珠在小分子荧光素钠中的载药效率达到了82.8%,在生理pH浓度下持续释放150h以上的释放率达到71.6%,在酸性介质下20h内即可快速释放82.4%的药物含量,并且细胞毒测试表明在肝星状细胞株中复合物凝胶珠表现了很小的细胞毒性。由此可见CSD/rGO/藻朊酸盐复合物凝胶珠是一种安全有效的药物载体。
2 石墨烯及其衍生物在骨科中的应用 2.1 用于生物材料石墨烯及其衍生物利用其独特的物理、化学及良好的生物相容性,能与其他材料相结合构成新的复合材料。
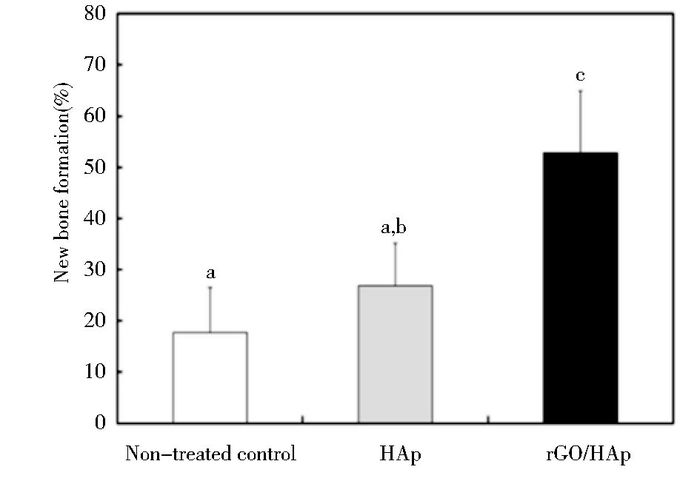
2.1.1 羟基磷灰石(hydroxyapatite, HAP)HAP具有特殊的生物活性、生物相容性和骨传导性,但拉伸强度和断裂强度较差,限制了其作为骨科材料的实际应用。以石墨烯作为增强材料,可改善HAp的力学性能,提高HA的强度[19]。Lee等[20]发现rGO和HAp形成的纳米复合物(rGO/HAp NCs)可以提高前成骨细胞MC3T3-E1的成骨分化并且促进新骨生成。免疫印迹分析显示rGO/HAp NCs可以显著增加骨钙蛋白和骨桥蛋白的表达水平。Feng等[21]建立了一种由石墨烯纳米片(GNSs)-碳纳米管(CNTs)-石墨烯纳米片(GNSs)构成的纳米三明治结构,来提高羟基磷灰石-聚醚醚酮(HAP-PEEK)支架的机械性能,原因为CNTs将两层GNSs分隔开,增大了支架和基质间的有效接触面积。并得出CNTs和GNSs最佳的重量比率为2:8,HAP-PEEK支架的抗压强度和系数分别增加了63.58%和56.54%,此外,将支架在模拟体液中浸泡过后,支架表面形成了磷灰石涂层,并且表面细胞都具有很好的粘附和离散性。结果表明CNTs和GNSs增强过的HAP-PEEK支架在骨组织工程中可作为一种很有前景的替代物。
2.1.2 超高分子量聚乙烯(ultra-high molecular weight polyethylene, UHMWPE)众所周知UHMWPE具有良好的耐磨性、抗腐蚀性和抗冲击韧性,但UHMWPE的表面硬度偏低,抗蠕变性能较差,会产生聚乙烯磨屑碎片,进而引起骨质溶解,限制了其作为人工骨关节材料的使用[22](图 3)。而将石墨烯与其构成复合材料,复合材料机械性能和生物相容性均有提高[23-24]。
PMMA目前广泛用于全关节置换,但与相邻骨不能形成很好的骨结合是它的一个显著缺点[19]。将GO作为增强剂加入PMMA-HA骨水泥中,GO对细胞功能和力学性能的提高产生了重要作用,形成的复合材料有较好的诱导磷酸钙层生长的能力,这样不仅提高了材料的力学性能,还使得成骨细胞的存活率显著提升并在水泥盘表面广泛生长,所以加入GO的复合骨水泥能显著增强其骨与骨之间的结合力[25]。
2.1.4 聚乙烯醇(ploy-vinyl alcohol,PVA)PVA也具有较好的生物相容性、可降解性和机械性能,但细胞亲和力很弱,所以一般都是与其他材料组成复合物植入体内。将GO加入到PVA中,不仅可增强PVA的力学性能,还有利于成骨细胞在支架表面生长和黏附[26]。
2.1.5 生物活性玻璃(bioactiveglass, BAG)BAG能够在植入部位形成与骨和软组织都良好结合的HA层。在生物活性玻璃中加入石墨烯不但能增强其电导率且不损害生物活性,同时能提升其力学性能[27]。
2.1.6 硅酸钙(CaSiO3, CS)CS是骨组织工程的生物活性材料,但在承载条件下CS的韧性较低。将GO与CS通过激光烧结等方法相结合,确实能够增强CS的力学性能、耐磨性、硬度、弹性模量、断裂韧性[28-30]。
上述物质都为关节外科常用的材料,将这些物质与石墨烯或其衍生物相结合,可增强性能、弥补不足,为今后人工关节材料的制作和发展提供了新的选择。
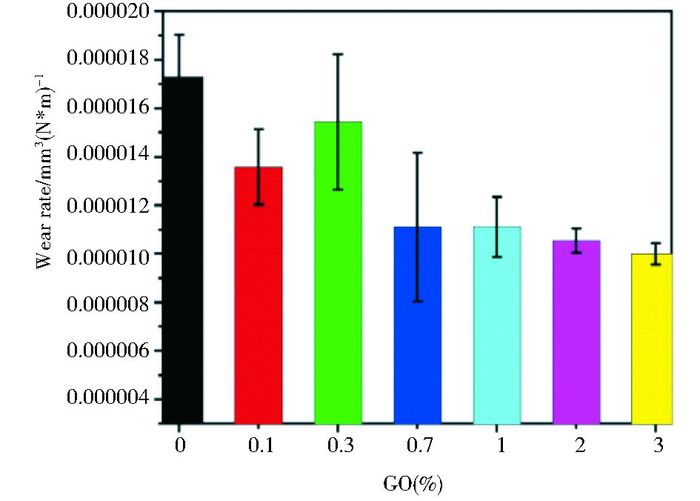
2.2 增加复合材料的摩擦磨损性Tai等[31]将GO纳米片与超高分子量聚乙烯(UHMWPE)相结合,发现当加入的GO纳米片的重量百分比为1wt%时UHMWPE的磨损率显著减少(图 4),而再增加GO的量UHMWPE/GO复合物的摩擦系数仅仅轻度升高,所以1wt%为最佳重量百分比。对于UHMWPE来说GO是一种优秀的抗磨损纳米填充物,因此UHMWPE/GO复合物在轴承材料的制作中具有良好的应用前景,或可制作成一种优秀的髋臼假体应用于髋关节或膝关节置换。Yan等[32]通过硅氢加成反应将超支化聚硅烷成功接枝到还原氧化石墨烯上(HBPSi-RGO),接着将HBPSi-RGO与双马来酰亚胺树脂(BMI)共混,制备了HBPSi-RGO/BMI复合材料。结果表明,当HBPSi-RGO的含量为0.6%时,HBPSi-RGO/BMI的摩擦因数和磨损率都达到最低,与纯BMI相比其摩擦因数和磨损率分别降低了44.6%和77.4%。这主要是因为在磨损过程中,HBPSi-RGO的薄片结构使复合材料的表面易形成摩擦转移层,这可以阻止两表面的直接接触。其次,复合材料机械性能的提高增加了复合材料的摩擦承受能力。
Saravanan等[33]发现将氧化石墨烯(GO)加入壳聚糖(CS)/明胶(Gn)制作的支架中可改进CS/Gn支架的多孔结构并使其更加接近骨的天然结构。当加入GO浓度为0.25%时CS/Gn支架的蛋白吸附作用、生物矿化作用和可控降解作用得到显著增强。研究发现0.25%GO/CS/Gn复合支架对大鼠的骨母细胞有较好的细胞亲和力,可促进大鼠间充质干细胞分化成成骨细胞,并可通过增加体内的胶原沉积加速大鼠胫骨骨缺损的修复,而且没有明显的细胞毒性。由此可见GO/CS/Gn生物支架在骨组织再生领域有很大的应用潜力。Wang等[34]用化学气相沉积法在镍泡沫基底上沉积石墨烯, 再旋涂聚己内酯(PCL)及聚偏氟乙烯(PVDF),最后用氯化铁将镍泡沫溶解得到聚合物富集的三维石墨烯泡沫(3DGFs)。3DGFs表现出高导电性、高弹性、高灵活性和可操作性,可应用于骨缺损的治疗等生物医学领域。
3 总结与展望综上所述,尽管石墨烯及其衍生物的研究及应用仍处于初期的阶段,但凭借优异且独特的特性成为近年来的研究热点。石墨烯所具有的众多特性更是使其成为生物医学领域的重点研究对象,尤其将来在骨科具有很好的应用前景。如抗菌性可应用于骨关节外科,降低或预防关节置换术后感染的发生;而增加复合材料耐磨性并可与生物材料相结合,可应用于关节假体增加假体的耐磨性并延长假体的使用年限;载药缓释性可将石墨烯与相关药物相结合(如抗菌、抗结核或抗肿瘤药物等)置入关节腔或髓腔内,并且石墨烯自身便具有抗菌性,利用石墨烯的多重特性,从而达到药物缓释及治疗目的;促骨组织再生将来可用于治疗骨缺损等。但是目前还存在许多尚未解决的问题,如石墨烯及其衍生物潜在的生物毒性,是否有良好的细胞相容性等问题需要通过进一步的动物体内及临床试验来研究论证。但凭借其在生物医学及组织工程领域极大的应用前景,将来可为骨科的研究和发展提供理论依据及物质基础。
| [1] |
Geim A K, Novoselov K S. The rise of graphene. Nature Materials, 2007, 6(3): 183-191. DOI:10.1038/nmat1849 |
| [2] |
Novoselov K S, Geim A K, Morozov S V, et al. Electric field effect in atomically thin carbon films. Science, 2004, 306(5696): 666-669. DOI:10.1126/science.1102896 |
| [3] |
Liu Z, Robinson J T, Sun X, et al. PEGylated nano graphene oxide for delivery of water-insoluble cancer drugs. J Am Chem Soc, 2008, 130(33): 10876-10877. DOI:10.1021/ja803688x |
| [4] |
Rana V K, Choi M C, Kong J Y, et al. Synthesis and drug-delivery behavior of chitosan-funetionalized graphene oxide hybrid nanosheets. Macromole Mater Eng, 2011, 296(2): 131-140. DOI:10.1002/mame.v296.2 |
| [5] |
Hu W, Peng C, Luo W, et al. Graphene-based antibacterial paper. ACS Nano, 2010, 4(7): 4317-4323. DOI:10.1021/nn101097v |
| [6] |
Shi J, Guo J, Bai G, et al. A graphene oxide based fluorescence resonance energy transfer (FRET) biosensor for ultrasensitive detection of botulinum neurotoxin A (BoNT/A) enzymatic activity. Biosens Bioelectron, 2015, 65(3): 238-244. |
| [7] |
Liu Z, Robinson J T, Sun X, et al. PEGylated nanographene oxide for delivery of water-insoluble cancer drugs. Journal of the American Chemical Society, 2008, 130(33): 10876-10877. DOI:10.1021/ja803688x |
| [8] |
Barinov A, Malcioglu B, Fabris S, et al. Initial stages of oxidation on graphitic surfaces:photoemission study and density functional theory calculations. J Phys Chem C, 2009, 113(21): 9009-9013. DOI:10.1021/jp902051d |
| [9] |
Hu W, Peng C, Luo W, et al. Graphene -based antibacterial paper. ACS Nano, 2010, 4(7): 4317-4323. DOI:10.1021/nn101097v |
| [10] |
Liu S, Zeng T H, Hofmann M, et al. Antibacterial activity of graphite graphite oxide, graphene oxide and reduced graphene oxide:membrane and oxidative stress. ACS Nano, 2011, 5(9): 6971-6980. DOI:10.1021/nn202451x |
| [11] |
Tu Y, Lv M, Xiu P, et al. Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets. Nat Nano, 2013, 8(8): 594-601. DOI:10.1038/nnano.2013.125 |
| [12] |
Kumar S, Raj S, Kolanthai E, et al. Chemical functionalization of graphene to augment stem cell osteogenesis and inhibit biofilm formation on polymer composites for orthopedic applications. ACS Appl Mater, 2015, 7(5): 3237-3252. DOI:10.1021/am5079732 |
| [13] |
Keun O P, Jong H L, Ji H P, et al. Graphene oxide-coated guided bone regeneration membranes with enhanced osteogenesis:Spectroscopic analysis and animal study. Applied Spectroscopy Reviews, 2016, 51(7-9): 540-551. DOI:10.1080/05704928.2016.1165687 |
| [14] |
Elkhenany H, Amelse L, Lafont A, et al. Graphene supports in vitro proliferation and osteogenic differentiation of goat adult mesenchymal stem cells:potential for bone tissue engineering. J Appl Toxicol, 2015, 5(4): 367-374. |
| [15] |
Aryaei A, Ahalapitiya H J, Ambalangodage C J. The effect of graphene substrate on osteoblast cell adhesion and proliferation. J Biomed Mater Res A, 2014, 102(9): 3282-3290. DOI:10.1002/jbm.a.v102.9 |
| [16] |
Liu F Z, Fan Z J, Wang J Q. Preparation of graphene and its applications in biomedicine. Materials China, 2015, 34(7-8): 589-594. |
| [17] |
Liu Z, Robinson J T, Sun X, et a1. PEGylated nano graphene oxide for delivery of water-insoluble cancer drugs. J Am Chem Soc, 2008, 130(33): 10876-10877. DOI:10.1021/ja803688x |
| [18] |
Chen K H, Ling Y Z, Cao C, et al. Chitosan derivatives/reduced graphene oxide/alginate beads for small-molecule drug delivery. Materials Science and Engineering, 2016, 69(12): 1222-1228. |
| [19] |
Zhao W K, Zhang S Y, Yang Q M, et al. Research progres of graphene and derivatives nanocomposite in orthopedics application. Journal of Biomedical Engineering, 2016, 3(33): 604-608. |
| [20] |
Lee J H, Shin Y C, Lee S M, et al. Enhanced osteogenesis by reduced graphene oxide/hydroxyapatite nanocomposites. Nature Scientific Reports, 2015, 5(12): 1-13. |
| [21] |
Feng P, Peng S P, Wu P, et al. A nano-sandwich construct built with graphene nanosheets and carbon nanotubes enhances mechanical properties of hydroxyapatite-polyetheretherketone scaffolds. International Journal of Nanomedicine, 2016, 11(7): 3487-3500. |
| [22] |
Brachdel P, Bistolfi A, Bracco P, et al. UHMWPE for arthroplasty:past or future?. J Orthop Traumatol, 2009, 10(1): 1-8. DOI:10.1007/s10195-008-0038-y |
| [23] |
Lahiri D, Dua R, Zhang C, et al. Graphene nano-platelet-induced strengthening of ultrahigh molecular weight polyethylene and biocompatibility in vitro. ACS Appl Mater Interfaces, 2012, 4(4): 2234-2241. DOI:10.1021/am300244s |
| [24] |
Chen Y F, Qi Y Y, Tai Z X, et al. Preparation, mechanical properties and biocompatibility of graphene oxide/ultrahigh molecular weight polyethylene composites. Eur Polym J, 2012, 48(6): 1026-1033. DOI:10.1016/j.eurpolymj.2012.03.011 |
| [25] |
Goncalves G, Portol S M, Ram Rezsantillan C, et al. Evaluation of the in vitro biocompatibility of PMMA/high-load HA/carbon nanostructures bone cement formulations. J Mater Sci Mater Med, 2013, 24(12): 2787-2796. DOI:10.1007/s10856-013-5030-2 |
| [26] |
Qi Y Y, Tai Z X, Sun D F, et al. Fabrication and characterization of poly(vinyl alcohol)/graphene oxide nanofibrous biocomposite scaffolds. J Appl Polym Sci, 2013, 127(3): 1885-1894. DOI:10.1002/app.37924 |
| [27] |
Porwal H, Grasso S, Reece M, et al. Review of graphene-ceramic matrix composites. Advances in Applied Ceramics, 2013, 112(8): 443-454. DOI:10.1179/174367613X13764308970581 |
| [28] |
Shuai C J, Gao C D, Feng P, et al. Graphene-reinforced mechanical properties of calcium silicate scafolds by laser sintering. RSC Adv, 2014, 4(25): 12782-12788. DOI:10.1039/C3RA47862A |
| [29] |
Xie Y T, Li H Q, Zhang C, et al. Graphene-reinforced calcium silicate coatings for load-bearing implants. Biomed Mater, 2014, 9(2): 025009. DOI:10.1088/1748-6041/9/2/025009 |
| [30] |
Mehrali M, Moghaddam E, Shirazi S F, et al. Synthesis, mechanical properties, and in vitro biocompatibility with osteoblasts of calcium silicate-reduced graphene oxide composites. ACS Appl Mater Interfaces, 2014, 6(6): 3947-3962. DOI:10.1021/am500845x |
| [31] |
Tai Z X, Chen Y F, An Y F, et al. Tribological behavior of UHMWPE reinforced with graphene oxide nanosheets. Tribol Lett, 2012, 46(1): 55-63. DOI:10.1007/s11249-012-9919-6 |
| [32] |
Yan H, Li S, Jia Y, et al. Hyperbranched polysiloxane grafted graphene for improved tribological performance of bismaleimide composites. RSC Adv, 2015, 5(17): 12578-12582. DOI:10.1039/C4RA13134G |
| [33] |
Saravanan S, Chawla A, Vairamani, M, et al. Scaffolds containing chitosan, gelatin and graphene oxide for bone tissue regeneration in vitro and in vivo. International Journal of Biological Macromolecules, 2017, 034(1): 1-11. |
| [34] |
Wang J K, Xiong G M, Zhu M, et al. Polymer-enriched 3d graphene foams for biomedical applications. ACS Applied Materials & Interfaces, 2015, 7(15): 8275-8283. |
 2017, Vol. 37
2017, Vol. 37