文章信息
- 杨青, 汪斌, 王亚伟, 张华山, 熊海容, 张莉.
- YANG Qing, WANG Bin, WANG Ya-wei, ZHANG Hua-shan, XIONG Hai-rong, ZHANG Li.
- 介导两种半纤维素酶分泌表达的信号肽比较
- Comparison of Signal Peptides for Two Hemicellulase Secretory Expression
- 中国生物工程杂志, 2017, 37(8): 15-22
- China Biotechnology, 2017, 37(8): 15-22
- http://dx.doi.org/DOI:10.13523/j.cb.20170803
-
文章历史
- 收稿日期: 2017-02-27
2. 湖北工业大学发酵工程省部共建教育部重点实验室 武汉 430068
2. Key Laboratory of Fermentation Engineering, Ministry of Education, Hubei University of Technology, Wuhan 430068, China
木聚糖酶和甘露聚糖酶是两种重要的半纤维素酶,在半纤维素的降解中起着非常重要的作用。目前越来越多的木聚糖酶和甘露聚糖酶被发掘且应用于食品、饲料、造纸等行业[1-4]。酶制剂的工业生产和应用中,需要性质优异的酶,因此高效分泌表达重组外源蛋白的基因工程菌受到越来越多的关注。巴斯德毕赤酵母表达系统是目前应用非常广泛的外源蛋白表达系统,已成功表达了多种外源蛋白,且其中一些外源蛋白的表达可达到每升克级的水平(g/L)[5],但也仍有很多外源蛋白的表达量相对较低,因此提高毕赤酵母表达外源蛋白的水平是减少工业生产成本的一个重要手段。
信号肽是实现外源蛋白分泌表达的重要元件,信号肽的功能主要是调节蛋白前体的折叠,引导蛋白质的穿膜转运,对蛋白质的分泌起着至关重要的作用[6-7]。已有的研究结果显示不同的信号肽对同一蛋白的引导效率是不一样的。石艺平等[8]通过二维电泳的数据分析,结合毕赤酵母的基因组测序结果筛选出7种毕赤酵母中高分泌水平的蛋白,将这7种蛋白的信号肽和来自酿酒酵母的α-factor用于漆酶的表达,结果显示不同信号肽介导表达的漆酶酶活差别较大。因此,在外源蛋白表达的研究中,寻找合适的信号肽对提高外源蛋白的表达量具有重要意义。
目前毕赤酵母表达系统中应用最广泛的信号肽是来自酿酒酵母的α-factor[9-10]。但α-factor对引导小分子多肽和蛋白的分泌非常有效,而对大分子蛋白的分泌优势并不明显[11]。其它来源的信号肽也在毕赤酵母中逐渐得到应用,包括PHO1、SUC2、一些蛋白自身的信号肽等[12-13]。也有一些毕赤酵母内源的信号肽被逐渐挖掘出来,Liang等[14]预测并验证获得了3个毕赤酵母内源的信号肽,Scw11、Dse4和Exg1,将其用于EGFP和CALB的表达,结果发现3个信号肽均能有效地介导两种外源蛋白的表达,且Dse4和Exg1的分泌效率甚至比α-factor更优秀一些。
本实验室前期研究中获得了两种耐热半纤维素酶-木聚糖酶DSB[15]和甘露聚糖酶ManA[16],具有很好的工业应用前景。为提高DSB和ManA在毕赤酵母中的胞外酶活,本研究选择了上述3种毕赤酵母内源信号肽,Scw11、Dse4和Exg1,分别分泌表达DSB和ManA,并与α-factor进行比较,从而选择适合DSB和ManA高效表达的信号肽。
1 材料与方法 1.1 材料 1.1.1 菌种与质粒含木聚糖酶DSB基因的质粒pPIC9K/DSB和含甘露聚糖酶ManA基因的质粒pPIC9K/ManA由研究室构建并保藏。表达载体pPICZαA、巴斯德毕赤酵母X33、大肠杆菌Top10均由实验室保藏。
1.1.2 工具酶及试剂限制性内切酶、PrimeSTAR Max DNA聚合酶、T4 DNA连接酶等工具酶及DNA marker、蛋白质marker购自TaKaRa公司;TaKaRa Bradford Protein Assay Kit购自碧云天公司;质粒小量提取试剂盒、DNA凝胶回收试剂盒、PCR清洁试剂盒等购自上海AxyPrep公司;底物燕麦木聚糖和角豆胶购于Sigma公司;蛋白胨和酵母提取物购自于Oxoid公司;无氨基酵母氮源YNB、山梨醇和琼脂购自Biosharp公司;博来霉素Zeocin购自Invitrogen公司;其他试剂均为国产或进口分析纯。
1.1.3 培养基大肠杆菌培养基LB、毕赤酵母培养基YPD、毕赤酵母抗性选择平板YPDSZ(含抗生素Zeocin,终浓度100μg/ml),毕赤酵母生长/诱导培养基BMGY/BMMY等培养基配方见Invitrogen公司毕赤酵母操作手册。
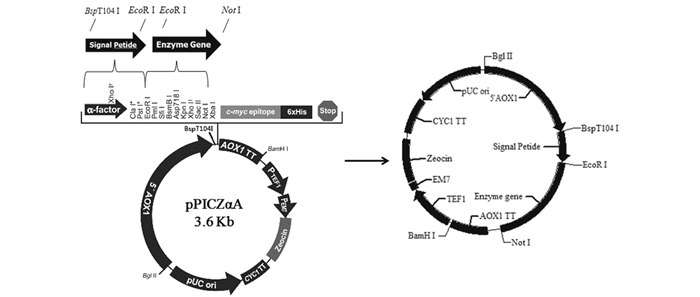
1.2 方法 1.2.1 不同信号肽基因的克隆及表达载体的构建本研究中采用的信号肽Scw11、Dse4和Exg1的基因序列见表 1,设计的引物见表 2,并在5′端和3′端分别引入限制性内切酶BspT104I和EcoRI位点(下划线标记)。以毕赤酵母X33基因组为模板,PCR扩增获得各信号肽的基因片段,与质粒pPICZαA同时进行双酶切,然后分别进行连接从而将不同信号肽的基因片段定向插入pPICZαA质粒中(图 1),构建含有不同信号肽的毕赤酵母表达载体,并送至武汉擎科生物有限公司进行测序验证。
| 信号肽 | 基因序列(5′→3′) |
| Scwll | ATGCTATCAACTATCTTAAATATCTTTATCCTGTTGCTCTTCATACAGGCATCCCTACAG |
| Dse4 | ATGTCATTCTCTTCCAACGTGCCACAACTTTTCTTGTTGTTGGTTCTGTTGACCAATATAGTCAGTGGA |
| Exgl | ATGAACTTGTACCTAATTACATTACTATTCGCCAGTCTATGCAGCGCA |
| 信号肽 | 引物 | 引物序列(5'→3') | 酶切位点 |
| Scwll | SCW11F | CC TTCGAAACGATGCTATCAACTATC | BspT104 Ⅰ |
| SCW11R | GT GAATTCCTGTAGGGATGCCTG | EcoR Ⅰ | |
| Dse4 | DSE4F | GC TTCGAAACGATGTCATTCTCTTCC | BspT104 Ⅰ |
| DSE4R | GCT GAATTCTCCACTGACTATATTGGTC | EcoR Ⅰ | |
| Exgl | EXG1F | GGC TTCGAAACGATGAACTTGTACC | BspT104 Ⅰ |
| EXG1R | GT GAATTCTGCGCTGCTGCATAGACTG | EcoR Ⅰ |
|
| 图 1 基于不同信号肽的重组质粒构建 Figure 1 Construction of recombinant plasmids based on different signal peptides |
实验室前期构建的含DSB和ManA基因的质粒pPIC9K/DSB和pPIC9K/ManA中,DSB和ManA基因片段两端的酶切位点为EcoRI和NotI,与1.2.1中构建的3种信号肽表达载体及pPICZαA同时进行双酶切,连接后转化大肠杆菌Top 10,使用AOX1通用引物进行菌落PCR验证获得阳性转化子[17],并送至武汉擎科生物有限公司进行测序验证。
1.2.3 重组酵母的构建、筛选及诱导表达采用SacⅠ分别线性化上述构建的基于不同信号肽的DSB和ManA表达载体,之后采用电转化法转化宿主菌毕赤酵母X33,涂布于YPDSZ抗性筛选平板上,30℃倒置培养约3天。使用AOX1通用引物对平板上长出的转化子进行菌落PCR验证获得阳性转化子。将各阳性转化子接种于含有25ml BMGY培养基的250ml三角瓶中,30℃、250r/min培养至OD600达到2.0~6.0,取适量体积的菌悬液8 000r/min离心去上清,将菌体重悬于含有25 ml BMMY培养基的250 ml三角瓶中,使每瓶BMMY培养基中重组菌的起始OD600为1.0。每隔24h取样,并补加1%甲醇,连续培养至144h。以毕赤酵母X33作为阴性对照。所有实验数据均重复3次。
1.2.4 重组酵母拷贝数鉴定目的基因拷贝数显著地影响目的蛋白的表达量,在考察信号肽分泌能力的时候,有必要排除拷贝数对表达量的影响。用酵母基因组提取试剂盒提取各重组菌的基因组,然后采用real-time quantitative PCR以双标准曲线的方法测定目的基因的拷贝数[18]。
1.2.5 重组菌上清及胞内酶活力的测定取样后离心收集上清,采用DNS法[19]测定各重组菌发酵上清液的木聚糖酶和甘露聚糖酶的酶活。此外还测定了各重组菌胞内的酶活,取适量的发酵液离心并去除上清,用磷酸氢二钠-柠檬酸缓冲液重悬洗涤菌体两次,然后再用等量的缓冲液重悬,加入适量酸洗玻璃珠振荡破碎30min[20],离心后收集上清,采用DNS法[18]检测木聚糖酶和甘露聚糖酶的酶活。
1.2.6 SDS-PAGE电泳分析及发酵上清液蛋白浓度的测定摇瓶发酵结束后,取等体积各重组菌的上清液及胞内溶液进行SDS-PAGE电泳分析,具体操作方法参考《分子克隆实验指南》第2版。采用Bradford法[21]测定蛋白质含量,以牛血清白蛋白BSA作为标准蛋白质,考马斯亮蓝G250为染色液,于595 nm检测吸光度。
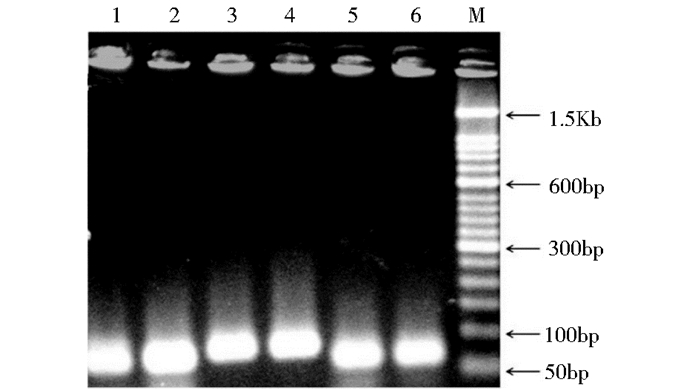
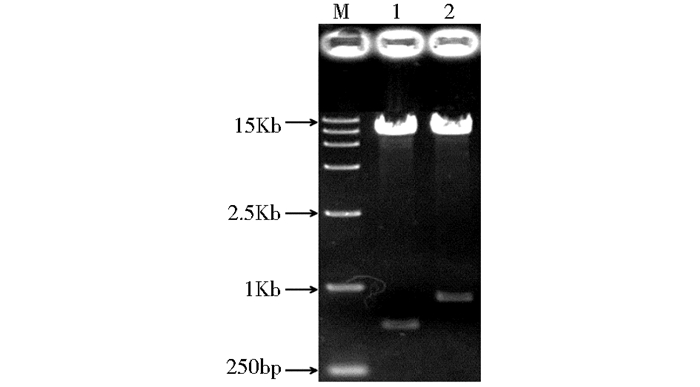
2 结果与分析 2.1 不同信号肽介导的DSB、ManA表达载体和重组菌的构建及拷贝数鉴定以提取的毕赤酵母X33基因组为模板,通过PCR扩增获得3个信号肽Scw11、Dse4和Exg1的基因片段,大小分别为79bp、89bp和68bp,与预期大小一致(图 2)。将上述3种信号肽的基因片段与pPICZαA同时使用BspT104I和EcoRI双酶切,然后分别连接获得含不同信号肽的质粒,命名为pPICZA-SCW11、pPICZA-DSE4和pPICZA-EXG1,测序结果与3个信号肽的基因序列一致,表明以上3个质粒构建成功。随后将以上3个质粒、pPICZαA、pPIC9K/DSB和pPIC9K/ManA同时用EcoRI和NotI进行双酶切,然后将DSB和ManA的基因片段(大小分别为585bp和852bp)(图 3)分别连接到4个含不同信号肽的质粒上获得不同信号肽介导的DSB和ManA表达载体,命名为pPICZA/SCW11-DSB(ManA)、pPICZA/DSE4-DSB(ManA)、pPICZA/EXG1-DSB(ManA)和pPICZαA/DSB(ManA),测序结果验证以上8个重组质粒构建成功。使用电转化的方法获得不同信号肽介导的DSB和ManA重组菌,分别命名为X33/SCW11-DSB(ManA)、X33/DSE4-DSB(ManA)和X33/EXG1-DSB(ManA),以X33/α-DSB(ManA)为对照。为了比较各信号肽引导外源蛋白分泌的能力,需排除报告基因的拷贝数的影响,采用实时荧光定量PCR的方法对各重组菌中报告基因的拷贝数进行了测定,结果如表 3所示,各重组菌均只含一个拷贝的报告基因,消除了基因剂量对外源蛋白表达的影响。
|
| 图 2 3个信号肽基因PCR产物的凝胶电泳 Figure 2 Gel electrophoresis of three signal peptide PCR production 1~2: Scw11; 3~4: Dse4; 5~6: Exg1;M: 50 bp DNA Ladder Marker |
|
| 图 3 DSB和ManA基因片段的凝胶电泳 Figure 3 Gel electrophoresis of DSB and ManA gene fragments 1: DSB; 2: ManA; M: DL 15 000 DNA Marker |
| 重组菌 | 拷贝数 |
| X33/α-DSB | 0.89 |
| X3/SCW11-DSB | 0.86 |
| X33/DSE4-DSB | 0.91 |
| X33/EXG1-DSB | 0.82 |
| X33/α-ManA | 0.94 |
| X33/SCW11-ManA | 0.87 |
| X33/DSE4-ManA | 1.06 |
| X33/EXG1-ManA | 0.91 |
2.2 不同信号肽对木聚糖酶DSB分泌表达水平的影响
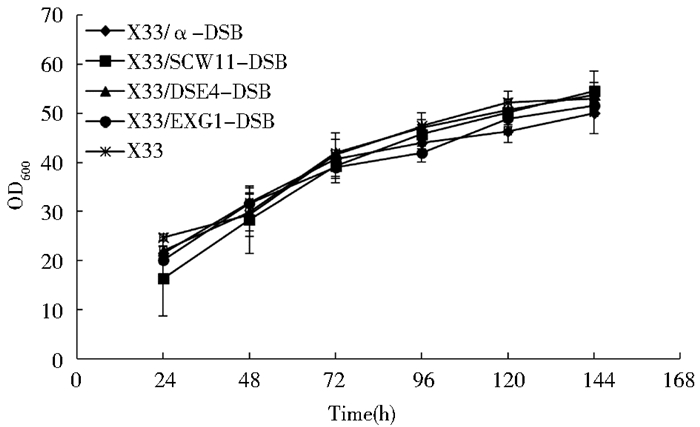
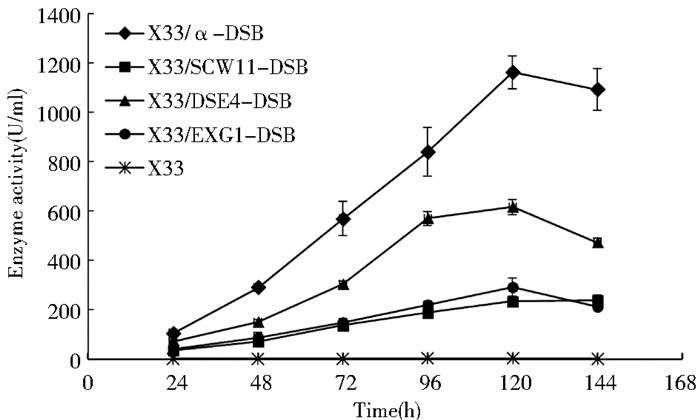
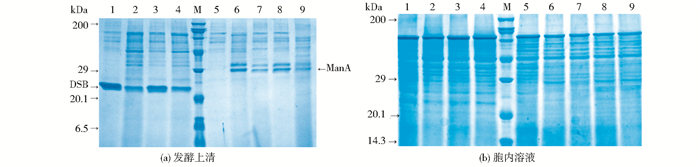
对X33/SCW11-DSB、X33/DSE4-DSB、X33/EXG1-DSB和X33/α-DSB在BMMY培养基中进行摇瓶发酵,每隔24h取样,测定发酵液菌体浓度及发酵上清液的酶活,每组实验均重复3次,取平均值作为最终结果。从图 4可以看出,不同信号肽对介导的DSB分泌表达的重组酵母生长状况无明显的影响,各重组菌生长良好。然而,在Scw11、Dse4、Exg1和α-factor 4种信号肽的引导下,DSB的上清液酶活水平差别较大,如图 5所示,X33/α-DSB发酵上清液的酶活最高,发酵至120 h时可达1162U/ml,约为X33/DSE4-DSB的1.9倍。但X33/DSE4-DSB的发酵上清液的酶活又明显高于X33/SCW11-DSB和X33/EXG1-DSB。当各重组菌发酵至144 h时,取相同体积的发酵上清液进行SDS-PAGE分析,结果如图 8所示,DSB大小为23kDa。同时对发酵上清液的蛋白浓度进行测定,得到各重组菌上清液中比酶活(表 4)的多少与酶活测定的结果一致。以上结果表明,木聚糖酶DSB在毕赤酵母X33中分泌表达时,α-factor介导的分泌表达效率明显优于Scw11、Dse4和Exg1。
|
| 图 4 不同信号肽介导的DSB重组酵母的生长曲线 Figure 4 Growth curve of recombinants for expression of DSB with different signal peptide |
|
| 图 5 不同信号肽介导的DSB重组酵母发酵上清液的酶活曲线 Figure 5 The DSB activity curve of recombinants with different signal peptide |
|
| 图 8 各重组菌发酵上清液和胞内溶液的SDS-PAGE电泳 Figure 8 SDS-PAGE analysis of supernatant(a) and intracellular sample(b) 1: α-DSB; 2:Scw11-DSB; 3:Dse4-DSB; 4:Exg1-DSB; M: Premixed Protein Marker(Broad); 5:X33; 6:α-ManA; 7: Scw11-ManA; 8: Dse4-ManA; 9:Exg1-ManA |
| 重组菌 | 胞外蛋白浓度(mg/L) | 胞外酶活(U/ml) | 胞外比酶活(U/m/) |
| X33/α-DSB | 1487 | 1092 | 734 |
| X33/SCW11-DSB | 1322 | 238 | 180 |
| X33/DSE4-DSB | 1313 | 471 | 359 |
| X33/EXG1-DSB | 1154 | 211 | 183 |
| X33/α-ManA | 474 | 394 | 835 |
| X33/SCWl1-ManA | 383 | 152 | 397 |
| X33/DSE-ManA | 442 | 371 | 839 |
| X33/EXG1-ManA | 309 | 176 | 570 |
2.3 不同信号肽对甘露聚糖酶ManA分泌表达水平的影响
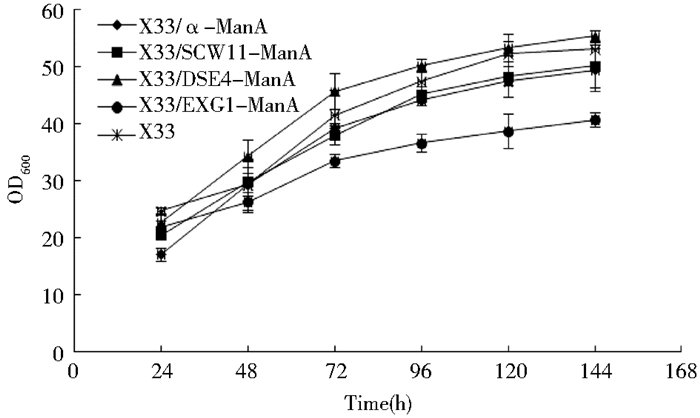
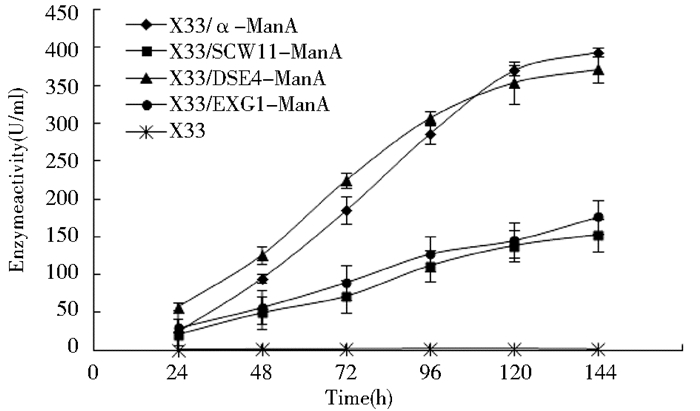
对X33/SCW11-ManA、X33/DSE4-ManA、X33/EXG1-ManA和X33/α-ManA在BMMY培养基中进行摇瓶发酵,发酵液菌体浓度及发酵上清液的酶活测定结果如图 6和图 7所示。从图 6可以看出,Scw11、Dse4和α-factor介导的ManA分泌表达重组酵母生长状况无明显差别,而Exg1介导的ManA分泌表达重组菌生长略差。对于ManA的上清液酶活水平来说,由图 7可知,使用不同信号肽时ManA的上清液酶活水平差别也较大,其中发酵前期X33/DSE4-ManA发酵上清液酶活力比X33/α-ManA高,在发酵至144 h时发酵上清液酶活力相当(都接近400 U/ml),但却明显高于X33/SCW11-ManA和X33/EXG1-ManA。对各重组菌的发酵上清液也进行了SDS-PAGE分析(图 8),结果表明ManA大小为30kDa。同时对发酵上清液的蛋白浓度进行测定,得到各重组菌上清液中比酶活的多少(表 4)与酶活测定的结果一致。上述结果显示,甘露聚糖酶ManA在毕赤酵母X33中分泌表达时,Dse4和α-factor介导的分泌表达效率明显优于Scw11和Exg1。
|
| 图 6 不同信号肽介导的ManA重组酵母的生长曲线 Figure 6 Growth curve of recombinants for expression of ManA with different signal peptide |
|
| 图 7 不同信号肽介导的ManA重组酵母发酵上清液的酶活曲线 Figure 7 The ManA activity curve of recombinants with different signal peptide |
为了分析不同信号肽介导DSB或ManA分泌表达时胞内滞留的情况,发酵结束后取等量的细胞进行破碎,对胞内溶液的酶活进行了测定且进行了SDS-PAGE电泳,结果如图 8和图 9所示。从图中可以看出,无论使用哪一种信号肽,DSB或ManA在重组菌胞内都有一定的滞留,但是分子量大一些的ManA的滞留酶活明显大于分子量小一些的DSB。且α-factor介导的DSB和ManA重组菌胞内酶活明显高于Scw11、Dse4和Exg1这3种内源信号肽,分别达到40.2U/ml和67.2U/ml。有研究指出α-factor对引导小分子多肽和蛋白的分泌非常有效,而对大分子蛋白的分泌优势并不明显[11]。因此在表达分子量较大的外源蛋白ManA时,可选用其它的信号肽,如Dse4,会减少外源蛋白在胞内的滞留从而在一定程度上提高外源蛋白的分泌量。
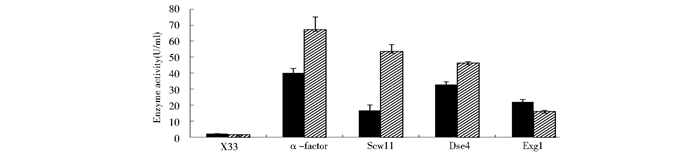
|
图 9
不同信号肽介导的重组酵母胞内酶活力的测定结果
Figure 9
DSB and ManA intracellular activity of recombinantswith different signal peptide
■: Intracellular activity of DSB;  :Intracellular activity of ManA :Intracellular activity of ManA
|
木聚糖酶和甘露聚糖酶是两种应用广泛的半纤维素酶,本实验室前期研究中获得的耐热木聚糖酶DSB[15]和耐热甘露聚糖酶ManA[16](最适反应温度均为75℃)具有较好的工业应用前景。不同的信号肽对同一外源蛋白的引导效率是不一样的,选择并使用高效的信号肽是提高毕赤酵母外源蛋白表达和节约生产成本的有效途径之一。
Liang等[14]的研究将内源的信号肽Scw11、Dse4和Exg1分别用于EGFP(分子质量为27kDa)和CALB(分子质量为36kDa)分泌表达,结果发现3个信号肽均能有效地介导两种外源蛋白的表达,且Dse4和Exg1的分泌效率甚至比α-factor更优秀一些。石艺平等[8]研究发现漆酶在毕赤酵母Exg1蛋白信号肽引导下菌株酶活力与漆酶自身信号肽引导下的活力差异不大。本研究选择了3种毕赤酵母内源信号肽Scw11、Dse4和Exg1,分别在毕赤酵母X33中分泌表达DSB和ManA,并与α-factor进行比较。摇瓶发酵的结果显示:对DSB(分子量为23kDa),使用α-factor时上清液酶活力与比酶活明显高于Scw11、Dse4和Exg1,胞外酶活达到1 162 U/ml;而对于ManA(分子量为30kDa),发酵前期X33/DSE4-ManA发酵上清液酶活力比X33/α-ManA高,且后期使用Dse4和α-factor时酶活力(接近400 U/ml)相当,但明显高于Scw11和Exg1。在外源蛋白表达时,寻找合适的信号肽是提高外源蛋白表达量的重要手段之一,因此由上述结果可知,在X33中表达DSB时应选用α-factor,而表达ManA时应选用Dse4或α-factor。胞内酶活的测定结果表明使用α-factor时,胞内DSB和ManA的滞留酶活显著高于其它3种内源信号肽,且分子量大小为30 kDa的ManA的滞留酶活又明显高于分子量大小为23kDa的DSB,因此在表达ManA蛋白时选用其它的信号肽(如Dse4),会在一定程度上减少外源蛋白在胞内的滞留。
为了进一步提高两种半纤维素酶的分泌表达效率,未来的工作可对Dse4进行改造,以使其在毕赤酵母表达系统中更好地发挥功能,进而为高效表达外源蛋白奠定基础。
致谢 本论文获得了中央高校基本科研业务费专项资金项目(CZW15026,CZW15012) 支持,特此致谢。| [1] |
陈威威, 江正强, 王瑞君. 绵毛嗜热丝孢菌木聚糖酶对面包品质的改善. 食品与发酵工业, 2008, 34(12): 1-4. Chen W W, Jiang Z Q, Wang R J. Effect of a thermostable xylanase from thermomyces lanuginosus on bread quality. Food and Fermentation Industries, 2008, 34(12): 1-4. |
| [2] |
张金伟. 甘露聚糖酶对动物生产性能的影响. 饲料工业, 2016, 37(12): 62-64. Zhang J W. Effects of the β-mannanase on the production performance of animals. Feed Industry, 2016, 37(12): 62-64. |
| [3] |
郝涤非. 木聚糖酶及其复合酶在面包生产中的应用与探索. 中国酿造, 2008, 27(16): 77-80. Hao D F. Application and exploration of xylanaseandrelatedcompoundenzymeinbreadproduction. China Brewing, 2008, 27(16): 77-80. |
| [4] |
杨少杰, 高海有, 李晞, 等. 甘露聚糖酶和木聚糖酶在纸浆漂白中的应用. 造纸科学与技术, 2016, 35(4): 71-76. Yang S J, Gao H Y, Li X, et al. Application of mannanase and xylanase in the pulp bleaching. PaperScience&Technology, 2016, 35(4): 71-76. |
| [5] |
王冶, 郑甲, 唐诗哲, 等. 外源蛋白在巴斯德毕赤酵母中高效分泌表达的前沿技术. 基因组学与应用生物学, 2014, 33(3): 689-694. Wang Y, Zheng J, Tang S Z, et al. Advance technologies of the efficient secretory expression of heterologous proteins in Pichia pastoris. Genomics and Applied Biology, 2014, 33(3): 689-694. |
| [6] |
Su L, Xu C, Woodard R W, et al. A novel strategy for enhancing extracellular secretion of recombinant proteins in Escherichia coli. Applied Microbiology and Biotechnology, 2013, 97(15): 6705-6713. DOI:10.1007/s00253-013-4994-7 |
| [7] |
Li S, Sing S, Wang Z. Improved expression of Rhizopus oryzae α-amylase in the methylotrophic yeast Pichia pastoris. Protein Expression & Purification, 2011, 79(1): 142-148. |
| [8] |
石艺平, 周雪, 胡美荣, 等. 不同信号肽对毕赤酵母表达漆酶的影响. 微生物学报, 2014, 54(12): 1446-1452. Shi Y P, Zhou X, Hu M R, et al. Effect of signal peptides on the expression of laccase in Pichia pastoris. Acta Microbiologica Sinica, 2014, 54(12): 1446-1452. |
| [9] |
Shen M, Wang Q, Mu X, et al. Expression, purification and characterization of recombinant human beta-amyloid 1-42 in Pichia pastoris. Protein Expr Purif, 2009, 63(2): 84-88. DOI:10.1016/j.pep.2008.09.015 |
| [10] |
Richter S, Nieveler J, Schulze H, et al. High yield production of a mutant Nippostrongylus brasiliensis acetylcholinesterase in Pichia pastoris and its purification. BiotechnolBioeng, 2006, 93(5): 1017-1022. |
| [11] |
Daly R, Hearn M T. Expression of heterologous proteins in Pichia pastoris:a useful experimental tool in protein engineering and production. Journal of Molecular Recognition, 2005, 18(2): 119-138. DOI:10.1002/(ISSN)1099-1352 |
| [12] |
Wege S, Khan G A, Jung J Y, et al. The EXS domain of PHO1 participates in the response of shoots to phosphate deficiency via a root-to-shoot signal. Plant Physiology, 2016, 170(1): 385-400. DOI:10.1104/pp.15.00975 |
| [13] |
Sun Q, Wang J S, Li R, et al. Establishment of suc2 signal sequence trap system. ActaGeneticaSinica, 2001, 28(4): 379-384. |
| [14] |
Liang S L, Li C, Ye Y R, et al. Endogenous signal peptides efficiently mediate the secretion of recombinant proteins in Pichia pastoris. BiotechnolLett, 2013, 35(1): 97-105. |
| [15] |
李思佳, 王亚伟, 付正, 等. 嗜热真菌木聚糖酶1YNA及其双硫键突变体在毕赤酵母中的表达. 中国生物工程杂志, 2013, 33(3): 74-79. Li S J, Wang Y W, Fu Z, et al. Expression of thermomyces lanuginosus xylanase 1YNA and its disulphide bridge mutantin Pichia pastoris. China Biotechnology, 2013, 33(3): 74-79. |
| [16] |
张巍, 王亚伟, 陈丰, 等. 一株全基因合成耐热甘露聚糖酶的表达及酶学性质分析. 中国生物工程杂志, 2014, 34(8): 41-46. Zhang W, Wang Y W, Chen F, et al. Gene synthesis, expression and characterization of a thermostable endo-β-1, 4-mannanase. China Biotechnology, 2014, 34(8): 41-46. |
| [17] |
Wang Y W, Shi P J, Luo H Y, et al. Cloning, over-expression and characterization of an alkali-tolerant endo-β-1, 4-mannanase from Penicillium freii F63. Journal of Bioscience and Bioengineering, 2012, 113(6): 710-714. DOI:10.1016/j.jbiosc.2012.02.005 |
| [18] |
Bharuthram A, Paximadis M, Picton A C, et al. Comparison of a quantitative Real-Time PCR assay and droplet digital PCR for copy number analysis of the CCL4L genes. Infection, Genetics and Evolution, 2014, 25(7): 28-35. |
| [19] |
余红英, 孙远明, 王炜军, 等. 枯草芽孢杆菌SA-22β-甘露聚糖酶的纯化及其特性. 生物工程学报, 2003, 19(3): 327-331. Yu H Y, Sun Y M, Wang W J, et al. Purification and properties of Bacillus subtilis SA-22 endo-1, 4-β-D-mannanase. Chinese Journal of Biotechnology, 2003, 19(3): 327-331. |
| [20] |
易弋, 容元平, 程谦伟, 等. 不同破壁方法提取酵母菌总RNA的比较. 食品科学, 2011, 32(11): 161-164. Yi G, Rong Y P, Cheng Q W, et al. Comparison of different cell wall disruption methods for yeast total RNA extraction. Food Science, 2011, 32(11): 161-164. |
| [21] |
Orna E, Tsaffrir Z. Linearization of the bradford protein assay. Journal of Visualized Experiments, 2010, 38(38): 1918. |
 2017, Vol. 37
2017, Vol. 37




