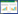文章信息
- 代立婷, 吴忠南, 黄翔, 杨杰, 曾慧兰, 王国才, 蒋建伟.
- DAI Li-ting, WU Zhong-nan, HUANG Xiang, YANG Jie, ZENG Hui-lan, WANG Guo-cai, JIANG Jian-wei.
- 卤地菊乙醇提取物W40单体诱导GLC-82细胞凋亡的分子机制研究
- Molecular Mechanism of Inducing GLC-82 Cells Apoptosis by Ethanol Extract from Wedelia prostrate(Hook.et Arn.) Hemsl
- 中国生物工程杂志, 2017, 37(8): 1-7
- China Biotechnology, 2017, 37(8): 1-7
- http://dx.doi.org/DOI:10.13523/j.cb.20170801
-
文章历史
- 收稿日期: 2017-05-23
- 修回日期: 2017-06-23
2. 暨南大学药学院中药及天然产物研究所 广州 510632
2. Institute of Traditional Chinese Medicine and Nature Products, Jinan University, Guangzhou 510630, China
肺癌是最常见的恶性肿瘤之一,全球由肺癌造成死亡人数高达10万,约19.4 %,位居第一[1-2]。肺癌通常分为两类,非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中非小细胞肺癌占肺癌所有发病率的80%左右[3]。由于肺癌缺乏有效的早期筛查手段,大多数肺癌患者确诊时已为晚期。NSCLC的常见治疗方法有手术、放疗和化疗,然而,我国肺癌的5年生存率仅为1%左右[4]。近年来,多项研究表明EGFR、ALK、c-MET、K-RAS、BRAF可作为NSCLC分子靶向治疗的相关靶点[5-6]。分子靶向治疗作为一种新型肿瘤治疗方案,通过研究特定基因的变化有助于开发个性化治疗,改善预后情况,延长患者生存率[7]。
卤地菊Wedelia prostrate(Hook. et Am.) Hemsl.为菊科蟛蜞菊属植物,一年生草本,适合生长于海岸干燥沙土地区[8]。在《福建民间草药》中,其别名为黄花龙舌草,具有清热解毒,祛痰止咳等功效,可用于治疗急性扁桃腺炎、喉蛾、喉痹、百日咳、肺热喘咳、鼻衄、痈疖疔疮等症状[9]。其化学成分研究表明,卤地菊主要含有黄酮类、萜类、有机酸类以及甾体类等化学活性成分[10]。有研究表明,卤地菊的醇提物显示具有良好的细胞毒作用,且其在结肠癌SW480细胞中诱导典型的凋亡细胞死亡[11]。
本课题组从卤地菊中分离纯化出7种单体,利用MTT法从中筛选出了具有明显抗肿瘤效果的活性单体W40化合物,根据化学上的系统命名法则命名为1β,9α-diacetoxy-4α-hydroxy-6β-isobutyroxyprostatolide[12], 其结构式见图 1a。经文献检索,尚未有W40单体抗肿瘤作用机制的报道。本文进一步探究W40对肺癌GLC-82细胞的抗肿瘤作用机制,并为W40的临床应用提供理论依据。
|
| 图 1 W40的化学结构及其对肿瘤细胞的影响 Figure 1 Chemical structure of W40 and its effect on different cancer cells (a) The chemical structure of W40(b~f) HepG2, MDA-MB-231, PC-9, GLC-82 and A549 cells were treated with W40 at various concentrations for 48 h |
卤地菊W40(C26H36O9)为本课题组库存分子。HepG2细胞、MDA-MB-231细胞、GLC-82细胞、PC-9细胞和A549细胞由中山大学附属肿瘤医院提供,Caspase -3、Caspase -9、PARP、Bax、Bcl-2、Mcl-1、Stat3、p-Stat3、BRAF、p-BRAF、MEK、ERK、p-MEK和GAPDH等一抗均购自美国Cell Sgnaling Technology, MTT和结晶紫购自美国Sigma公司,Annexin V—TC /PI双染试剂盒购自上海罗氏生物科技有限公司。
1.2 方法 1.2.1 细胞培养用DMEM/T12培养液含有10% FBS)培养HepG2细胞、MDA-MB-231细胞、GLC-82细胞、PC-9细胞和A549细胞,置于37℃、含5% CO2的恒温培养箱中常规培养。每两天更换新鲜培养液,细胞融合度达到80%左右时,用0.25%胰酶消化传代。
1.2.2 MTT法测定细胞增殖收集对数生长期的细胞接种在96孔板中,1 000个/孔,设置3个复孔,每孔含有培养液10 μl。待细胞贴壁后加人100 μl含有不同浓度药物的培养液,继续培养细胞24、48、72 h,实验终止前4 h每孔加人10 μl 5 mg/ml的MTT试剂并孵育4 h,弃去培养液,加人100 μl DMSO溶解结晶,待结晶全部溶解后,在酶标仪上检测570 nm波长下每孔的吸光度(OD值)并记录下结果,计算细胞存活率。存活率(%) =(A实验组/A对照组)×100%,实验重复3次。
1.2.3 克隆形成抑制实验取对数生长期的GLC-82细胞,胰酶消化后处理为细胞悬液,接种于6孔板中(800个/孔,连续培养14天后弃去上清液,用PBS洗涤细胞3次,用4 %多聚甲醛固定细胞30 min, 弃去固定液后,用0.1 %结晶紫染色30 min。轻轻冲洗后干燥,最后拍照记录结果。
1.2.4 细胞划痕实验取对数生长期的GLC-82细胞接种于6孔板中,培养24 h后细胞密度达到90 %左右,用200 μl的无菌枪头在铺满单层细胞的上面迅速划2道痕呈”十”字划痕。PBS洗去脱落细胞后,换为无血清培养液,设置DMS0对照组和加药组,每组3个复孔,置于37 ℃、含5 % CO2的恒温培养箱,分别取0 h、24 h和48 h作为观察时间点并拍照记录,比较细胞划痕修复速度及方式的差异。
1.2.5 流式细胞术检测细胞凋亡取对数生长期的GLC-82细胞接种于6孔板,加人不同浓度的药物以及DMS0作为对照组。24 h后收集细胞,1 200 r/min, 离心3 min,弃去上清液,PBS洗涤细胞2遍,加人500 μl Binding Buffer悬浮细胞,再加人5 μl Annexin V-FITC、5 μl PI混勻后于室温避光染色15 min,最后在流式细胞仪上检测细胞凋亡。
1.2.6 Western blotting检测相关信号通路蛋白用不同浓度的W40处理GLC-82细胞24 h,用预冷的PBS洗细胞2遍,加人细胞裂解液含蛋白酶抑制剂和磷酸酶抑制剂冰上裂解1 min,12 000 r/min,4℃离心15 min,吸取上清液转移到新的EP管中,用BCA法测定蛋白质浓度。取适量蛋白质上样至SDS-PAGE聚丙烯酰胺凝胶电泳,转膜,封闭。4℃一抗孵育过夜,TBST洗膜10 min/次,共3次; 二抗室温孵育2 h,TBST洗膜10 min/次,共3次; 于暗室发光显影洗片,扫描机扫描。
2 结果 2.1 W40对肺癌GLC-82细胞的细胞毒作用利用MTT法检测W40对肝癌HepG2细胞、乳腺癌MDA-MB-231细胞以及3种肺癌细胞株GLC-82、PC-9和A549细胞的细胞毒作用,见图 1(b~f)。结果显示,W40作用于乳腺癌MDA-MB-231、肺癌GLC-82和PC-9细胞的IC50分别为47.13±1.60、15.81±0.47和69.86±1. 31 μmol/L; 而W40作用于肝癌HepG2和肺癌A549细胞的IC50均大于80 μmol/L。其中W40对肺癌GLC-82细胞有较为明显的细胞毒作用,且呈现出剂量依赖关系。
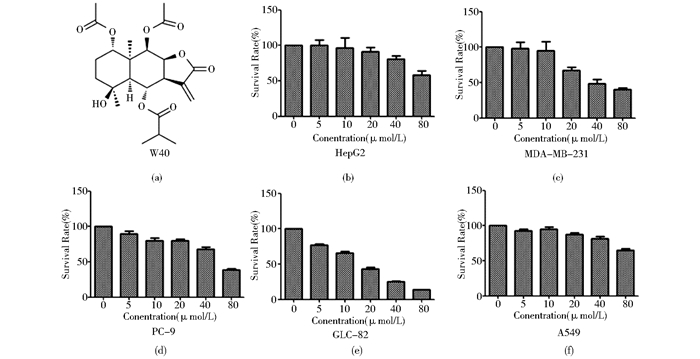
2.2 W40抑制肺癌GLC-82细胞的细胞迁移和细胞增殖利用细胞划痕实验检测W40对GLC-82细胞迁移能力的影响。与对照组比较,不同浓度W40(20μmol/L、40 μmol/L)处理GLC-82细胞24 h和48 h,细胞迁移能力受到抑制,并呈现浓度依赖性,见图 2a。同时,W40作用GLC-82细胞14天,与对照组相比,随着药物浓度増加,细胞克隆数显著减少,并且克隆体积显著变小。当药物浓度为5 μmol/L时,GLC-82细胞克隆几乎完全被抑制,见图 2b。
|
| 图 2 W40对肺癌GLC-82细胞迁移和增殖能力的影响 Figure 2 Effects of W40 on migration and colon formation on GLC-82 cells (a) GLC-82 cells migration was inhibited by W40 in does-dependent manner (b) W40 reduced colon formation of GLC-82 cells |
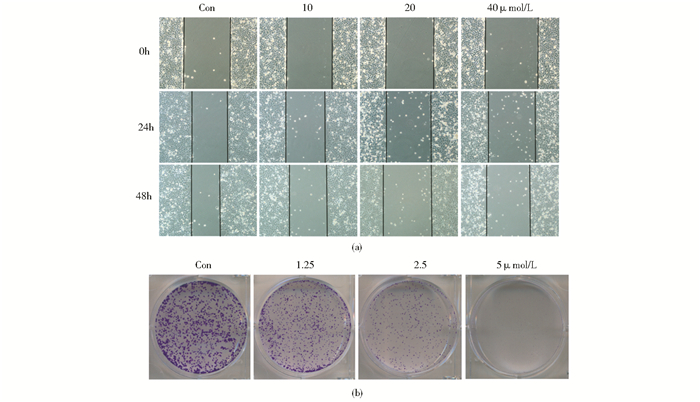
利用Annexin V-FITC/PI双染流式细胞术检测细胞凋亡,结果显示,W40诱导GLC-82细胞凋亡,且随着W40浓度的増加,GLC-82细胞的凋亡率逐渐升高。用不同浓度的W40 (0、10、20、40 μmol/L)处理GLC-82细胞24h,GLC-82细胞中早晚期细胞凋亡率分别为1.5%、3.4%、3.8%和31.1%,见图 3a。
|
| 图 3 W40对肺癌GLC-2细胞凋亡的影响 Figure 3 Effects of W40 on apoptosis of GLC-82 cells (a) GLC-82 cells apoptosis detected by Annexin V-FITC/PI double staining(b) The apoptosis of the GLC-82 cells threated with W40## Mean±SD. n=3. **P < 0.01, compared with control |
MAPK信号通路的异常活化会影响肿瘤的发生发展。ERK作为MAPK家族的成员之一,广泛存在于各MAPK信号通路的异常活化会影响肿瘤的发生发种组织,参与细胞的増殖、凋亡、分化的调控。为了研究W40是否通过MAPK/ERK信号通路来影响细胞凋亡,我们检测了涉及MAPK/ERK信号通路的相关蛋白的活化情况。当W40作用于GLC-82细胞24 h,随着W40作用浓度的増加,P-BRAF,P-MEK和P-ERK均表达下降,而BRAF,MEK和ERK的表达无明显变化,见图 4。这说明W40抑制了MAPK/ERK信号通路的活化,导致细胞凋亡发生。
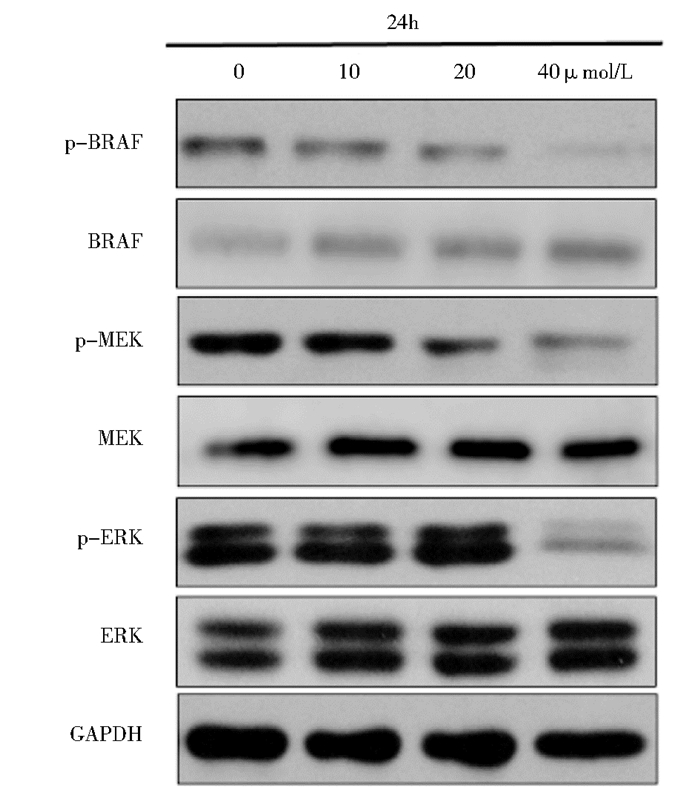
|
| 图 4 Western blotting检测MAPK/ERK信号通路相关蛋白 Figure 4 The expression level of MAPK/ERK signaling pathway |
细胞凋亡是由基因控制的自主、有序的死亡过程,它对于维持内环境的稳定具有十分重要的意义。细胞凋亡的基本过程是细胞感受到凋亡刺激信号后,调控凋亡的分子进行相互作用,促进蛋白水解酶Caspase)的活化,最后启动细胞发生凋亡。结果显示,当W40处理GLC-82细胞24 h后,随着药物浓度的増加,CaSpase-9、CaSpase-3活化,且PARP被切割,见图 5。Caspase-3剪切PARP后,破坏了其结构的完整性,使PARP失去其酶活力,加速细胞的不稳定,从而促进细胞凋亡。
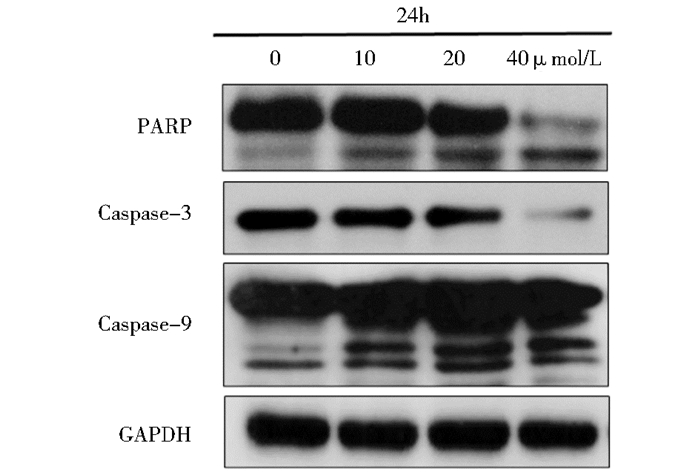
|
| 图 5 检测细胞凋亡相关蛋白的表达 Figure 5 The expression of apotosis-related proteins detected by the Western blotting |
在肿瘤发生中,异常激活的STAT蛋白能够调控某些与细胞増殖和存活相关基因的表达,因此我们检测了STAT信号通路。结果显示,当W40处理GLC-82细胞24 h后,随着药物浓度的増加,p-Stat3表达水平逐渐下降,其下游蛋白Mcl-1、Bcl-2表达下降,Stat3信号通路被抑制。此外,抗凋亡蛋白Bcl-2表达减少,促凋亡蛋白Bax表达増加,二者比值下降,促进了细胞凋亡。表明W40通过抑制Stat3信号通路而诱导肿瘤细胞发生凋亡,见图 6。
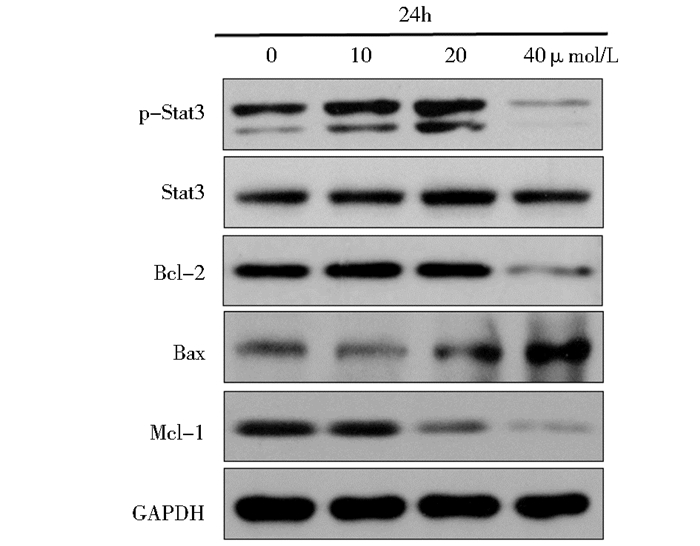
|
| 图 6 Western blotting检测Stat3信号通路相关蛋白 Figure 6 The expression level of Stat3 signaling patliway |
卤地菊Wedelia prostrate(Hook.et Arn.)Hemsl.为菊科蟛蜞菊属植物,在我国主要分布于广东、福建、台湾、浙江等地[13]。在《福建民间草药》的记载中,卤地菊可用于治疗急性扁桃腺炎、喉蛾、喉痹、百日咳、肺热喘咳、鼻衄、痈疖疔疮等症状。可发挥治喉蛾,喉痹,白喉,百日咳,肺热喘咳,鼻衄,痈肿,疔疮等功效[14]。实验研究表明,卤地菊提取物对白血病K562),肝癌(HePG2) 和胃癌SGC-7901) 均有一定的细胞毒作用,但其作用机制尚不明确[11]。
W40是本课题组从卤地菊乙醇提取物中提取的一种单体成分,同时三裂叶蟛蜞菊中也存在[12],但关于W40化合物的抗肿瘤机制研究尚缺乏相关报道。结果表明,我们通过MTT实验发现W40对肺癌GLC-82细胞有较为明显的细胞毒作用;克隆形成实验以及细胞划痕实验发现W40抑制肺癌GLC-82细胞増殖以及细胞迁移能力;Annexin V-FITC/PI双染实验发现W40诱导肺癌GLC-82细胞凋亡。
MAPKs家族由细胞外信号调节激酶(ERK),p38和c-Jun氨基末端激酶(JNK)组成。MAPK通过磷酸化核转录因子、细胞骨架蛋白及酶类等参与细胞増殖、分化、转化及凋亡的调节,并与炎症、肿瘤等多种疾病的发生密切相关[15-16]。MAPK/ERK信号通路是研究得比较清楚的一条通路。在外界因子的刺激下Ras激活,将Raf从胞浆转移到胞膜并激活,活化的Raf通过磷酸化MEK环上的丝氨酸残基而将其激活。MEK再将ERK激活,进而磷酸化许多与胞质和胞膜相连的底物[17]。ERK还可被快速地转位到细胞核激活AP-1、ELK-1、SAP等涉及増殖的转录分子,发挥促进细胞増殖、抑制细胞凋亡的作用[18]。
STAT蛋白作为转录因子,主要是调控宿主的应激反应,可广泛地调控细胞各种生理活动,包括细胞増殖,侵袭和凋亡[19]。特别是STAT3,通常在肿瘤处于持续激活状态,可诱导肿瘤恶性増殖和凋亡抑制[20]。在我们的研究中,W40抑制了STAT3的磷酸化,导致STAT3的下游靶基因的转录产物Bcl-2、Mcl-1等表达降低,Bcl-2不能与Ba结合,促进了Bax释放形成同源二聚体,抑制Bd-2的抗凋亡作用。同时,Bax形成同源二聚体可引起线粒体内、外膜之间的通透性转换孔开放,线粒体体膜电位下降,释放Cytochrome C,导致下游Caspase家族级联活化反应,引起内源性细胞凋亡;活化的Caspase还可以切割PARP,加速细胞的不稳定,共同促进细胞凋亡[21]。
本文发现W40能抑制肺癌GLC-82细胞的増殖和迁移能力,并且对其分子机制做了初步探讨。W40能在一定程度上抑制肺癌GLC-82细胞迁移能力,W40还能促进肺癌GLC-82细胞凋亡,细胞内抗凋亡蛋白Bcl-2表达降低而促凋亡蛋白Bax表达増加,同时W40能抑制STAT信号通路的靶基因的蛋白表达,促进细胞凋亡。此外,本实验显示W40还可以通过抑制MAPK/ERK信号通路发挥诱导细胞凋亡、抑制肺癌细胞増殖的作用,在治疗肺癌方面表现出良好的应用前景,这为卤地菊的临床应用提供了更多的理论依据。
致谢 本研究受到暨南大学科研培育与创新基金跃升计划11615424, 21615465) 的资助,特此致谢。| [1] |
Cheng T Y, Cramb S M, Baade P D, et al. The international epidemiology of lung cancer:Latest trends, disparities, and tumor characteristics. Journal of thoracic oncology:official publication of the International Association for the Study of Lung Cancer, 2016, 11(10): 1653-1671. DOI:10.1016/j.jtho.2016.05.021 |
| [2] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer Journal International du Cancer, 2015, 136(5): 359-386. DOI:10.1002/ijc.29210 |
| [3] |
Kenfield S A, Wei E K, Stampfer M J, et al. Comparison of aspects of smoking among the four histological types of lung cancer. Tobacco Control, 2008, 17(3): 198-204. DOI:10.1136/tc.2007.022582 |
| [4] |
Mao Y, Yang D, He J, et al. Epidemiology of lung cancer. Surgical Oncology Clinics of North America, 2016, 25(3): 439-445. DOI:10.1016/j.soc.2016.02.001 |
| [5] |
Hsu H C, Thiam T K, Lu Y J, et al. Mutations of KRAS/NRAS/BRAF predict cetuximab resistance in metastatic colorectal cancer patients. Oncotarget, 2016, 7(16): 22257-22270. DOI:10.18632/oncotarget.v7i16 |
| [6] |
Califano R, Abidin A, Tariq N U, et al. Beyond EGFR and ALK inhibition:unravelling and exploiting novel genetic alterations in advanced non small-cell lung cancer. Cancer Treat Rev, 2015, 41(5): 401-411. DOI:10.1016/j.ctrv.2015.03.009 |
| [7] |
Mok T S, Wu Y L, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. The New England Journal of Medicine, 2009, 361(10): 947-957. DOI:10.1056/NEJMoa0810699 |
| [8] |
Vieira H S, Takahashi J A, Boaventura M A. Constituents from aerial parts of Wedelia paludosa. Fitoterapia, 2001, 72(7): 854-856. DOI:10.1016/S0367-326X(01)00332-X |
| [9] |
Dai J, Zhu L, Yang L, et al. Chemical composition, antioxidant and antimicrobial activities of essential oil from Wedelia prostrata. EXCLI Journal, 2013, 12: 479-490. |
| [10] |
Ragasa C Y, Padolina W G, Bowden B F, et al. New eudesmanolide sesquiterpenes from a Philippines collection of Wedelia prostata. Journal of Natural Products, 1993, 56(3): 386-393. DOI:10.1021/np50093a011 |
| [11] |
Ma X H, Wang Z B, Zhang L, et al. Diterpenoids from Wedelia prostrata and their derivatives and cytotoxic activities. Chemistry & Biodiversity, 2017, 14(5): 1-8. |
| [12] |
Li Y, Hao X, Li S, et al. Eudesmanolides from Wedelia trilobata (L.) Hitchc. as potential inducers of plant systemic acquired resistance. Journal of Agricultural and Food Chemistry, 2013, 61(16): 3884-3890. DOI:10.1021/jf400390e |
| [13] |
Li X, Dong M, Liu Y, et al. Structures and biological properties of the chemical constituents from the genus Wedelia. Chemistry & Biodiversity, 2007, 4(5): 823-836. |
| [14] |
Miles D H, Chittawong V, Payne A M, et al. Cotton boll weevil antifeedant activity and antifungal activity (Rhizoctonia solani and Pythium ultimum) of extracts of the stems of Wedelia biflora. Jagricfood Chem, 1990, 38(7): 1591-1594. |
| [15] |
Pullikuth A K, Catling A D. Scaffold mediated regulation of MAPK signaling and cytoskeletal dynamics:a perspective. Cellular Signalling, 2007, 19(8): 1621-1632. DOI:10.1016/j.cellsig.2007.04.012 |
| [16] |
Huang C, Jacobson K, Schaller M D. MAP kinases and cell migration. Journal of Cell Science, 2004, 117(Pt 20): 4619-4628. |
| [17] |
Steelman L S, Chappell W H, Abrams S L, et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging. Aging (Albany NY), 2011, 3(3): 192-222. |
| [18] |
Boilly B, Vercoutter-Edouart A S, Hondermarck H, et al. FGF signals for cell proliferation and migration through different pathways. Cytokine & Growth Factor Reviews, 2000, 11(4): 295-302. |
| [19] |
Meyer T, Vinkemeier U. STAT nuclear translocation:potential for pharmacological intervention. Expert Opinion on Therapeutic Targets, 2007, 11(10): 1355-1365. DOI:10.1517/14728222.11.10.1355 |
| [20] |
Malemud C J. Negative regulators of JAK/STAT signaling in rheumatoid arthritis and osteoarthritis. Int J Mol Sci, 2017, 18(3): 484-493. DOI:10.3390/ijms18030484 |
| [21] |
Yao K, Xing H C, Wu B, et al. Effect of TIEG1 on apoptosis and expression of Bcl-2/Bax and Pten in leukemic cell lines. Genetics and Molecular Research:GMR, 2015, 14(1): 1968-1974. DOI:10.4238/2015.March.20.6 |
 2017, Vol. 37
2017, Vol. 37