文章信息
- 冯雪, 高香, 牛纯青, 刘堰.
- FENG Xue, GAO Xiang, NIU Chun-qing, LIU Yan.
- 密码子优化后的αB-晶状体蛋白基因毕赤酵母重组质粒的构建及表达的初步研究
- Construction of Pichia pastoris Expression Vector of Codon Optimized αB-crystallin Gene and Expression Optimization
- 中国生物工程杂志, 2017, 37(7): 42-47
- China Biotechnology, 2017, 37(7): 42-47
- http://dx.doi.org/DOI:10.13523/j.cb.20170709
-
文章历史
- 收稿日期: 2017-01-04
- 修回日期: 2017-02-12
αB-晶状体蛋白(αB-crystallin,Cryab)即α-晶状体蛋白B链,是眼晶状体蛋白的主要成分[1]。该蛋白质在非晶状体组织,包括中枢神经系统也有表达[2],Cryab作为小分子热休克蛋白(small heat-shock protein,sHSP),具有分子伴侣活性功能,并能防止蛋白质积聚,起到保护细胞的作用。在阿尔茨海默病(Alzheimer’s disease,AD)患者大脑中Cryab的表达上调,在星形胶质细胞和小胶质细胞中发现Cryab主要限于老年斑和神经纤维缠结,表明Cryab与AD中淀粉样蛋白沉积相关,但其因果关系尚未知[3-5]。已有研究表明,Cryab蛋白通过与Aβ蛋白直接结合等方式有效地阻止Aβ蛋白的聚集及其细胞毒性作用[6-7]。
近来研究发现[8],Cryab作为一种小分子热激蛋白,在一些磷酸化激酶的调节网络中扮演重要角色,而异常磷酸化蛋白与AD发病时神经纤维聚集有关。在血清缺乏和有毒试剂刺激下,通过激活MAPK、PI3K / Akts信号通路和抑制脑内线粒体产生活性氧(ROS),外源的Cryab保护星形胶质细胞免于细胞死亡,起有效的细胞保护作用[9]。Papuc′等[10]研究指出,AD患者Cryab上调会引发体液免疫应答,IgM和IgG自身抗体的滴度增加可用作疾病生物标志物。人Cryab可能是衰老细胞和组织中内源性保护机制的一个重要组成部分。人Cryab的多功能活性源自暴露在分子表面上的相互作用肽序列。多个非共价相互作用序列可以解释Cryab对未折叠蛋白质起作用的选择性和灵敏性[11]。因此,得到具有生物学活性的Cryab对于研究外源Cryab在AD中对星形胶质细胞的保护机制,进而探索AD发病机制和治疗具有重要意义。为进一步研究外源Cryab在AD中对星形胶质细胞的保护机制奠定基础。
随着蛋白质重组技术的发展和重组多肽类药物在临床中的应用,Cryab主要在大肠杆菌中表达[12-13]。毕赤酵母作为真核表达系统,相较于大肠杆菌等原核表达系统,具有较强的蛋白质加工修饰能力和先进的表达调控机制,如磷酸化、糖基化、酰胺化及蛋白质酶水解等蛋白功能。利用毕赤酵母进行分泌表达,具有杂蛋白少的特点,有利于重组目的蛋白的纯化。因此,我们期望通过毕赤酵母表达系统表达得到具有生物学活性、空间结构更加接近于天然蛋白的人Cryab。
1 材料与方法 1.1 实验材料Pichia pastoris整合型分泌表达质粒pPIC9K购自Invitrogen公司;毕赤酵母菌株GS115,宿主菌E.coli(DH5α)本实验室保存;各类限制性内切核酸酶、T4 DNA连接酶均购自TaKaRa公司,RNase购自上海生工公司; 引物由上海英俊(Invitrogen)公司完成;胶回收试剂盒、DNA纯化试剂盒购自天根生物。YPD、BMGY和BMMY培养基均按Invitrogen公司的毕赤酵母菌实验操作手册配制。
1.2 实验方法 1.2.1 Cryab密码子优化参照GenBank中Cryab基因序列,根据毕赤酵母密码子偏好,在不改变氨基酸序列的前提下,利用密码子优化软件对Cryab基因进行密码子优化,并在序列的5′端设计了Xho I酶切位点,在3′端设计了EcoR I酶切位点。将优化构建好的基因序列送至上海生工公司合成,合成的基因连接到pMD-18T载体中。
1.2.2 毕赤酵母表达载体的构建Cryab基因扩增:为便于目的蛋白用亲和层析法进行纯化,在Cryab全长序列上加入一段6个组氨酸的His标签。以pMD-18T载体(含有Cryab全长cDNA)为模板,用合成的上游引物和下游引物(表 1)进行PCR扩增。
| Primer name | Primer sequence (5′-3′) |
| Forward | CCGCTCGAGAAAAGAATGGACATCGCTATTCATCATCC(下划线为Xho I和Kex2酶切位点) |
| Reverse | GACGACGAGGATTCTTCGTAGTAGTAGTAGTAGTAGTATTCCTTAAGGCC(下划线为EcoR I酶切位点) |
重组载体的构建:将扩增得到基因和pPIC9K分别用Xho I和EcoR I进行酶切,将回收酶切后的目的基因片段与pPIC9K载体片段以摩尔浓度比3/1加入到PCR管中,加入T4 DNA连接酶后16℃连接过夜。将连接物转入大肠杆菌DH5α感受态细胞中,利用含有相应抗生素(Amp)的LB固体培养基进行筛选,经菌落PCR筛选阳性克隆大肠杆菌菌株,酶切鉴定后,进一步送至上海英潍捷基贸易有限公司测序。
Cryab毕赤酵母表达菌株的构建:提取质粒Cryab/pPIC9K,用Sac I酶切线性化后,电击法转化GS115感受态细胞。电转完成后涂布RDB平板,30℃培养48h左右,观察到酵母重组转化子的乳白色菌落出现。经菌落PCR鉴定阳性重组子,获得Cryab毕赤酵母表达菌株。
1.2.3 Cryab的鉴定和表达优化Cryab鉴定:表达上清经SDS-PAGE后,15V、40min电转移至聚偏氟乙烯(PVDF)膜上,于含5%脱脂奶粉的TBST溶液中4℃封闭过夜,一抗为His-Tag鼠抗兔37℃孵育1h,二抗为HRG标记的羊抗鼠IgG 37℃孵育2h,经过显影定影,通过目的条带在胶片的位置判断目的蛋白的表达情况和分子质量大小。
单因素优化:参照Invitrogen Multi-Copy Pichia Expression Kit手册,筛选到的阳性菌株进行小量诱导表达筛选高表达菌株。筛选到的高表达菌株进行大量表达,在其他条件一致的情况下进行单因素条件优化,分别对诱导时间、BMGY换成BMMY的转接比例、甲醇补加量进行优化分析。
正交优化:根据单因素条件优化结果,选用正交设计法的L9(34)表, 以甲醇为A因素(处理水平为0.5%、0.75%、1%),BMGY与BMMY的体积比为B因素(1:2、1:1、2:1), 发酵时间为D因素(处理水平为60h、72h、84h),按设计方案控制表达条件,以Cryab的浓度为指标,确定最优发酵方案。
1.2.4 Cryab纯化和鉴定利用最优发酵条件进行目的蛋白的表达,得到的发酵液进行离心去除菌体,将收集的上清用0.22μm滤膜过滤后,与Ni-6FF混合4℃过夜,进行上样,分别用50mmol/L和200mmol/L咪唑pH为7.4的PBS洗脱液进行分步洗脱,收集洗脱液,进行SDS-PAGE电泳检测。
利用蛋白质印迹法鉴定纯化得到的重组目的蛋白。
1.2.5 重组Cryab活性测定应用胰岛素还原实验检测[14]Cryab的分子伴侣活性,原理为Cryab具有分子伴侣活性,能够抑制还原剂引起的胰岛素B链聚集而产生的沉淀反应,从而判断重组蛋白是否有分子伴侣活性。
实验分为三组,分别为阴性对照组、阳性对照组和实验组。阴性对照组只加PBS缓冲液,阳性对照组加入胰岛素(0.8mg/ml 20mmol/L磷酸盐缓冲液)和还原剂二硫苏糖醇[dithiothreitol(DTT), 8.0mg/ml 20mmol/L磷酸盐缓冲液];实验组为胰岛素、DTT和Cryab(胰岛素与Cryab质量比为1:1)。利用分光光度计检测可见光值,记录数据;重复三次实验,取平均值,并作曲线图,进行统计学分析。
2 结果 2.1 密码子的优化通过调整G+C含量,在不改变氨基酸的前提下,对Cryab基因的密码子进行优化,其中涉及109个密码子的改变,覆盖86个氨基酸,并在终止密码子前加入了6*His纯化标签。
2.2 质粒Cryab/pPIC9K的构建及鉴定以合成的pMD-Cryab质粒为模板,利用上、下游引物进行目的基因扩增。经1%琼脂糖凝胶电泳检测,目的基因约546bp(图 1a),与预期大小一致。Cryab/pPIC9K质粒经Xho I/EcoR I酶切鉴定,其中一段与目的基因大小相符(546bp),证明Cryab已成功连接到pPIC9K载体上。经测序,进一步确定插入片段阅读框和方向是正确的。
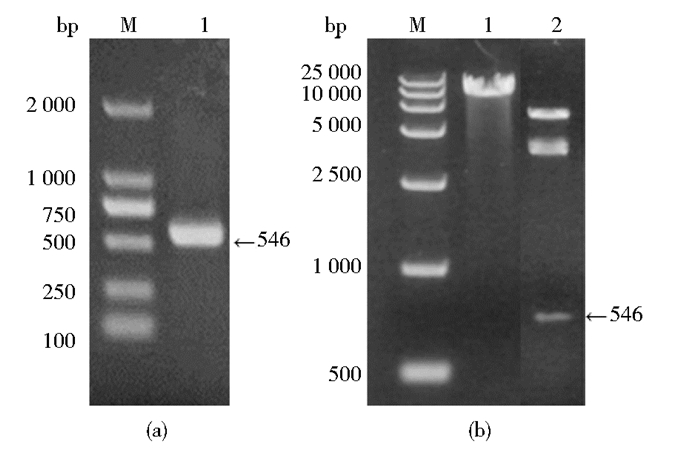
|
| 图 1 PCR产物凝胶电泳及重组质粒酶切鉴定 Figure 1 Gel electrophoresis of Cryab gene PCR products and identification of recombinant colonies by enzyme digestion (a) 1: Positive PCR results (b) 1: Recombinant plasmid digested with Sac I; 2: Recombinant plasmid digested with Xho I and EcoR I |
线性化的重组质粒电转化进入毕赤酵母GS115。菌落PCR鉴定,结果显示1、3~12、14~21泳道在500~750bp均出现了目的条带(图 2),表明外源基因和酵母染色体发生同源重组,获得了重组酵母菌株。
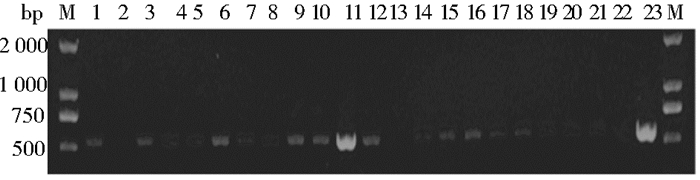
|
| 图 2 酵母菌落PCR结果 Figure 2 Yeast PCR screening results 1, 3-12, 14-21: Positive clones; 2, 13, 22: Negative clones; 23: Positive control |
对表达时间、转接比和甲醇补加量进行单因素优化,SDS-PAGE结果,显示诱导表达至60h、72h、84h时,发酵上清的目的蛋白含量相对较高(图 3a);转接比为1:1时,目的蛋白表达量最高(图 3c);每隔12h补加甲醇至终浓度0.75%,重组目的蛋白表达量最高(图 3d)。Western blotting分析出现分子质量为20kDa、18.6kDa、13.1kDa三条蛋白质片段(图 3b)。L9(34)正交优化实验结果表明,转接比为2:1、甲醇补加量为0.5%、发酵时间为72h时(表 2),重组蛋白表达量最高。
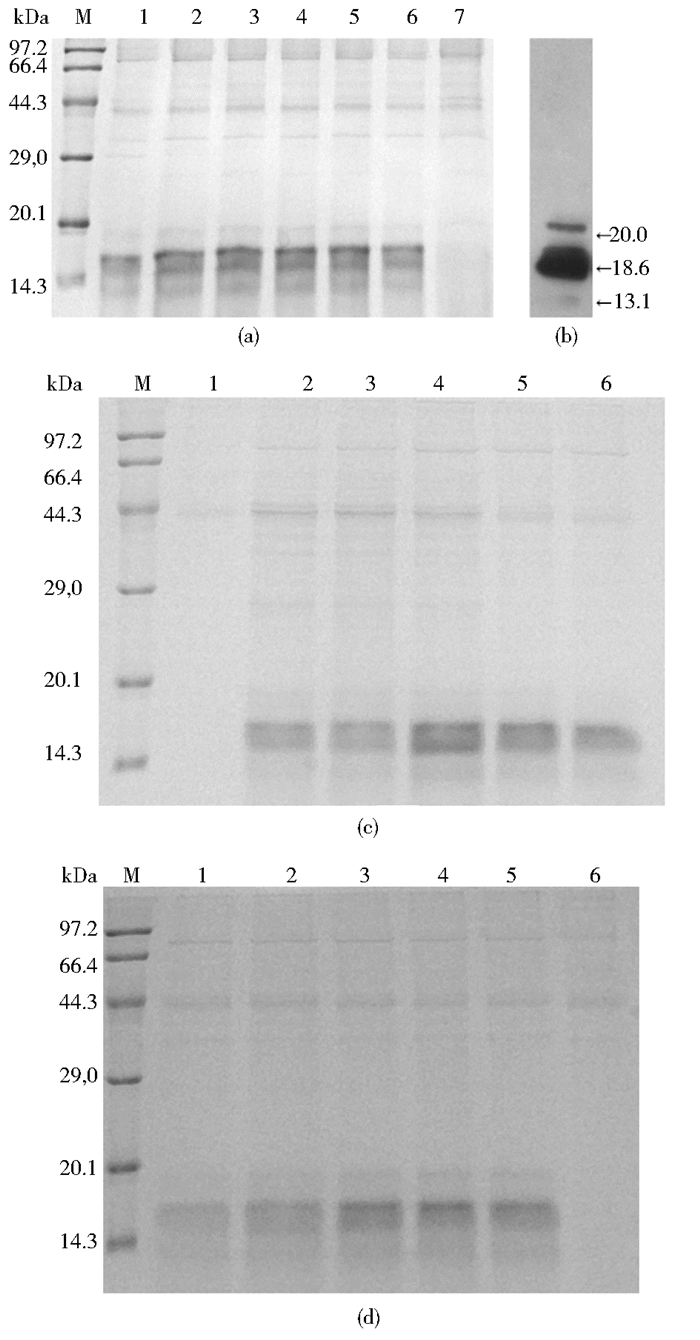
|
| 图 3 诱导时间、转接比、甲醇对重组Cryab的影响和Western blotting鉴定 Figure 3 Effect of induction time, transfer ratio and methanol concentration on the recombinant protein and Western blotting analysis (a) Induction time M: Low molecular weight protein marker; 1-6: Target protein with expressed by 36h, 48h, 60h, 72h, 84h, 96h; 7: Negative control (pPIC9K/GS115) (b) Western blotting analysis of recombinant protein (c) Transfer ratio 1: Negative control; 2-6: Transfer ratio of 1:3, 1:2, 1:1, 2:1, 3:1 (d) Methanol concentration 1-5: Methanol complement: 1.25%, 1.0%, 0.75%, 0.75%, 0.5%, 0.25%; 6: Negative control (pPIC9K/GS115) |
| Number | Transfer ratio | Methanol (%) | Expression time(h) | Protein concentration(mg/L) |
| 1 | 3:1 | 0.25 | 60 | 147.8 |
| 2 | 3:1 | 0.50 | 84 | 177.7 |
| 3 | 3:1 | 0.75 | 72 | 183.5 |
| 4 | 2:1 | 0.25 | 84 | 155.3 |
| 5 | 2:1 | 0.50 | 72 | 230.1 |
| 6 | 2:1 | 0.75 | 60 | 217.2 |
| 7 | 1:1 | 0.25 | 72 | 178.2 |
| 8 | 1:1 | 0.50 | 60 | 189.5 |
| 9 | 1:1 | 0.75 | 84 | 188.4 |
| k1 | 169.67 | 160.43 | 184.83 | |
| k2 | 200.87 | 199.10 | 192.27 | |
| k3 | 185.37 | 196.47 | 173.13 | |
| R | 30.33 | 38.67 | 19.14 |
2.5 重组蛋白的分离纯化及鉴定
发酵上清与Ni-6FF混合上样后,通过含有50mmol/L和200mmol/L咪唑的PBS洗脱,得到样品通过SDS-PAGE分析(图 4a),结果表明,重组蛋白全部挂柱,可见上样后的穿过峰溶液中没有重组蛋白,收集到的50mmol/L咪唑洗脱液中可见分子质量为18.6kDa的蛋白片段,200mmol/L咪唑洗脱液中可见分子为20kDa的蛋白质片段。经Western blotting鉴定,证实纯化得到的目的蛋白为20kDa(图 4b)。
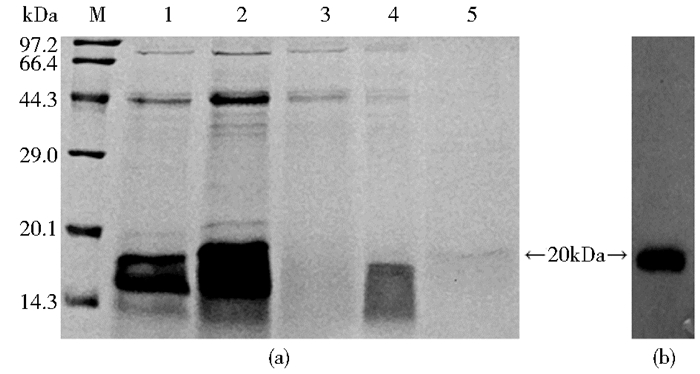
|
| 图 4 重组蛋白的纯化和Western blotting鉴定 Figure 4 Purification of recombinant protein and Western blotting analysis of recombinant protein (a) M: Low molecular weight protein marker; 1, 2: Fermentation supernatant; 3: Through peak; 4: 50mmol/L elution peak; 5: 200mmol/L elution peak (b) Western blotting analysis of recombinant protein |
| Purification step | Total volume (ml) | Total protein (mg) | Purity (%) | Percentage yield (%) |
| Fermentation supernatant | 200.0 | 59.8 | 78.9 | 100.0 |
| Ni-6FF | 30.0 | 12.0 | 98.0 | 24.9 |
2.6 Cryab的分子伴侣活性测定
用胰岛素还原实验对毕赤酵母表达的Cryab进行了分子伴侣活性检测,结果显示,阳性对照组A650吸收值高于实验组(图 6),说明毕赤酵母表达的Cryab具有生物活性,能抑制还原剂DTT引起的胰岛素B链聚集反应,说明重组目的蛋白具有分子伴侣活性。

|
| 图 6 Cryab分子伴侣活性测定 Figure 6 Detection of the molecular chaperones activity of recombinant aB-crystallin |
本实验根据毕赤酵母的密码子偏爱性对编码Cryab cDNA进行了优化,确保了目的蛋白在毕赤酵母中的顺利表达。成功构建了Cryab/pPIC9K载体,通过对表达条件进行优化,确定该菌株的最适表达条件为BMGY转接到BMMY的比例为2:1,发酵时间72h,每12h补加甲醇至终浓度0.5%,各个因素的影响依次为:甲醇浓度>转接比>发酵时间。
从NCBI上查得人的Cryab的分子质量为20kDa, 大肠杆菌表达得到的分子质量也为20kDa[15]。毕赤酵母表达的Cryab经SDS-PAGE及蛋白质印迹分析,发现分子质量分别为20kDa、18.6kDa及13.1kDa三条蛋白质片段,其中以18.6kDa为主,推测可能是在表达过程中Cryab出现了部分降解。在纯化过程中,我们发现这三种分子质量的蛋白质都能挂柱,200mmol/L咪唑洗脱获得纯化的分子质量为20kDa的Cryab条带。
迄今为止,利用毕赤酵母表达外源目的蛋白的工业技术已经相当成熟,但在表达载体构建时添加了Kex-2酶切位点后,仍然出现了目的蛋白降解的情况鲜有发生。通过查阅文献得知,毕赤酵母的液泡内存在各种蛋白水解酶,其水平根据营养条件而变化[16],其中主要的蛋白酶为蛋白酶A、蛋白酶B、羧肽酶和氨肽酶[17]。已有研究表明,当蛋白酶A过表达时,其会分泌到毕赤酵母胞外[18]。酵母细胞在遭受到饥饿环境、碳源、温度和pH的改变时细胞膜会发生裂解。在Sinha等[19]的研究中,甲醇营养型毕赤酵母利用AOX1启动子诱导蛋白质表达时,也触发了胞内蛋白酶的过表达和细胞裂解。因此推测在发酵过程中,由于酵母细胞的裂解,导致胞内蛋白酶释放到培养基中,导致目的蛋白的降解。此外,在甲醇营养型的巴斯德毕赤酵母中,利用甲醇代谢需要高氧,并且氧代谢将产生过氧化氢,过量有毒副产物的产生导致其分泌到细胞溶质,并最终到培养基中[20],在这些压力条件下,酵母细胞通过水解不必要的蛋白质,以提供氨基酸用于新蛋白质的合成[21]。我们的目的蛋白属于外源蛋白,在酵母利用甲醇进行代谢时,我们的目的蛋白可能被水解成氨基酸,用于其他蛋白质的合成。
利用胰岛素还原实验确定表达得到的重组αB-晶状体蛋白具有分子伴侣活性。
进一步可对Cyrab进行改构,以解决Cyrab降解问题;其次,可以比较毕赤酵母表达系统和大肠杆菌表达系统所得到的的Cryab的生物学活性,以及对于后续研究的影响,得到Cryab更适合的表达系统;纯化得到的蛋白质具有生物学活性,因此可以用来进行后续实验。为探究Cryab在阿尔兹海默病的发病机制扮演的角色,找到阿尔兹海默病治疗方法奠定基础。
| [1] |
Wistow G J, Piatigorsky J. Lens crystallins: the evolution and expression of proteins for a highly specialized tissue. Biochemistry, 1988, 57(57): 479-504. |
| [2] |
Bhat S P, Nagineni C N. B subunit of lens-specific protein α-crystallin is present in other ocular and non-ocular tissue. Biochem Biophys Res Commun, 1989, 158(1): 319-325. DOI:10.1016/S0006-291X(89)80215-3 |
| [3] |
Renkawek K, Voorter C E, Bosman G J, et al. Expression of alpha B-crystallin in Alzheimer's disease. Acta Neuropathol, 1994, 87(2): 155-160. DOI:10.1007/BF00296185 |
| [4] |
Björkdahl C, Sjögren M J, Zhou X, et al. Small heat shock proteins Hsp27 or αB-crystallin and the protein components of neurofibrillary tangles: Tau and neurofilaments. Journal of Neuroscience Research, 2008, 86(6): 1343-1352. DOI:10.1002/(ISSN)1097-4547 |
| [5] |
Mao J J, Katayama S, Watanabe C, et al. The relationship between aB-crystallin and neurofibrillary tangles in Alzheimer's diseases. Neuropathol Appl Neurobiol, 2001, 27(3): 180-188. DOI:10.1046/j.1365-2990.2001.00310.x |
| [6] |
Dehle F C, Ecroyd H, Musgrave I F, et al. αB-crystallin inhibits the cell toxicity associated with amyloid fibril formation by κ-casein and the amyloid-β peptide. Cell Stress and Chaperones, 2010, 15(6): 1013-1026. DOI:10.1007/s12192-010-0212-z |
| [7] |
Shammas S L, Waudby C A, Wang S, et al. Binding of the molecular chaperone αB-crystallin to Aβ amyloid fibrils inhibits fibril elongation. Biophysical Journal, 2011, 101(7): 1681-1689. DOI:10.1016/j.bpj.2011.07.056 |
| [8] |
Dammer E B, Lee A K, Duong D M, et al. Quantitative phosphoproteomics of Alzheimer's disease reveals cross-talk between kinases and small heat shock proteins. Proteomics, 2015, 15(2-3): 508-519. DOI:10.1002/pmic.201400189 |
| [9] |
Zhu Z, Li R, Stricker R, et al. Extracellular α-crystallin protects astrocytes from cell death through activation of MAPK, PI3K/Akt signaling pathway and blockade of ROS release from mitochondria. Brain Research, 2015, 1620: 17-28. DOI:10.1016/j.brainres.2015.05.011 |
| [10] |
Papuć E, Krupski W, Kurys-Denis E, et al. Antibodies against small heat-shock proteins in Alzheimer's disease as a part of natural human immune repertoire or activation of humoral response. J Neural Transm, 2016, 123(4): 455-461. DOI:10.1007/s00702-015-1477-2 |
| [11] |
Clark J I. Functional sequences in human alphaB crystallin. Biochimica Et Biophysica Acta, 2016, 1860(1PtB): 240-245. |
| [12] |
Sun T X, Das B K, Liang J J. Conformational and functional differences between recombinant human lens αA-and αB-Crystallin. J Biol Chem, 1997, 272(10): 6220-6225. DOI:10.1074/jbc.272.10.6220 |
| [13] |
Horwitz J, Huang Q L, Ding L, et al. Lens α-crystallin: Chaperone-like properties. Methods in Enzymology, 1998, 290(98): 365-383. |
| [14] |
Saha S, Das K P. Relationship between chaperone activity and oligomeric size of recombinant human alphaA-and alphaB-crystallin: a tryptic digestion study. Proteins Structure Function & Bioinformatics, 2004, 57(3): 610-617. |
| [15] |
Sun T X, Das B K, Liang J J. Conformational and functional differences between recombinant human lens alphaA-and alphaB-crystallin. Journal of Biological Chemistry, 1997, 272(10): 6220-6225. DOI:10.1074/jbc.272.10.6220 |
| [16] |
Hansen R J, Switzer R L, Hinze H, et al. Effects of glucose and nitrogen source on the levels of proteinases, peptidases, and proteinase inhibitors in yeast. Biochimica Et Biophysica Acta, 1977, 496(1): 103-114. DOI:10.1016/0304-4165(77)90119-2 |
| [17] |
Hb V D H, Kiellandbrandt M C, Winther J R. Review: biosynthesis and function of yeast vacuolar proteases. Yeast, 1996, 12(1): 1-16. DOI:10.1002/(SICI)1097-0061(199601)12:1<1::AID-YEA902>3.0.CO;2-N |
| [18] |
Rothman J H, Hunter C P, Valls L A, et al. Overproduction-induced mislocalization of a yeast vacuolar protein allows isolation of its structural gene. Proceedings of the National Academy of Sciences of the United States of America, 1986, 83(10): 3248-3252. DOI:10.1073/pnas.83.10.3248 |
| [19] |
Sinha J, Plantz B A, Inan M, et al. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeast Pichia pastoris: Case study with recombinant ovine interferon-τ. Biotechnology and Bioengineering, 2005, 89(1): 102-112. DOI:10.1002/(ISSN)1097-0290 |
| [20] |
Stevens T H, Rothman J H, Payne G S, et al. Gene dosage-dependent secretion of yeast vacuolar carboxypeptidase Y. Journal of Cell Biology, 1986, 102(5): 1551-1557. DOI:10.1083/jcb.102.5.1551 |
| [21] |
Hilt W, Wolf D H. Stress-induced proteolysis in yeast. Molecular Microbiology, 1992, 6(17): 2437-2442. |
 2017, Vol. 37
2017, Vol. 37




